名校
1 . 在生活中亚硝酸钠( )应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知:
)应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知: ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
①NO能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)盛放浓硝酸的仪器名称为___________ ;仪器按气流方向连接顺序为b→g→___________
(装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气排除装置中的空气,若不排除装置中的空气,可能导致产物中混有杂质___________ (填化学式):反应结束后打开止水夹a,继续通入过量氮气,其目的是___________ 。
(3)盛水的洗气瓶中发生的反应的化学方程式为___________ ;为了提高产率,可在该洗气瓶中加入铜片,请用化学反应方程式解释加入铜片的作用___________ 。
Ⅱ.测定的纯度:
(4)准确称取反应后的固体2.500g于烧杯中,加入煮沸并冷却的蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,向锥形瓶中滴加0.1 的酸性
的酸性 溶液,当溶液恰好变为浅红色时停止滴加,共消耗酸性
溶液,当溶液恰好变为浅红色时停止滴加,共消耗酸性 溶液10.00mL,计算所得固体中
溶液10.00mL,计算所得固体中 的纯度为
的纯度为___________ %。
 )应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知:
)应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知: ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
①NO能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)盛放浓硝酸的仪器名称为
(装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气排除装置中的空气,若不排除装置中的空气,可能导致产物中混有杂质
(3)盛水的洗气瓶中发生的反应的化学方程式为
Ⅱ.测定的纯度:
(4)准确称取反应后的固体2.500g于烧杯中,加入煮沸并冷却的蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,向锥形瓶中滴加0.1
 的酸性
的酸性 溶液,当溶液恰好变为浅红色时停止滴加,共消耗酸性
溶液,当溶液恰好变为浅红色时停止滴加,共消耗酸性 溶液10.00mL,计算所得固体中
溶液10.00mL,计算所得固体中 的纯度为
的纯度为
您最近一年使用:0次
2 . 某中学研究性学习小组的以黄铁矿 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程:
(1)在空气中焙烧黄铁矿的化学方程式为:__________________________ 。
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示( )。
)。__________ 。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式_____________________ 。检验反应Ⅱ所得的滤液中所含阴离子的方法是____________________________ 。
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得 的操作为:
的操作为:__________ 、__________ 、过滤、洗涤、干燥。
(5)反应①反应方程式是______________ 。从反应①至④制取高纯多晶硅的过程中可以循环利用的物质有____________________ 。
 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程: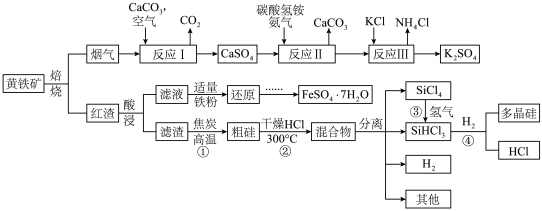
(1)在空气中焙烧黄铁矿的化学方程式为:
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示(
 )。
)。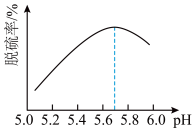
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得
 的操作为:
的操作为:(5)反应①反应方程式是
您最近一年使用:0次
3 . 以粗盐和石英砂为原料制备纯碱和精硅的流程如下图所示,结合题意回答下列问题:__________ 。__________ 气体。 ,其含有的化学键为
,其含有的化学键为__________ 。
(4)流程7的化学方程式__________ 。
(5)流程9整个制备过程必须严格控制无氧,若混入 ,可能引起的后果是
,可能引起的后果是__________ 。
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。



 ,其含有的化学键为
,其含有的化学键为(4)流程7的化学方程式
(5)流程9整个制备过程必须严格控制无氧,若混入
 ,可能引起的后果是
,可能引起的后果是(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。

| A.混有杂质硼的硅晶棒熔点低于纯硅 |
| B.熔炼前,可以用普通玻璃管替换石英保温管 |
| C.熔炼时,加热环移动速度过快可能导致杂质硼分离不彻底 |
| D.熔炼后,硅晶棒纯度右端高于左端 |
您最近一年使用:0次
4 . 工业上用以下转化过程生产硝酸及其相关产品。请回答:

(1)写出步骤①的化学方程式:___________ 。
(2)下列说法正确的是___________。
(3)室温下, 极易溶于水,原因是
极易溶于水,原因是___________ 。请设计实验证明 极易溶于水:
极易溶于水:___________ 。
(4)步骤⑦同时释放出转化流程中的一种气体,写出步骤⑦的化学方程式:___________ 。

(1)写出步骤①的化学方程式:
(2)下列说法正确的是___________。
| A.步骤③O2过量有利于提高硝酸浓度 | B.步骤④⑤中硫酸所起的作用完全相同 |
| C.硝化纤维洗净后隔绝空气大火烘干 | D.通过①②③制得的硝酸的质量分数不超过 |
(3)室温下,
 极易溶于水,原因是
极易溶于水,原因是 极易溶于水:
极易溶于水:(4)步骤⑦同时释放出转化流程中的一种气体,写出步骤⑦的化学方程式:
您最近一年使用:0次
5 . 锂辉矿(主要成分为LiAlSi2O6)可用低温重构—直接浸出技术制备碳酸锂,同时得到氧化铝,工艺流程如图。下列说法错误的是

A.“水热反应”为 |
| B.“滤渣1”和“滤渣2”主要成分相同 |
| C.冶炼金属锂和金属铝均可用电解其熔融氯化物的方法 |
| D.流程中不涉及氧化还原反应 |
您最近一年使用:0次
2024-03-20更新
|
573次组卷
|
2卷引用:广东省广州市黄广中学2023-2024学年高一下学期期中错题专项考化学试题
名校
6 . I、现有一份含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。(可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水。)回答下列问题:
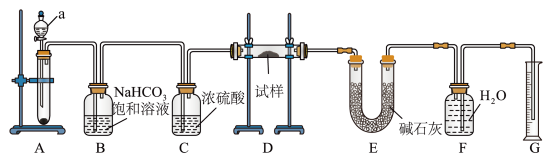
(1)装置a的名称为_______ 。
(2)装置B的作用:_______ 。
(3)装置D中生成O2的反应的化学方程式为_______ 。
(4)装置E中的碱石灰的主要作用是_______ ;若撤掉装置E,会使测得的Na2O2的含量_______ (选填“偏高”,“偏低”,“无影响”)。
(5)已知装置D中试样质量为15.6g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数_______ 。
Ⅱ、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为_______ 。
A.先通CO2再通NH3 B.先通NH3再通CO2

(1)装置a的名称为
(2)装置B的作用:
(3)装置D中生成O2的反应的化学方程式为
(4)装置E中的碱石灰的主要作用是
(5)已知装置D中试样质量为15.6g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数
Ⅱ、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为
A.先通CO2再通NH3 B.先通NH3再通CO2
您最近一年使用:0次
名校
解题方法
7 . 某同学设计用下图的装置制备少量的 (易与水反应)。下列说法错误的是
(易与水反应)。下列说法错误的是

 (易与水反应)。下列说法错误的是
(易与水反应)。下列说法错误的是
A.B装置中所装试剂为饱和的 溶液,其作用是除去氯气中的 溶液,其作用是除去氯气中的 |
| B.装置F中的试剂为浓硫酸,其作用是防止水蒸气进入E中 |
C.用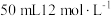 的盐酸与足量的 的盐酸与足量的 反应,所得氯气可以制取 反应,所得氯气可以制取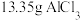 |
| D.实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯 |
您最近一年使用:0次
名校
8 . 碘化亚铁 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。 )
)
(1)装置中盛碱石灰的仪器名称为_____ 。若无此装置,写出铁粉参与的副反应的化学方程式:_____ 。
(2)收集器浸泡在冷水中的原因是_____ 。
(3)试剂a为_____ ,其作用是_____ 。
Ⅱ、化学兴趣小组为了探究 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
甲同学认为:是因为被 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。
随后化学兴趣小组进行如下实验进行验证。
(4)上述实验②中现象为_____ 。化学兴趣小组得到的结论: 的还原性
的还原性_____  的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(5)依据(4)中所得结论,试写出往过量 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:_____ 。
 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。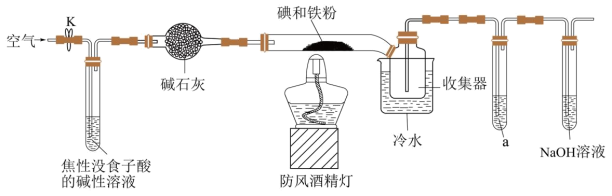
 )
)(1)装置中盛碱石灰的仪器名称为
(2)收集器浸泡在冷水中的原因是
(3)试剂a为
Ⅱ、化学兴趣小组为了探究
 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:甲同学认为:是因为被
 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。随后化学兴趣小组进行如下实验进行验证。
| 实验步骤 | 现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加淀粉溶液 | 试管中溶液变蓝色 | 甲同学观点正确 |
②取少量黄色溶液于试管中,滴加 溶液 溶液 | 乙同学观点不正确 |
(4)上述实验②中现象为
 的还原性
的还原性 的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(5)依据(4)中所得结论,试写出往过量
 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:
您最近一年使用:0次
2024-02-16更新
|
154次组卷
|
3卷引用:广东省茂名市高州中学2023-2024学年高一下学期期中考试化学试题
名校
9 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。
Ⅰ.如图为联合制碱法的主要过程(部分物质已略去):

(1)根据上述流程图,将化学方程式补充完整:______ 。
NH3+CO2+______+______=NaHCO3↓+______。
(2)上述联合制碱法流程可以循环使用的中一种物质是______ (填化学式)。
Ⅱ.某小组利用下列装置对Na2CO3和NaHCO3的性质进行探究(夹持装置已略去,气密性已检查)。

(3)方框中为洗气装置,请将该装置图补充完整______ 。
(4)试剂a为饱和NaHCO3溶液,其作用是______ 。
(5)实验持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因______ 。
Ⅰ.如图为联合制碱法的主要过程(部分物质已略去):

(1)根据上述流程图,将化学方程式补充完整:
NH3+CO2+______+______=NaHCO3↓+______。
(2)上述联合制碱法流程可以循环使用的中一种物质是
Ⅱ.某小组利用下列装置对Na2CO3和NaHCO3的性质进行探究(夹持装置已略去,气密性已检查)。

(3)方框中为洗气装置,请将该装置图补充完整
(4)试剂a为饱和NaHCO3溶液,其作用是
(5)实验持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因
您最近一年使用:0次
2024-02-11更新
|
84次组卷
|
2卷引用:广东省鹤山市第一中学2023-2024学年高一上学期第二阶段考试化学试卷
名校
解题方法
10 . ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2,成为自来水的消毒剂。已知ClO2是一种易溶于水的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2C1O2+2NaCl,下图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品已省略),其中E用于除去ClO2中的未反应的Cl2。___________ 。
(2)写出装置A中烧瓶内发生反应的离子方程式:___________ 。
(3)B装置中所盛试剂是___________ 。
(4)F为ClO2收集装置,应选用的装置是___________ (填序号),其中与E装置导管相连的导管口是___________ (填接口字母)。
①请写出该反应的化学方程式:___________ ,每消耗319.5gNaClO3,生成___________ L氯气(标况下)。(M(NaClO3)=106.5)。
②浓盐酸在该反应中表现出来的性质是___________ (填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
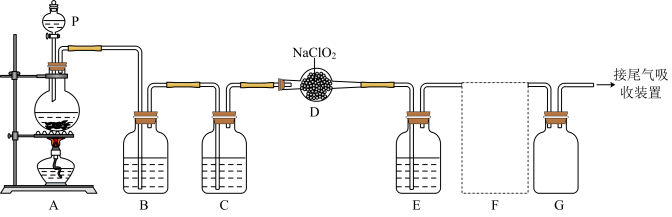
(2)写出装置A中烧瓶内发生反应的离子方程式:
(3)B装置中所盛试剂是
(4)F为ClO2收集装置,应选用的装置是

①请写出该反应的化学方程式:
②浓盐酸在该反应中表现出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
您最近一年使用:0次
2024-02-02更新
|
145次组卷
|
3卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题



