解题方法
1 . 碳酸锶( )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
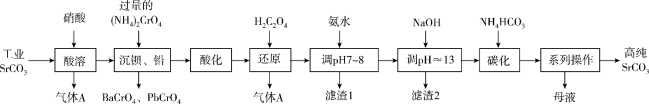
已知:I. 为两性氢氧化物;
为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的化学式为_______ ;基态Cr原子的价层电子排布图为_______ 。
(2)酸溶时为了加快酸溶速率,可适当升高温度,但升温度又不能过高的原因是_______ 。
(3)“系列操作”是煮沸并趁热过滤、_______ 。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ (用化学方程式回答)。
(5)“调pH≈13”后,需对溶液进行煮沸并趁热过滤出“滤渣2”,“滤渣2”的主要成分为_______ (填化学式);要煮沸并趁热过滤的目的是_______ 。
(6)“还原”时含Cr微粒发生反应的离子方程式为_______ 。
(7)“碳化”时,实际所用 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
_______ t(保留到小数点后两位)。
 )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
已知:I.
 为两性氢氧化物;
为两性氢氧化物;II.常温下,各物质的溶度积常数如下表所示。
| 化合物 |  |  |  |  |
 近似值 近似值 | 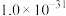 | 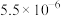 | 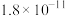 | 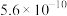 |
(1)气体A的化学式为
(2)酸溶时为了加快酸溶速率,可适当升高温度,但升温度又不能过高的原因是
(3)“系列操作”是煮沸并趁热过滤、
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH≈13”后,需对溶液进行煮沸并趁热过滤出“滤渣2”,“滤渣2”的主要成分为
(6)“还原”时含Cr微粒发生反应的离子方程式为
(7)“碳化”时,实际所用
 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
您最近一年使用:0次
名校
解题方法
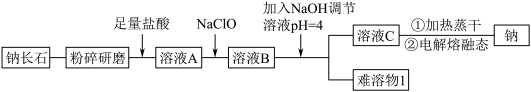
2 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
526次组卷
|
6卷引用:重庆市巴蜀中学2022-2023学年高一上学期期中考试化学试题
10-11高三·江西·阶段练习
名校
解题方法
3 . 两种硫酸盐按一定比例混合后共熔,可制得化合物X,且X溶于水能电离出K+、Cr3+、SO ,若将2.83gX中的Cr3+全部氧化为Cr2O
,若将2.83gX中的Cr3+全部氧化为Cr2O 后,溶液中的Cr2O
后,溶液中的Cr2O 可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O
可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O +6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
 ,若将2.83gX中的Cr3+全部氧化为Cr2O
,若将2.83gX中的Cr3+全部氧化为Cr2O 后,溶液中的Cr2O
后,溶液中的Cr2O 可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O
可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O +6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为| A.K2SO4•2Cr2(SO4)3 | B.K2SO4•Cr2(SO4)3 |
| C.2K2SO4•Cr2(SO4)3 | D.K2SO4• Cr2(SO4)3 Cr2(SO4)3 |
您最近一年使用:0次
2022-11-21更新
|
286次组卷
|
11卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
重庆市南开中学2022-2023学年高一上期期末考试化学试题(已下线)2012届江西省白鹭洲中学高三第一次月考化学试卷(已下线)2012届安徽省宿州市高三第一次教学质量检测化学试卷(已下线)2015届江西省奉新县第一中学高三上学期第一次月考化学试卷甘肃省天水一中2017-2018学年高一下学期入学考试化学试题辽宁省六校2021届高三上学期期中联考化学试题广东省中山纪念中学2021届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题豫中名校2022-2023学年高一上学期期中考试化学试题
4 . 现有如下反应: (提示:BrF3中F为
(提示:BrF3中F为 价),下列判断错误的是
价),下列判断错误的是
 (提示:BrF3中F为
(提示:BrF3中F为 价),下列判断错误的是
价),下列判断错误的是| A.BrF3既是氧化剂,又是还原剂 |
| B.被氧化的原子数与被还原的原子数之比为3∶2 |
| C.每当消耗3molBrF3,就有5molH2O被还原 |
| D.若反应转移3mol电子,则生成标准状况下11.2LO2 |
您最近一年使用:0次
名校
解题方法
5 . 大多数离子液体含有体积很大的阴、阳离子(如图所示)。其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。下列说法正确的是
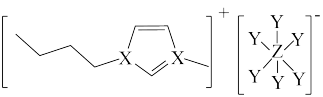

| A.原子半径:Z>X>Y | B.气态氢化物的稳定性:Z>X>Y |
| C.Z的氯化物的分子式一定为ZCl3 | D.此阴离子中Y、Z均满足8电子稳定结构 |
您最近一年使用:0次
2022-07-10更新
|
1346次组卷
|
7卷引用:重庆市第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
6 . 某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
某同学进行了如下实验(必要时可加热):
| 阳离子 | K+、NH 、Fe2+、Mg2+、Cu2+ 、Fe2+、Mg2+、Cu2+ |
| 阴离子 | OH-、Cl-、CO 、SO 、SO |

A.由沉淀A推断原溶液中一定含有SO |
| B.沉淀B中一定含有Mg(OH)2 |
| C.滤液A中可能含有K+ |
D.原溶液中只含有NH 、Fe2+、Cl-、SO 、Fe2+、Cl-、SO |
您最近一年使用:0次
2022-02-17更新
|
536次组卷
|
3卷引用:重庆育才中学2021-2022高三下学期入学考试化学试题
7 . 下图是含氯物质的“价类二维图”,下列叙述错误的是


A.a与d均可与 反应生成 反应生成 气体 气体 |
B.b通入 溶液中有白色沉淀产生 溶液中有白色沉淀产生 |
| C.由e制得c可加入一种还原剂来实现 |
| D.a、b、c、d、e、f中有四种物质为电解质 |
您最近一年使用:0次
8 . 元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系;元素周期表的建立成为化学发展史上的重要里程碑。下图是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g分别代表某种化学元素。请依据这7种元素回答下列问题:
(1)上述7种元素中金属性最强的是___________ (用元素符号表示)。
(2)g在周期表中的位置是___________ ,其最高价氧化物对应的水化物的化学式为___________ 。
(3)a、c两元素形成的含有非极性共价键的化合物的电子式为___________ 。
(4)c、d、e、f简单离子半径由小到大的顺序是___________ (用离子符号表示)。
(5)b、c两元素形成的简单氢化物中稳定性最强的是________ (填化学式)。
(6)富硒酵母是一种新型添加剂,硒 元素与c同主族,则还原性:
元素与c同主族,则还原性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(7)b、c、d三元素形成的正盐溶液呈___________ (填“碱性”“中性”或“酸性”),向其溶液中通入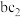 所发生反应的离子方程式为
所发生反应的离子方程式为___________ 。
| a | |||||||||||||||||
| b | c | ||||||||||||||||
| d | e | f | g | ||||||||||||||
(2)g在周期表中的位置是
(3)a、c两元素形成的含有非极性共价键的化合物的电子式为
(4)c、d、e、f简单离子半径由小到大的顺序是
(5)b、c两元素形成的简单氢化物中稳定性最强的是
(6)富硒酵母是一种新型添加剂,硒
 元素与c同主族,则还原性:
元素与c同主族,则还原性:
 (填“>”或“<”)。
(填“>”或“<”)。(7)b、c、d三元素形成的正盐溶液呈
 所发生反应的离子方程式为
所发生反应的离子方程式为
您最近一年使用:0次
9 . 氯酸锶可溶于水,它的主要用途是制造红色烟火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:
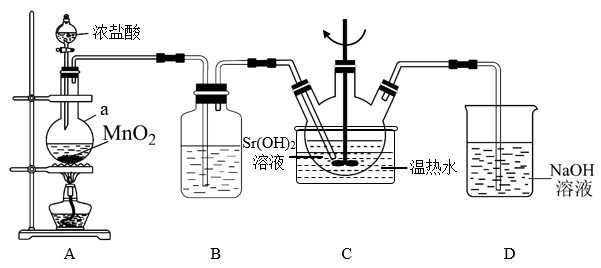
(1)仪器a的名称是___________ 。
(2)装置B中的试剂是___________ ,装置D的作用是___________ 。
(3)检查装置A气密性的操作为___________ 。
(4)A中发生反应的离子方程式为___________ 。
(5)装置C中搅拌的目的是___________ 。
(6)装置C中发生反应的化学方程式为___________ 。

(1)仪器a的名称是
(2)装置B中的试剂是
(3)检查装置A气密性的操作为
(4)A中发生反应的离子方程式为
(5)装置C中搅拌的目的是
(6)装置C中发生反应的化学方程式为
您最近一年使用:0次
名校
10 . 在半导体的发展史中金属锗(Ge)是第一个被广泛使用的半导体材料,它在硅的下一周期,且与硅同主族。下列叙述不正确 的是
| A.锗位于金属区与非金属区的交界处 | B.锗的最高价含氧酸是强酸 |
| C.锗的单质具有半导体的性能 | D.热稳定性: |
您最近一年使用:0次
2022-01-24更新
|
463次组卷
|
4卷引用:重庆市2021-2022学年高一上学期期末联合检测化学试题



