名校
解题方法
1 . 将15.6gNa2O2和5.4gAl 同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,下列说法错误的是
| A.最终溶液:c(Na+)= 2 mol·L-1 | B.标准状况下,反应过程中得到6.72L气体 |
| C.最终溶液:c(Na+) >c(Cl-) | D.最终得到7.8 g沉淀 |
您最近一年使用:0次
名校
解题方法
2 . NaBO3·4H2O的阴离子结构如图所示。硼砂(Na2B4O7)与氢氧化钠的混合溶液中加入双氧水可以制备NaBO3·4H2O。下列说法正确的是
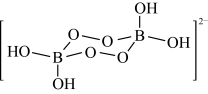
| A.硼砂与氢氧化钠、双氧水的反应为氧化还原反应 |
| B.NaBO3·4H2O不具有杀菌消毒功能与漂白性 |
| C.用浓硫酸处理NaBO3·4H2O可以得到O2 |
| D.分别向同体积的硼砂稀溶液和蒸馏水中加入相同的少量盐酸,前者pH变化大 |
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
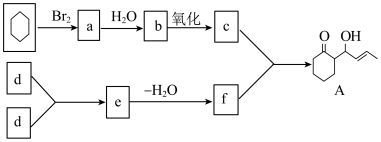
(1)下面是一种有机物A的合成路线,请回答有关问题:
已知:d的分子式为:C2H4O___________ , f___________ 。
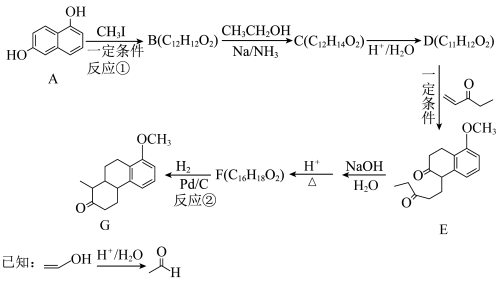
(2)以1,6-二酚(化合物A)为原料合成药物中间体F及其衍生物G的一种路线如下:___________ F___________ 。
(1)下面是一种有机物A的合成路线,请回答有关问题:
已知:d的分子式为:C2H4O
(2)以1,6-二酚(化合物A)为原料合成药物中间体F及其衍生物G的一种路线如下:
您最近一年使用:0次
名校
4 . 下列各组物质中,都含有两个π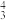 的是
的是
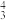 的是
的是A.N2O,CO2,N | B.N2O,NO2,N |
| C.N2O,CO2,NO2 | D.NO2,CO2,N |
您最近一年使用:0次
名校
5 . 下面反应中,主产物不是1-丙醇的是
A.CH3CH2COOH 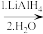 CH3CH2CH2OH CH3CH2CH2OH |
B.CH3CH=CH2 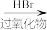 CH3CH2CH2Br CH3CH2CH2Br  CH3CH2CH2OH CH3CH2CH2OH |
C.CH3CH2Br 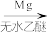 CH3CH2MgBr CH3CH2MgBr  CH3CH2CH2OH CH3CH2CH2OH |
D.CH3CH=CH2 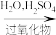 CH3CH2CH2OH CH3CH2CH2OH |
您最近一年使用:0次
名校
解题方法
6 . 将一定质量的铜与150mL的一定浓度的硝酸反应,铜完全溶解,产生标准状况下11.2L的NO和NO2的混合气体(不考虑NO2转化成N2O4),将生成的混合气体与5.6L标况下的氧气一起通入足量NaOH溶液中,气体恰好被吸收生成NaNO3。下列说法不正确的是
| A.铜的质量为32g |
| B.硝酸的物质的量浓度为10.0mol•L-1 |
| C.铜与硝酸反应,生成的NO和NO2体积相等 |
| D.向反应后的溶液加NaOH,使铜沉淀完全,需要NaOH的物质的量至少为1.0mol |
您最近一年使用:0次
2024-03-28更新
|
187次组卷
|
2卷引用:河南省洛阳市宜阳县第一高级中学2023-2024学年高一下学期期中考试化学试卷(研学班)
名校
解题方法
7 . 常温下,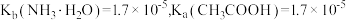 ,向20mL浓度均为
,向20mL浓度均为 的盐酸和醋酸的混合溶液中逐滴加入
的盐酸和醋酸的混合溶液中逐滴加入 的氨水,测得过程中电导率和pH变化曲线如图所示。
的氨水,测得过程中电导率和pH变化曲线如图所示。
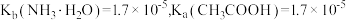 ,向20mL浓度均为
,向20mL浓度均为 的盐酸和醋酸的混合溶液中逐滴加入
的盐酸和醋酸的混合溶液中逐滴加入 的氨水,测得过程中电导率和pH变化曲线如图所示。
的氨水,测得过程中电导率和pH变化曲线如图所示。
| A.a点溶液中,c(CH3COO-)数量级为10-5 |
B.b点溶液中,存在c(Cl-)>c(NH )>c(CH3COOH)>c(H+)>c(OH-) )>c(CH3COOH)>c(H+)>c(OH-) |
C.c点溶液中,存在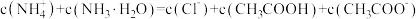 |
D.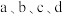 点溶液中,d点水的电离程度最大 点溶液中,d点水的电离程度最大 |
您最近一年使用:0次
2024-03-17更新
|
359次组卷
|
6卷引用:河南省洛阳市新安县第一高级中学2023届高三下学期入学检测化学试题
河南省洛阳市新安县第一高级中学2023届高三下学期入学检测化学试题湖南省醴陵市第一中学2023届高三第六次月考化学试题湖南省涟源市第一中学2023届高三第六次月考化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)辽宁省实验中学2024届高三高考适应性测试(二)化学试题安徽省六安第一中学2024届高三下学期质量检测化学试卷(四)
名校
解题方法
8 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为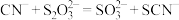 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
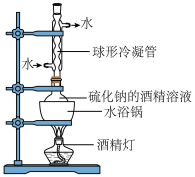
将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是___________ 。
(3)利用下图装置制备 。
。
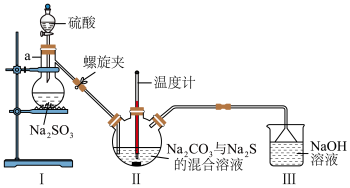
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置Ⅲ的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
(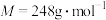 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为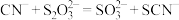 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是
(3)利用下图装置制备
 。
。
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置Ⅲ的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
(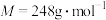 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
9 . I.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:
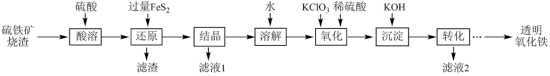
已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为___________ 。
(2)“滤渣”中的主要成分是___________ 。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)流程中“ ”环节的目的是
”环节的目的是___________ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以___________ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:
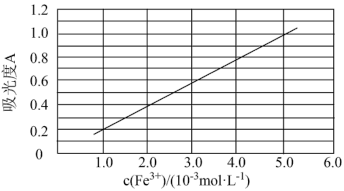
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为___________ %(保留小数点后一位)。
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:
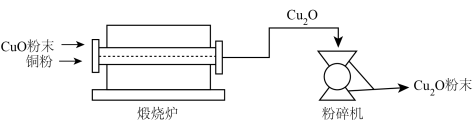
(7)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。
Ⅲ.运用热重分析法推测产物
称取 草酸亚铁晶体(
草酸亚铁晶体(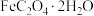 )加热分解,得到剩余固体质量随温度变化的曲线如图所示:
)加热分解,得到剩余固体质量随温度变化的曲线如图所示:
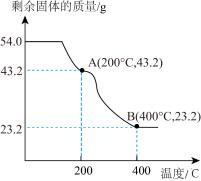
(9)已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为_______ 。
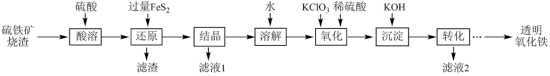
已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)“还原”过程中涉及的离子方程式为
(4)流程中“
 ”环节的目的是
”环节的目的是(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(7)粉碎机中,发生的变化属于
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
Ⅲ.运用热重分析法推测产物
称取
 草酸亚铁晶体(
草酸亚铁晶体(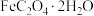 )加热分解,得到剩余固体质量随温度变化的曲线如图所示:
)加热分解,得到剩余固体质量随温度变化的曲线如图所示:
(9)已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为
您最近一年使用:0次
名校
解题方法
10 . 我国将镓列为战略储备金属,我国的镓储量占世界储量的80%以上。请回答:
(1)基态镓原子最外层的电子排布图为________ ,最高能级的电子云形状为_________ 。
(2)镓可与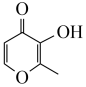 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga(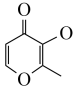 )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是___________ (填名称);每个甲基麦芽酚分子中含有___________ 个σ键。
(3)镓的卤化物熔点如表所示:
①氯化镓中镓的杂化方式与下列微粒的中心原子的杂化方式相同且氯化镓的空间结构也与其微粒相同的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
②各物质的熔点从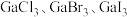 到
到 依次升高,原因是
依次升高,原因是___________ 。
(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以___________ 键结合。
(1)基态镓原子最外层的电子排布图为
(2)镓可与
 (甲基麦芽酚)形成配合物Ga(
(甲基麦芽酚)形成配合物Ga( )3。该配合物中与Ga(Ⅲ)形成配位键的原子是
)3。该配合物中与Ga(Ⅲ)形成配位键的原子是(3)镓的卤化物熔点如表所示:
| 物质 |  |  |  |  |
| 熔点/℃ | 1000 | 78 | 124 | 213 |
A.
 B.
B. C.
C. D.
D.
②各物质的熔点从
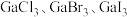 到
到 依次升高,原因是
依次升高,原因是(4)砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一、GaAs的熔点为1238℃,则Ga和As以
您最近一年使用:0次



