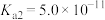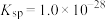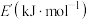名校
解题方法
1 . 下列离子方程式与所给事实相符的是
A.向水杨酸溶液中加入碳酸氢钠: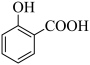 +2HCO +2HCO → →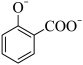 +2H2O+2CO2↑ +2H2O+2CO2↑ |
B.向碳酸氢镁溶液中加入过量澄清石灰水溶液产生白色沉淀: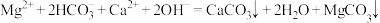 |
C.向 溶液中通入 溶液中通入 气体: 气体: |
D. 溶液滴入 溶液滴入 溶液中: 溶液中: |
您最近一年使用:0次
2024-05-16更新
|
511次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
2 . 下列陈述I和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | HCl的酸性强于CH3COOH | 盐酸的pH一定小于醋酸溶液 |
| B | 通过煤的干馏可获得苯、甲苯等化工原料 | 煤的干馏属于化学变化 |
| C | 将Cl2通入溴水中,溴水褪色 | Cl2具有漂白性 |
| D | 将金属Na加入CuSO4溶液中,析出红色固体 | 还原性:Na>Cu |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-23更新
|
852次组卷
|
2卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
解题方法
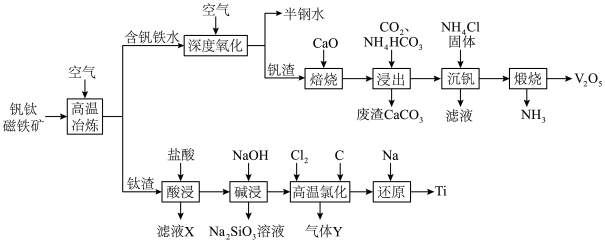
3 . 稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
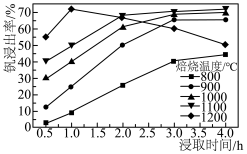
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。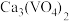 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以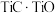 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
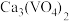 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
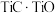 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近一年使用:0次
2024-04-22更新
|
469次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
4 . 硒 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:_______ 区。
(2) 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为_______ 。
(3) 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为_______ 。
(4)比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(5)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为_______ (用文字描述),其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为_______ 。
(6)甲硒醇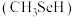 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是_______ 。
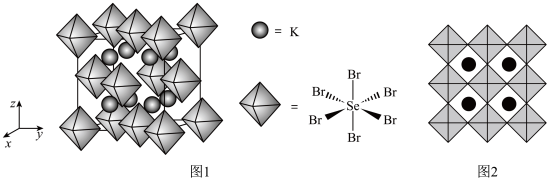
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为_______ 。
 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示: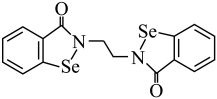
(2)
 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为(3)
 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为(4)比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(5)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为(6)甲硒醇
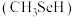 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是| 有机物 | 甲醇 | 甲硫醇 | 甲硒醇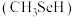 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为
您最近一年使用:0次
2024-04-19更新
|
297次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 碳酸铈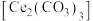 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以 的形式存在;
的形式存在;
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。
(1)“焙烧”时,从焙烧室的底部通入空气的目的是____________________ 。
(2)“滤渣1”的主要成分为__________ 。
(3)“还原”时,加入硫脲( )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为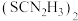 。
。
①该反应的离子方程式为____________________ 。
②硫脲属于__________ (填“极性”或“非极性”)分子,该分子中键角
__________ 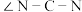 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为______________________________________________________________________ 。
(5)若“沉淀”后,溶液的pH为6,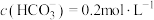 ,此时
,此时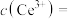
__________ 。已知常温下:
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示: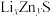 中,
中,
__________ 。
②ZnS晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为__________  (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为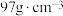 )。
)。
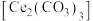 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示: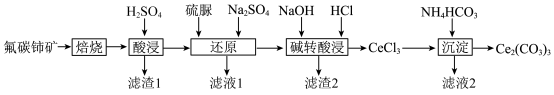
①“酸浸”后铈元素主要以
 的形式存在;
的形式存在;②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。(1)“焙烧”时,从焙烧室的底部通入空气的目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
 )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为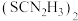 。
。①该反应的离子方程式为
②硫脲属于

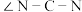 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)若“沉淀”后,溶液的pH为6,
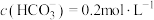 ,此时
,此时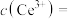
|
| |
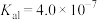 |
|
|
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示:
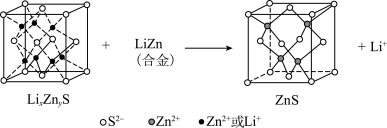
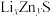 中,
中,
②ZnS晶胞中,
 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为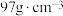 )。
)。
您最近一年使用:0次
2024-04-15更新
|
322次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
6 . 将等物质的量浓度等体积的甘氨酸溶液与盐酸混合,发生反应: ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。
 ,取上述溶液(含0.04mol
,取上述溶液(含0.04mol  ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以
),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以 的形式存在)。
的形式存在)。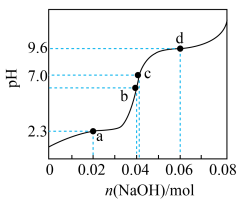
A. 中解离出 中解离出 的能力: 的能力: |
B.b点溶液pH<7,推测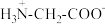 中 中 解离出 解离出 的程度大于-COO-水解的程度 的程度大于-COO-水解的程度 |
C.c点溶液中存在: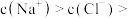 c( c(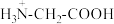 ) )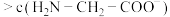 |
D.由d点可知: 的 的 |
您最近一年使用:0次
2024-04-10更新
|
668次组卷
|
5卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
7 . 与锂离子电池相比,有机电池不依赖战略金属、充电速度更快且环境友好。如图是一种可降解的多肽电池。(假设离子交换膜仅允许 通过)下列说法不正确的是
通过)下列说法不正确的是
 通过)下列说法不正确的是
通过)下列说法不正确的是
| A.放电时,电极电势:c>d |
B.放电时,总反应方程式为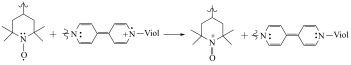 |
| C.充电时,电路中每通过2mol电子,阳极区质量增加298g |
D.充电时,a电极的方程式为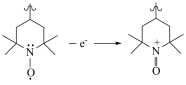 |
您最近一年使用:0次
2024-04-10更新
|
393次组卷
|
3卷引用:2024届河南省焦作市博爱县第一中学高三下学期二模化学试题
名校
8 . 二氧化碳加氢制甲醇可以实现温室气体资源化利用,过程中的主要反应为
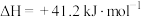

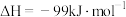
密闭容器中,反应物起始物质的量比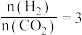 时,在不同条件下(①温度为250℃下压强变化,②压强为
时,在不同条件下(①温度为250℃下压强变化,②压强为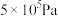 下温度变化)达到平衡时
下温度变化)达到平衡时 物质的量分数变化如图所示。下列有关说法正确的是
物质的量分数变化如图所示。下列有关说法正确的是

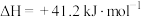

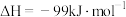
密闭容器中,反应物起始物质的量比
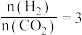 时,在不同条件下(①温度为250℃下压强变化,②压强为
时,在不同条件下(①温度为250℃下压强变化,②压强为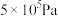 下温度变化)达到平衡时
下温度变化)达到平衡时 物质的量分数变化如图所示。下列有关说法正确的是
物质的量分数变化如图所示。下列有关说法正确的是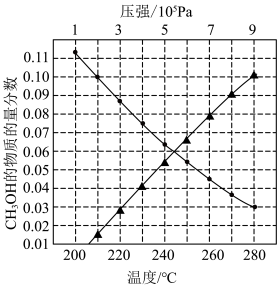
A.反应 的焓变 的焓变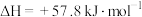 |
B.在250℃、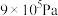 条件下,平衡时甲醇的物质的量分数为0.10 条件下,平衡时甲醇的物质的量分数为0.10 |
C.当甲醇的物质的量分数为0.03时, 的平衡转化率为11.3% 的平衡转化率为11.3% |
D.提高 转化为 转化为 的平衡转化率,需要研发在高温区的高效催化剂 的平衡转化率,需要研发在高温区的高效催化剂 |
您最近一年使用:0次
2024-04-01更新
|
274次组卷
|
3卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
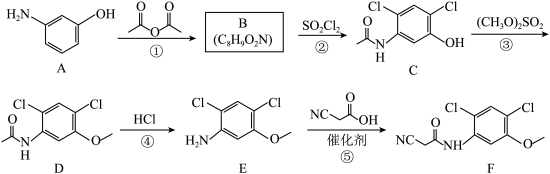
9 . 有机物F是合成治疗白血病的常用药博舒替尼的一种重要中间体,其一种合成路线如下图所示。
(1)A中所含官能团的名称为__________ 。
(2)B的结构简式为__________ 。
(3)③的反应类型为__________ 。
(4)④的化学方程式为______________________________ 。
(5)符合下列条件的C的同分异构体有__________ 种(不考虑立体异构)。
i.含有苯环
ii.含有
其中,核磁共振氢谱显示有5组峰,且峰面积之比为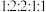 的同分异构的结构简式是
的同分异构的结构简式是__________ (写出一种)。
(6)设计①④的目的是__________ ;上述合成路线步骤多,导致F的产率低,利用原路线中的原料和反应条件,优化原合成路线以提高F的产率,完善新的合成路线:__________ 。
(1)A中所含官能团的名称为
(2)B的结构简式为
(3)③的反应类型为
(4)④的化学方程式为
(5)符合下列条件的C的同分异构体有
i.含有苯环
ii.含有

其中,核磁共振氢谱显示有5组峰,且峰面积之比为
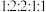 的同分异构的结构简式是
的同分异构的结构简式是(6)设计①④的目的是
您最近一年使用:0次
2024-03-21更新
|
210次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
10 . 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。
(1)已知: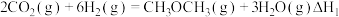


则反应 的
的 
_________ (用含 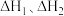 的代数式表示)
的代数式表示)
(2)化学反应的能量变化 与反应物和生成物的键能有关。键能可以简单地理解为断开(或形成)
与反应物和生成物的键能有关。键能可以简单地理解为断开(或形成) 化学键时所吸收(或放出)的能量。部分化学键的键能数据如表:
化学键时所吸收(或放出)的能量。部分化学键的键能数据如表:
反应 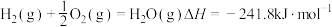 ,则
,则 
_____________ 。
(3)工业上用甲烷催化裂解可制备氢气,有关反应原理如下:
反应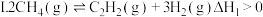 . 反应Ⅱ.
. 反应Ⅱ.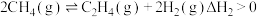 .
.
①实验测得反应Ⅰ的速率方程: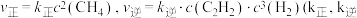 别为正、逆反应速率常数,只与温度、催化剂有关)。
别为正、逆反应速率常数,只与温度、催化剂有关)。 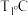 下反应达到平衡时
下反应达到平衡时 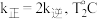 下反应达到平衡时
下反应达到平衡时 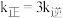 。由此推知,
。由此推知,
_________________  (填“>”、“<"或"=")。
(填“>”、“<"或"=")。
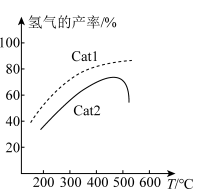
②在密闭容器中充入一定量 ,发生上述反应Ⅰ和反应Ⅱ。在不同催化剂
,发生上述反应Ⅰ和反应Ⅱ。在不同催化剂 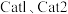 作用下,测得单位时间内
作用下,测得单位时间内  产率与温度的关系如图。其他条件相同时,催化效率较高的是
产率与温度的关系如图。其他条件相同时,催化效率较高的是_________________ (填 "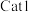 "或 "
"或 "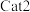 ")。在
")。在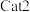 作用下,温度高于
作用下,温度高于 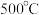 时,
时, 产率降低的可能原因是
产率降低的可能原因是_________________ 。(任写一条即可)。
(4)在一个体积为 的密闭容器中,高温下发生反应:
的密闭容器中,高温下发生反应: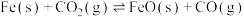 。其中
。其中 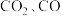 的物质的量
的物质的量 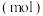 随时间
随时间 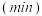 的变化关系如图所示。
的变化关系如图所示。

①反应在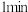 时第一次达到平衡状态,固体的质量增加了
时第一次达到平衡状态,固体的质量增加了 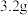 用
用  的浓度变化表示的反应速率
的浓度变化表示的反应速率 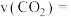
_____________________ 。
②反应进行至 时,若只改变温度,曲线发生的变化如图所示,
时,若只改变温度,曲线发生的变化如图所示, 时再次达到平衡,
时再次达到平衡,
_____________ 0(填“>”、“<"或"=")。
③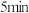 时再充入一定量的
时再充入一定量的  ,平衡发生移动。下列说法正确的是
,平衡发生移动。下列说法正确的是_____________ (填写编号)。
A. 先增大后减小 B.
先增大后减小 B. 先减小后增大
先减小后增大
C.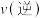 先增大后减小 D.
先增大后减小 D.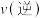 先减小后增大
先减小后增大
④表示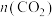 变化的曲线是
变化的曲线是_____________ (填写图中曲线的字母编号)。
(1)已知:
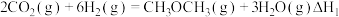


则反应
 的
的 
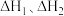 的代数式表示)
的代数式表示)(2)化学反应的能量变化
 与反应物和生成物的键能有关。键能可以简单地理解为断开(或形成)
与反应物和生成物的键能有关。键能可以简单地理解为断开(或形成) 化学键时所吸收(或放出)的能量。部分化学键的键能数据如表:
化学键时所吸收(或放出)的能量。部分化学键的键能数据如表:化学键 |
|
|
|
| 436 |
| 463 |
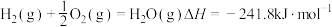 ,则
,则 
(3)工业上用甲烷催化裂解可制备氢气,有关反应原理如下:
反应
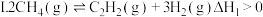 . 反应Ⅱ.
. 反应Ⅱ.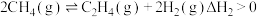 .
.①实验测得反应Ⅰ的速率方程:
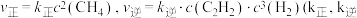 别为正、逆反应速率常数,只与温度、催化剂有关)。
别为正、逆反应速率常数,只与温度、催化剂有关)。 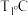 下反应达到平衡时
下反应达到平衡时 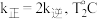 下反应达到平衡时
下反应达到平衡时 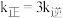 。由此推知,
。由此推知,
 (填“>”、“<"或"=")。
(填“>”、“<"或"=")。②在密闭容器中充入一定量
 ,发生上述反应Ⅰ和反应Ⅱ。在不同催化剂
,发生上述反应Ⅰ和反应Ⅱ。在不同催化剂 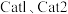 作用下,测得单位时间内
作用下,测得单位时间内  产率与温度的关系如图。其他条件相同时,催化效率较高的是
产率与温度的关系如图。其他条件相同时,催化效率较高的是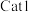 "或 "
"或 "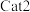 ")。在
")。在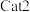 作用下,温度高于
作用下,温度高于 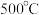 时,
时, 产率降低的可能原因是
产率降低的可能原因是
(4)在一个体积为
 的密闭容器中,高温下发生反应:
的密闭容器中,高温下发生反应: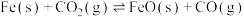 。其中
。其中 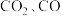 的物质的量
的物质的量 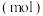 随时间
随时间 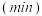 的变化关系如图所示。
的变化关系如图所示。
①反应在
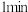 时第一次达到平衡状态,固体的质量增加了
时第一次达到平衡状态,固体的质量增加了 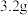 用
用  的浓度变化表示的反应速率
的浓度变化表示的反应速率 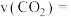
②反应进行至
 时,若只改变温度,曲线发生的变化如图所示,
时,若只改变温度,曲线发生的变化如图所示, 时再次达到平衡,
时再次达到平衡,
③
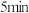 时再充入一定量的
时再充入一定量的  ,平衡发生移动。下列说法正确的是
,平衡发生移动。下列说法正确的是A.
 先增大后减小 B.
先增大后减小 B. 先减小后增大
先减小后增大C.
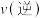 先增大后减小 D.
先增大后减小 D.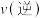 先减小后增大
先减小后增大④表示
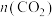 变化的曲线是
变化的曲线是
您最近一年使用:0次