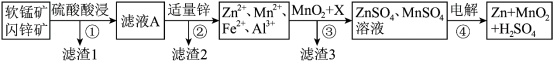
1 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2.闪锌矿主要成分为ZnS,含少量FeS、CuS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下:
Ⅱ.常温下各种金属离子开始沉淀和完全沉淀的pH如下表:
回答下列问题:
(1)为了加快矿石的酸浸速率,通常采用的方法有___________ 。
(2)滤渣2的主要成分是___________ (填化学式)。
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的离子方程式:___________ 。
(4)步骤③中MnO2的作用可以用一种常见的绿色氧化剂的溶液来代替,其化学式为___________ ;若物质X是用来调节溶液的pH至a,试分析a的范围是___________ 。
(5)当金属离子物质的量浓度为1×10-5 时认为离子完全沉淀,则Ksp[Al(OH)3]=
时认为离子完全沉淀,则Ksp[Al(OH)3]=___________ 。
(6)步骤④是以锂离子电池作电源,结合流程图分析用惰性电极进行电解时:在阴极放电的离子是___________ (填离子符号),阳极的电极反应式为___________ 。
Ⅱ.常温下各种金属离子开始沉淀和完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| 开始沉淀 | 5.7 | 7.9 | 7.2 | 2.3 | 3.3 |
| 完全沉淀 | 8.4 | 10.1 | 9.3 | 3.7 | 4.9 |
(1)为了加快矿石的酸浸速率,通常采用的方法有
(2)滤渣2的主要成分是
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的离子方程式:
(4)步骤③中MnO2的作用可以用一种常见的绿色氧化剂的溶液来代替,其化学式为
(5)当金属离子物质的量浓度为1×10-5
 时认为离子完全沉淀,则Ksp[Al(OH)3]=
时认为离子完全沉淀,则Ksp[Al(OH)3]=(6)步骤④是以锂离子电池作电源,结合流程图分析用惰性电极进行电解时:在阴极放电的离子是
您最近一年使用:0次
解题方法
2 . 以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],反应过程中能量(Ea2>Ea3>Ea1>Ea4>0)变化如图所示,下列说法正确的是
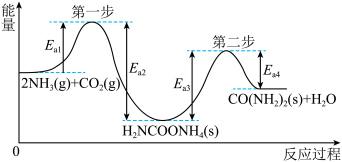
| A.该过程的两步反应均为放热反应 |
| B.第二步反应是合成尿素的决速步骤 |
| C.由图可知CO2和NH3在一定条件下发生有效碰撞直接生成了CO(NH2)2和H2O |
D.合成尿素的热化学方程式为: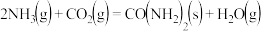 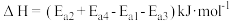 |
您最近一年使用:0次
解题方法
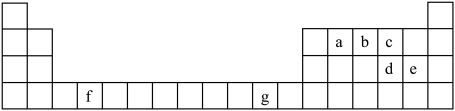
3 . 下图是元素周期表中的前四周期,回答下列问题:___________ ,基态e离子占据的最高能级的原子轨道形状是___________ 。
(2)g元素基态原子的价层电子轨道表示式为___________ 。
(3)a、b和c三种元素的电负性由大到小的顺序为___________ (用元素符号表示)。
(4)d、e两种元素形成的简单离子半径大小为___________ (用离子符号表示)。
(5)含a元素的物质甲醇(CH3OH)可以作为燃料电池的燃料,如下图所示:___________ (填“阴极”或“阳极”)。
②甲中A发生的电极反应式为___________ 。
(2)g元素基态原子的价层电子轨道表示式为
(3)a、b和c三种元素的电负性由大到小的顺序为
(4)d、e两种元素形成的简单离子半径大小为
(5)含a元素的物质甲醇(CH3OH)可以作为燃料电池的燃料,如下图所示:
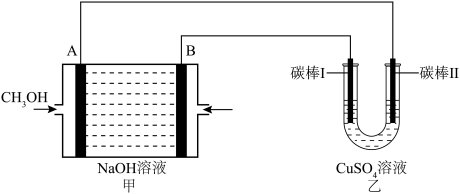
②甲中A发生的电极反应式为
您最近一年使用:0次
4 . 研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g) 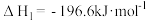
2NO(g)+O2(g) 2NO2(g)
2NO2(g) 
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的 。
。
(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术,反应原理如图。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,写出该反应的化学方程式___________ 。 进行吸附,主要反应为:C(s)+2NO(g)
进行吸附,主要反应为:C(s)+2NO(g) N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol
N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol (g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:
(g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:
①下列可判断该可逆反应达到化学平衡状态的标志是___________ 。
A.消耗2molN2的同时消耗了4molNO
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.c(N2)=c(CO2)
② t℃时,该反应的平衡常数K=___________ ;保持其他条件不变,在5min时向容器中同时通入0.1mol 和0.2molN2,此时速率:v正
和0.2molN2,此时速率:v正 ___________ (填“大于”“小于”或“等于”)v逆 。
(4)在汽车尾气的净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) 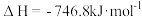 ,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。
,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。
①当该反应达到平衡状态后,保持其他条件不变,仅改变一个条件,下列有关说法正确的是___________ (填字母)。
A.加入催化剂可加快正、逆反应速率,同时增大反应物的转化率
B.降低温度,正反应速率减小的程度比逆反应速率减小的程度小
C.增大压强,平衡向正向移动,平衡常数增大
D.加入一定量的CO,平衡正向移动,但CO的转化率减小
②达到平衡后,仅升高温度,k正 增大的倍数___________ (填“大于”、“小于”或“等于”)k逆 增大的倍数。
(1)已知:2SO2(g)+O2(g)
 2SO3(g)
2SO3(g) 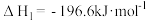
2NO(g)+O2(g)
 2NO2(g)
2NO2(g) 
则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的
SO3(g)+NO(g)的 。
。(2)用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术,反应原理如图。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,写出该反应的化学方程式
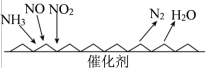
 进行吸附,主要反应为:C(s)+2NO(g)
进行吸附,主要反应为:C(s)+2NO(g) N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol
N2(g) +CO2(g)。t℃时,向容积恒定为10L的密闭容器中加入1molC(s)和2mol (g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:
(g)进行反应,5min时反应恰好达到平衡状态,且0~5min内v(CO2)=0.016mol·L-1·min-1.回答下列问题:①下列可判断该可逆反应达到化学平衡状态的标志是
A.消耗2molN2的同时消耗了4molNO
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.c(N2)=c(CO2)
② t℃时,该反应的平衡常数K=
 和0.2molN2,此时速率:v正
和0.2molN2,此时速率:v正 (4)在汽车尾气的净化装置中CO和NO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g) 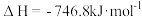 ,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。
,实验测得,v正= k正c2(NO)· c2(CO),v逆= k逆c(N2) c2(CO2)( k正、k逆为速率常数,均随温度的升高而增大,且都只与温度有关)。①当该反应达到平衡状态后,保持其他条件不变,仅改变一个条件,下列有关说法正确的是
A.加入催化剂可加快正、逆反应速率,同时增大反应物的转化率
B.降低温度,正反应速率减小的程度比逆反应速率减小的程度小
C.增大压强,平衡向正向移动,平衡常数增大
D.加入一定量的CO,平衡正向移动,但CO的转化率减小
②达到平衡后,仅升高温度,k正 增大的倍数
您最近一年使用:0次
5 . 酸、碱、盐均属于电解质,它们在水溶液中存在多种平衡,请根据所学知识回答下列问题:
(1)已知:
则①CH3COOH、②H2CO3、③H2SO3的酸性由强到弱的顺序是___________ (填标号)。
(2)常温下,物质的量浓度均为0.1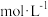 的五种溶液:
的五种溶液:
①NaOH、②NaCl、③H2SO3、④CH3COONa、⑤H2SO4
它们的pH从大到小排列顺序为___________ (填标号)。
(3)实验室配制FeCl3的水溶液时,常把FeCl3固体先溶于较浓的盐酸中,然后再加蒸馏水稀释到所需浓度,目的是为了___________ (填“促进”或“抑制”)铁离子的水解;如果把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________ (填化学式)。
(4)25 ℃时,向浓度均为0.02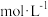 MgCl2和CuCl2的混合溶液中逐滴加入NaOH溶液,当两种沉淀共存时,
MgCl2和CuCl2的混合溶液中逐滴加入NaOH溶液,当两种沉淀共存时, =
= ___________ (保留至小数点后两位)。{已知25 ℃时,Ksp[Mg(OH)2]=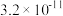 ,Ksp[Cu(OH)2]=
,Ksp[Cu(OH)2]=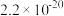 }
}
(5)某学习小组用0.1000mol/LNaOH标准溶液来滴定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
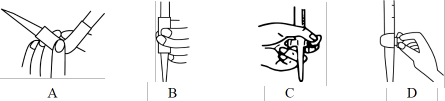
①滴定前需排放装有NaOH溶液的滴定管尖嘴处的气泡,其正确的图示为___________ (填字母)。
依据表中数据计算该盐酸的物质的量浓度为___________ mol/L(保留四位有效数字)。
(1)已知:
| 酸 | 电离常数 |
| CH3COOH | 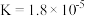 |
| H2CO3 | 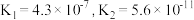 |
| H2SO3 | 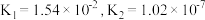 |
(2)常温下,物质的量浓度均为0.1
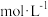 的五种溶液:
的五种溶液:①NaOH、②NaCl、③H2SO3、④CH3COONa、⑤H2SO4
它们的pH从大到小排列顺序为
(3)实验室配制FeCl3的水溶液时,常把FeCl3固体先溶于较浓的盐酸中,然后再加蒸馏水稀释到所需浓度,目的是为了
(4)25 ℃时,向浓度均为0.02
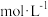 MgCl2和CuCl2的混合溶液中逐滴加入NaOH溶液,当两种沉淀共存时,
MgCl2和CuCl2的混合溶液中逐滴加入NaOH溶液,当两种沉淀共存时, =
= 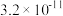 ,Ksp[Cu(OH)2]=
,Ksp[Cu(OH)2]=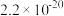 }
}(5)某学习小组用0.1000mol/LNaOH标准溶液来滴定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
①滴定前需排放装有NaOH溶液的滴定管尖嘴处的气泡,其正确的图示为
②若滴定开始和结束时,该仪器中溶液读数如图所示,所用NaOH标准溶液的体积为
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 25.00 | 0.06 | 26.17 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
您最近一年使用:0次
解题方法
6 . 由下列实验操作和现象得出的结论一定正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向H2O2溶液中滴加少量硫酸酸化的FeSO4溶液,溶液变为棕黄色后迅速出现大量气泡 | Fe2+催化H2O2发生分解反应生成氧气 |
| B | 用pH计测定SO2和CO2饱和溶液的pH值,前者pH小 | H2SO3酸性强于H2CO3 |
| C | 向等浓度的NaCl和Na2CrO4溶液中滴加少量AgNO3溶液,出现白色沉淀(铬酸银为深红色沉淀) | Ksp(AgCl)<Ksp(Ag2CrO4) |
| D | 等体积pH=2的HA和HB两种酸,HA稀释10倍,HB稀释100倍后,pH依然相同 | 酸性HA>HB |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 已知液氨的性质与水相似。T℃时,NH3+NH3
 的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是

 的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是| A.在此温度下液氨的离子积为1×10-30 |
| B.在液氨中放入金属钠,不可能生成NaNH2 |
C.降温,可使液氨电离平衡逆向移动,且c ( )<c ( )<c ( ) ) |
| D.恒温下,在液氨中加入NH4Cl,可使液氨的电离平衡正向移动 |
您最近一年使用:0次
解题方法
8 . 某化学学习兴趣小组利用如图装置可制作简易的燃料电池,电极Ⅰ、电极Ⅱ均为石墨电极,下列说法错误的是
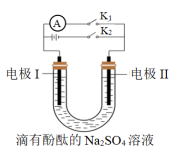
| A.将Na2SO4溶液换成NaCl溶液也能制作成燃料电池 |
| B.断开K1、闭合K2,一段时间后,电极Ⅰ附近溶液变红 |
| C.实验开始时,若断开K2、闭合K1,电流计指针不发生偏转 |
D.电解一段时间后,断开K2、闭合K1,电极Ⅰ的反应式为: |
您最近一年使用:0次
解题方法
9 . 常压条件下,羰基化法精炼镍的原理为:Ni(s)+4CO(g)⇌Ni(CO)4(g) ΔH<0。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
已知:①230℃时,K=2×10-5;②Ni(CO)4的沸点为42.2℃;③固体杂质不参与反应。
下列判断错误的是
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
已知:①230℃时,K=2×10-5;②Ni(CO)4的沸点为42.2℃;③固体杂质不参与反应。
下列判断错误的是
| A.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ |
| B.第二阶段,由于反应有可逆性,Ni(CO)4分解率较小 |
| C.增加c(CO),平衡向正向移动,但反应的平衡常数不变 |
| D.该反应达到平衡时,4v生成[Ni(CO)4]=v生成(CO) |
您最近一年使用:0次
解题方法
10 . 下列事实不能用勒夏特列原理解释的是
| A.实验室可用排饱和NaCl溶液的方法收集Cl2 |
| B.工业合成氨时,适当增大N2浓度,以提高H2的转化率 |
| C.用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少 |
D.对平衡体系2NO2(g) N2O4(g),缩小容器的体积,混合气体的颜色突然加深 N2O4(g),缩小容器的体积,混合气体的颜色突然加深 |
您最近一年使用:0次



