名校
1 . 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾;先将样品溶于适量水中;充分搅拌后过滤;再将滤液按下图所示步骤进行操作。

下列说法正确的是

下列说法正确的是
| A.反应①过滤后所得沉淀为不溶于水的杂质 |
| B.反应②中试剂Ⅱ是碳酸钾溶液 |
| C.图中所示转化反应中包含一个氧化还原反应 |
| D.试剂Ⅰ和试剂Ⅱ可进行对换 |
您最近一年使用:0次
2024-02-04更新
|
99次组卷
|
2卷引用:湖南省郴州市2023-2024学年高一上学期期末教学质量监测化学试卷
名校
2 . A、B、X、Y、Z是原子序数依次增大的短周期主族元素,其中A与Y同主族,X与Z同主族,X、B与A均可形成10电子化合物;B与Z的最外层电子数之比为2:3,常见化合物 与水反应生成X的单质,所得溶液可使酚酞溶液变红。则下列说法正确的是
与水反应生成X的单质,所得溶液可使酚酞溶液变红。则下列说法正确的是
 与水反应生成X的单质,所得溶液可使酚酞溶液变红。则下列说法正确的是
与水反应生成X的单质,所得溶液可使酚酞溶液变红。则下列说法正确的是A.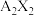 中只存在极性共价键 中只存在极性共价键 |
| B.B、X两元素至少可以形成两种化合物 |
C. 的离子半径小于 的离子半径小于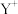 |
| D.B和Z的氧化物对应水化物的酸性:B<Z |
您最近一年使用:0次
2024-02-04更新
|
168次组卷
|
2卷引用:湖南省郴州市2023-2024学年高一上学期期末教学质量监测化学试卷
名校
解题方法
3 .  为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.18g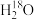 含有的中子数为 含有的中子数为 |
B.1mol/L 溶液中离子总数为 溶液中离子总数为 |
C.常温常压下,0.2克 和7.1克 和7.1克 于密闭容器中充分反应后,其分子总数为 于密闭容器中充分反应后,其分子总数为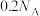 |
D.标准状况下,2.24L 与钠反应,转移的电子数一定为 与钠反应,转移的电子数一定为 |
您最近一年使用:0次
2024-02-04更新
|
165次组卷
|
2卷引用:湖南省郴州市2023-2024学年高一上学期期末教学质量监测化学试卷
4 . 25℃时,在25mL0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH与CH3COOH溶液体积关系如图所示。下列有关粒子浓度关系不正确的是
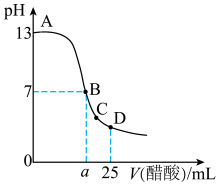

| A.曲线上A、B间的任意一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.B点:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.D点:c(CH3COO-)+ c(CH3COOH)=2c(Na+) |
您最近一年使用:0次
5 . 非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态N原子核外电子的运动状态有________ 种。羟胺(NH2OH)的水溶液呈碱性,其碱性原理与氨水相似,同浓度的氨水和羟胺两种溶液的碱性较强的是______ (填“NH2OH"或“NH3”),原因是____________ 。
(2)氟化硝酰(NO2F)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为_______ ;第一电离能由大到小顺序为_________ 。
(3)气态N2O5的分子结构为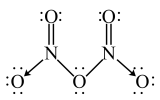 ,而固态N2O5则由
,而固态N2O5则由 与
与 构成。
构成。 的空间构型为
的空间构型为______ , 中N的杂化方式为
中N的杂化方式为________ 。
(4) 和PH3中共价键的键角比较:
和PH3中共价键的键角比较:
_______ PH3(填“>”、“<”或“=”,下同), 和
和 中共价键键角比较:
中共价键键角比较:
_____  。
。
(1)基态N原子核外电子的运动状态有
(2)氟化硝酰(NO2F)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为
(3)气态N2O5的分子结构为
 ,而固态N2O5则由
,而固态N2O5则由 与
与 构成。
构成。 的空间构型为
的空间构型为 中N的杂化方式为
中N的杂化方式为(4)
 和PH3中共价键的键角比较:
和PH3中共价键的键角比较:
 和
和 中共价键键角比较:
中共价键键角比较:
 。
。
您最近一年使用:0次
6 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.含0.1molFeCl3的饱和溶液中Fe3+数目为0.1NA |
| B.25℃时,1 LpH=1的醋酸溶液中含有醋酸分子数大于0.1NA |
| C.常温下,pH=9的CH3COONa溶液中,水电离出的H+数为10-5NA |
| D.0.1molN2和0.3molH2于密闭容器中充分反应生成NH3的分子数为0.2NA |
您最近一年使用:0次
7 . 从某废液(含有Fe3+、Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得的纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
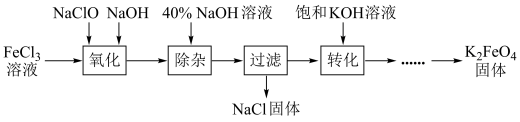
已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是_________ 和_________ 。
(2)检验废液中含有Fe2+选用的试剂是__________ (填化学式)。
(3)“氧化”过程反应的离子方程式为__________ 。
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用______ 溶解,然后______ ,过滤。
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
已知溶液中的某离子浓度小于1×10-5 mol/L时就认为该离子沉淀完全。加双氧水的目的是_________ ;若溶液中CuSO4的浓度为3.0mol/L,通过计算说明此方法可除去粗CuSO4·5H2O晶体中FeSO4·7H2O的理由:___________ 。

已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是
(2)检验废液中含有Fe2+选用的试剂是
(3)“氧化”过程反应的离子方程式为
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 3×10-20 |
您最近一年使用:0次
8 . 二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
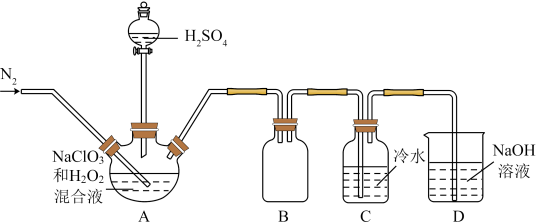
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是________ 。
②装置B的作用是_________ 。
③A装置中,装H2SO4溶液的仪器名称为:______ ,写出A中反应的离子方程式:_________ 。
(2)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化(8H++2ClO2+10I-=2C1-+5I2+4H2O),然后加入_____ 作指示剂,用0.2mol/L的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2 =2I-+
=2I-+ ),当看到
),当看到_______ 现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为_________ mol/L。
(3)下列操作使测定结果偏低的是__________。
(1)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③A装置中,装H2SO4溶液的仪器名称为:
(2)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化(8H++2ClO2+10I-=2C1-+5I2+4H2O),然后加入
 =2I-+
=2I-+ ),当看到
),当看到(3)下列操作使测定结果偏低的是__________。
| A.滴定前俯视,滴定终点仰视读数 |
| B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗 |
| C.锥形瓶用蒸馏水洗净后未干燥直接装入待测液 |
| D.滴定前正常,滴定后滴定管尖嘴内有气泡. |
您最近一年使用:0次
解题方法
9 . 将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)  2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法正确的是
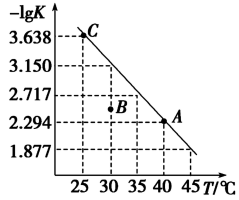
 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法正确的是
| A.该反应的△H<0 |
| B.NH3的体积分数不变时,该反应一定达到平衡状态 |
| C.A点对应状态的平衡常数K(A)=102.294 |
| D.30℃时,B点对应状态的v(正)<v(逆) |
您最近一年使用:0次
10 . 铁的配合物离子(用L-Fe-H]表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:

下列说法不正确的是

下列说法不正确的是
A.该过程的总反应为HCOOH CO2↑+H2↑ CO2↑+H2↑ |
| B.H+浓度过大或者过小,均导致反应速率降低 |
| C.该催化循环中Fe元素的化合价发生变化 |
| D.该过程的总反应速率由Ⅳ→Ⅰ步骤决定 |
您最近一年使用:0次



