2021高三·全国·专题练习
1 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。
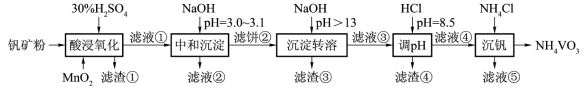
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是_______ 。
(2)“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有
,同时还有_______ 离子被氧化。写出VO+转化为 反应的离子方程式
反应的离子方程式_______ 。
(3)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是_______ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是
(2)“酸浸氧化”中,VO+和VO2+被氧化成
 ,同时还有
,同时还有 反应的离子方程式
反应的离子方程式(3)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是
您最近一年使用:0次
2021高三·全国·专题练习
2 . 生产生活中氨及铵盐有重要用途,而汽车尾气中含NO、NO2则应降低其排放。在20℃时,已知:
①N2(g)+O2(g)=2NO(g),正、逆反应活化能分别为akJ/mol、bkJ/mol;
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;
则4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的ΔH为_______ 。
①N2(g)+O2(g)=2NO(g),正、逆反应活化能分别为akJ/mol、bkJ/mol;
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;
则4NH3(g)+6NO(g)=5N2(g)+6H2O(l)的ΔH为
您最近一年使用:0次
2021高三·全国·专题练习
3 . 高纯硫酸锰在电池材料领域有重要用途。以软锰矿(主要成分为MnO2,含有少量铁和铝的氧化物)、硫铁矿(主要成分为FeS2)、钛白废酸(主要成分为H2SO4)为原料制备MnSO4·H2O的工艺流程如图:

在“酸浸”过程中,FeS2和MnO2颗粒组成两个原电池,如图所示:
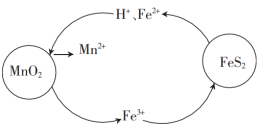
其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。
①MnO2原电池中,MnO2为原电池的___ (填“正极”或“负极”),每消耗1molMnO2,生成___ molFe3+。
②FeS2原电池负极上的电极反应式为___ 。

在“酸浸”过程中,FeS2和MnO2颗粒组成两个原电池,如图所示:

其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。
①MnO2原电池中,MnO2为原电池的
②FeS2原电池负极上的电极反应式为
您最近一年使用:0次
解题方法
4 . 硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)氨硼烷(H3NBH3)是目前最具潜力的储氢材料之一。
①氨硼烷能溶于水,其原因是___ 。
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___ 。
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
③氨硼烷电池放电时的总反应为:H3NBH3+3H2O2=NH4BO2+4H2O。写出负极电极反应___ 。
(2)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多硼酸根,其化学式为___ ;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型___ 。

(3)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:

①该晶体中Na+的配位数为___ 。标注为“1”的Na+分数坐标为___ 。
②H3BO3分子中的O—B—O的键角___ (填“大于”、“等于”或“小于”)BH 中的H—B—H的键角。
中的H—B—H的键角。
③已知硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=___ (用含ρ、NA的代数式表示);
④若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为__ 。
(1)氨硼烷(H3NBH3)是目前最具潜力的储氢材料之一。
①氨硼烷能溶于水,其原因是
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
③氨硼烷电池放电时的总反应为:H3NBH3+3H2O2=NH4BO2+4H2O。写出负极电极反应
(2)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多硼酸根,其化学式为

(3)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:

①该晶体中Na+的配位数为
②H3BO3分子中的O—B—O的键角
 中的H—B—H的键角。
中的H—B—H的键角。③已知硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=
④若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为
您最近一年使用:0次
2021高三·全国·专题练习
5 . ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
以Zn为顶点的ZnGeP2晶胞结构如图所示。
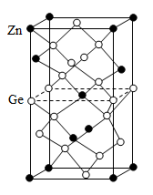
①Zn的配位数为___________ 。
②以Ge为顶点的晶胞中,Zn原子位于___________ 。
以Zn为顶点的ZnGeP2晶胞结构如图所示。

①Zn的配位数为
②以Ge为顶点的晶胞中,Zn原子位于
您最近一年使用:0次
2021高三·全国·专题练习
6 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
NaHSO3溶液在不同温度下均可被过量KIO3(IO 被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:
被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:__ 。依据I2析出所需时间可以求得NaHSO3的反应速率,将浓度均为0.020mol·L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。
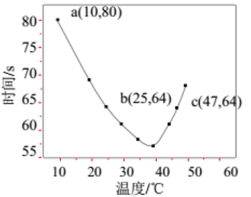
(1)图中a点对应的NaHSO3反应速率为__ mol·L-1·s-1。b、c两点对应的NaHSO3反应速率v(b)__ v(c)(填“>”、“=”、“<”)。
(2)在1L真空密闭容器中加入amolNH4I固体,t℃时发生如下反应:
NH4I(s)=NH3(g)+HI(g)①
2NH3(g)=N2(g)+3H2(g)②
2HI(g)=I2(g)+H2(g)③
达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则n(N2)=__ mol,t℃时反应①的平衡常数K值为__ (用字母表示)。
NaHSO3溶液在不同温度下均可被过量KIO3(IO
 被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:
被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:
(1)图中a点对应的NaHSO3反应速率为
(2)在1L真空密闭容器中加入amolNH4I固体,t℃时发生如下反应:
NH4I(s)=NH3(g)+HI(g)①
2NH3(g)=N2(g)+3H2(g)②
2HI(g)=I2(g)+H2(g)③
达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则n(N2)=
您最近一年使用:0次
名校
解题方法
7 . 明矾晶体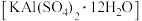 在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含
在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含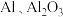 及少量
及少量 和
和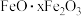 )可制备明矾,工艺流程如图:
)可制备明矾,工艺流程如图:

回答下列问题:
(1)“滤渣①”的主要成分是___________ (填化学式)。
(2)加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体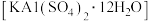 ,则“一系列操作”是
,则“一系列操作”是___________ 、___________ 、___________ 、洗涤、干燥。
(3)流程中加入 的作用是
的作用是___________ ,写出反应的离子方程式:___________ 。
(4)若将铝灰投入过量的氢氧化钠溶液中,所得溶液的溶质除 外,还含有
外,还含有___________ (填化学式)。写出生成气体的该反应的化学方程式:___________ 。
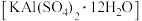 在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含
在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含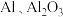 及少量
及少量 和
和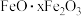 )可制备明矾,工艺流程如图:
)可制备明矾,工艺流程如图:
回答下列问题:
(1)“滤渣①”的主要成分是
(2)加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体
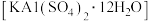 ,则“一系列操作”是
,则“一系列操作”是(3)流程中加入
 的作用是
的作用是(4)若将铝灰投入过量的氢氧化钠溶液中,所得溶液的溶质除
 外,还含有
外,还含有
您最近一年使用:0次
2021-05-15更新
|
358次组卷
|
6卷引用:3.2.1 合金-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)3.2.1 合金-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)专题七 金属材料(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)易错专题24 铝及其化合物的两性特点-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)贵州省黔南州瓮安二中2020-2021学年高一下学期第一次月考化学试题广东省湛江市2020-2021学年高一下学期期中考试化学试题广东省江门市蓬江区培英中学2021-2022学年高一下学期期中考试化学试题
名校
8 . 根据物质的组成、结构等信息可以预测其性质或用途。下列预测中,明显不合理 的是
A.根据化合价预测,高铜酸钠(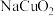 )与 )与 可生成硫酸盐 可生成硫酸盐 |
B.根据组成预测,铝酸三钙(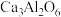 )溶于足量盐酸,生成白色沉淀 )溶于足量盐酸,生成白色沉淀 |
| C.根据在周期表中位置预测,单质砷(第ⅤA族)是重要的半导体材料 |
D.根据结构预测,葡萄糖[ ]溶液中加入新制氢氧化铜,溶液呈绛蓝色 ]溶液中加入新制氢氧化铜,溶液呈绛蓝色 |
您最近一年使用:0次
2021-05-10更新
|
524次组卷
|
3卷引用:专题讲座(五) “位-构-性”综合推断题的解题方法(精练)-2022年高考化学一轮复习讲练测
(已下线)专题讲座(五) “位-构-性”综合推断题的解题方法(精练)-2022年高考化学一轮复习讲练测浙江省金华十校2021届高三4月模拟考试化学试题浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题
名校
9 . 材料是人类赖以生存和发展的物质基础。下列有关物质的说法正确的是
| A.石英玻璃、碳化硅陶瓷、水泥、石墨烯都是新型无机非金属材料 |
| B.晶体硅的主要用途是制造光导纤维 |
| C.汽车中小摆件“苹果花”的动力是以Si为原料制作的太阳能电池 |
| D.普通玻璃的主要成分为纯碱、石灰石、石英砂 |
您最近一年使用:0次
2021-05-22更新
|
468次组卷
|
9卷引用:课时20 碳、硅与无机非金属材料-2022年高考化学一轮复习小题多维练(全国通用)
(已下线)课时20 碳、硅与无机非金属材料-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)黑龙江省双鸭山市第一中学2020-2021学年高一下学期期中考试化学试题山西省榆次第一中学校2021-2022学年高一下学期期中线上测试化学试题湖南省怀化市第五中学2022-2023学年高一下学期期中考试化学试题广东省深圳科学高中2021-2022学年高一下学期在线学习检测化学试题安徽省安庆市第九中学2022-2023学年高一下学期期中考试化学试题
10 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
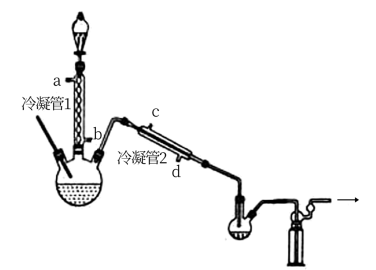
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2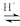
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
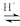
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次



