1 . 化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系错误 的是
| 选项 | 用途 | 性质或原理 |
| A | 自来水厂用氯气来杀菌、消毒 | 氯气(Cl2)具有强氧化性 |
| B | Na2O2常用作潜水艇或呼吸面具的供氧剂 | Na2O2与H2O、CO2反应产生O2 |
| C | 工业上常用绿矾(FeSO4·7H2O)处理废水中含有的高锰酸根离子(MnO ) ) | Fe2+具有还原性 |
| D | 用小苏打治疗胃酸过多 | NaHCO3可中和胃酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-20更新
|
420次组卷
|
3卷引用:2022年海南省高考真题变式题1-14
2 . 下列物质与危险化学品标志的对应关系错误的是
 |  |  |  |
| A.氢气 | B.高锰酸钾 | C.浓硫酸 | D.汽油 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-26更新
|
983次组卷
|
3卷引用:2019年高考海南卷化学试题变式题(单选题)
解题方法
3 . CO2可用于制备CH4、合成气(CO、H2),是CO2资源化利用的重要途径。
(1)CO2甲烷化过程可能发生反应:
i.
ii.
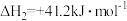
iii.
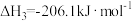
①
___________  。
。
②利用不同催化剂,在一定温度和反应时间条件下,测得产物的生成速率与催化剂的关系如图1.可知有利于制甲烷的催化剂是___________ 。
③压强一定时,按照 投料,发生上述反应,
投料,发生上述反应, 的平衡转化率与温度的关系如图2。
的平衡转化率与温度的关系如图2。
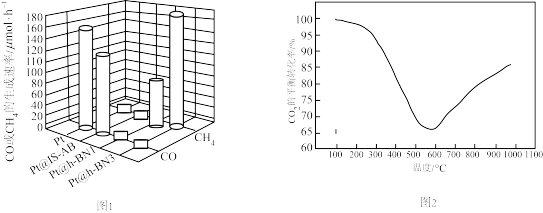
请解释温度高于600℃之后,随着温度升高 转化率增大的原因
转化率增大的原因___________ 。
(2)利用CO、 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
①由此可知,P1_____ P2(填“大于”或“小于”)。有利于提高CO平衡转化率的措施是______ 。
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为_____ ,该反应的压强平衡常数Kp=_______ (kPa)2(用分压代替浓度,分压=总压×该组分物质的量分数,用P2的式子表示)。
(1)CO2甲烷化过程可能发生反应:
i.

ii.

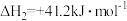
iii.

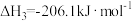
①

 。
。②利用不同催化剂,在一定温度和反应时间条件下,测得产物的生成速率与催化剂的关系如图1.可知有利于制甲烷的催化剂是
③压强一定时,按照
 投料,发生上述反应,
投料,发生上述反应, 的平衡转化率与温度的关系如图2。
的平衡转化率与温度的关系如图2。
请解释温度高于600℃之后,随着温度升高
 转化率增大的原因
转化率增大的原因(2)利用CO、
 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:| 温度/℃ 转化率 压强/kPa | 50 | 100 | 150 | 200 | 250 | 300 |
| P1 | 0.82 | 0.70 | 0.34 | 0.12 | 0.04 | 0.02 |
| P2 | 0.90 | 0.86 | 0.76 | 0.48 | 0.20 | 0.10 |
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为
您最近一年使用:0次
名校
解题方法
4 . 磷、碳、氢、氧等非金属及其化合物用途广泛。回答下列问题:
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为_______ 。(用NA表示阿伏伽德罗常数的值)
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为_______ 。
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为_______ ,产生的阳离子的空间结构为_______ 。
(2)分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 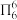 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为_______ ,一定在同一平面上的原子有_______ 个;乙醇显中性而苯酚显酸性的原因是:在大π键中氧的p电子云向苯环转移,_______ 。
(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。
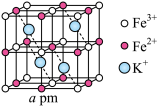
①该化合物的化学式为_______ 。
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g•cm-3(阿伏加德罗常数为NA)
(1)白磷(P4)在氯气中燃烧可生成PCl3和PCl5。
①31 g白磷(P4)中含有化学键的数目为
②形成PCl5时,P原子的一个3s电子激发入3d轨道后参与成键,该激发态的价电子排布式为
③研究表明,在加压条件下PCl5于148℃液化时能发生与水类似的自耦电离,形成一种能导电的熔体,其电离方程式为
(2)分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 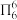 )。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为
)。一种观点认为,苯酚羟基中的O原子是sp2杂化则苯酚中的大π键可表示为(3)可溶性普鲁士蓝晶体属立方晶系,晶胞棱长为a pm,铁-氰骨架组成的小立方体中,Fe粒子在顶点,CN—在棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图所示(CN—在图中省略)。

①该化合物的化学式为
②若所有铁粒子均视为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
5 . 尼泊金甲酯和香兰素在食品、化妆品行业有广泛用途。它们的结构简式如下:

(1)香兰素中显酸性的官能团是_______ (填名称)。
(2)下列说法中,正确的是_______。
(3)大茴香酸与香兰素互为同分异构体,具备以下5个特点。大茴香酸的结构简式为_______ 。
a.分子中含有甲基 b.遇 溶液不显色 c.能与
溶液不显色 c.能与 溶液反应 d.不能发生水解反应 e.苯环上的一氯代物只有两种
溶液反应 d.不能发生水解反应 e.苯环上的一氯代物只有两种
(4)以丁香油酚为原料,通过下列路线合成香兰素。
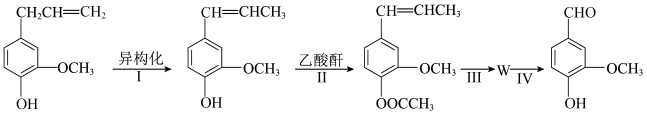
(注:分离方法和其他产物已经略去;乙酸酐的结构简式为(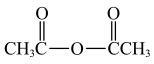 )
)
①由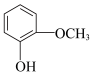 和
和 合成丁香油酚的反应类型为
合成丁香油酚的反应类型为_______ 。
②步骤Ⅱ中,反应的化学方程式为_______ 。

(1)香兰素中显酸性的官能团是
(2)下列说法中,正确的是_______。
A.尼泊金甲酯和香兰素分子都是 |
| B.尼泊金甲酯和香兰素都能与溴水发生反应 |
C.1mol尼泊金甲酯或香兰素均能与 发生加成反应 发生加成反应 |
| D.利用新制的氢氧化铜可以鉴别尼泊金甲酯和香兰素 |
a.分子中含有甲基 b.遇
 溶液不显色 c.能与
溶液不显色 c.能与 溶液反应 d.不能发生水解反应 e.苯环上的一氯代物只有两种
溶液反应 d.不能发生水解反应 e.苯环上的一氯代物只有两种(4)以丁香油酚为原料,通过下列路线合成香兰素。

(注:分离方法和其他产物已经略去;乙酸酐的结构简式为(
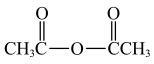 )
)①由
 和
和 合成丁香油酚的反应类型为
合成丁香油酚的反应类型为②步骤Ⅱ中,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . VA族氮、磷、砷(As)、锑(Sb)元素及其化合物应用广泛。 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷(
。工业上用白磷( )与
)与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元中强酸
反应制备一元中强酸 。雌黄
。雌黄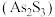 和
和 在盐酸中反应转化为雄黄(
在盐酸中反应转化为雄黄( )和
)和 (沸点114℃)并放出
(沸点114℃)并放出 气体。锑是带有银色光泽的灰色金属,其氧化物
气体。锑是带有银色光泽的灰色金属,其氧化物 可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷(
。工业上用白磷( )与
)与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元中强酸
反应制备一元中强酸 。雌黄
。雌黄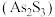 和
和 在盐酸中反应转化为雄黄(
在盐酸中反应转化为雄黄( )和
)和 (沸点114℃)并放出
(沸点114℃)并放出 气体。锑是带有银色光泽的灰色金属,其氧化物
气体。锑是带有银色光泽的灰色金属,其氧化物 可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是
可用于制造耐火材料;锑能与铅形成用途广泛的合金。下列说法正确的是A. 是由极性键形成的非极性分子 是由极性键形成的非极性分子 |
B.P4是正四面体形分子,其中P-P-P夹角为 |
| C.VA族元素单质的晶体类型相同 |
D.基态砷原子(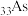 )核外电子排布式为 )核外电子排布式为 |
您最近一年使用:0次
2023-03-01更新
|
718次组卷
|
5卷引用:单项选择题
(已下线)单项选择题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)选择题1-5江苏省连云港市2022-2023学年高三下学期2月调研考试化学试题江苏省常州市第一中2023-2024学年高二下学期5月月考化学试题
解题方法
7 . 明末科学家宋应星出版的《天工开物》中记载了有关“五金”的内容: 黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间
黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间 贸迁有无,
贸迁有无, 。下列解释错误的是
。下列解释错误的是
 黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间
黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间 贸迁有无,
贸迁有无, 。下列解释错误的是
。下列解释错误的是| A.明代使用的釜、鬵一类的炊具都属于青铜合金 |
| B.添加了铬、镍的不锈钢菜刀和农具使用后若不保养,也会生锈 |
| C.金属的另一个用途就是铸成钱币作为贸易交往中的流通手段 |
| D.黑铁在空气中发生的腐蚀主要是电化学腐蚀 |
您最近一年使用:0次
解题方法
8 . 纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,以主要成分为CuFeS2的黄铜矿(含有杂质SiO2)为原料制取纳米Cu2O的一种工艺流程如图所示:
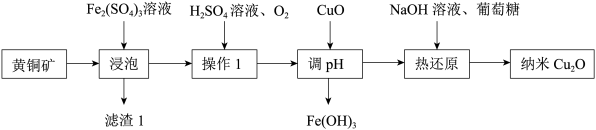
请回答下列问题:
(1)“滤渣1”中含有硫单质及_______ ,“浸泡”中反应的离子方程式为_______ 。
(2)“操作1”的目的是_______ 。
(3)“调pH”的过程中能否用CuCO3来代替CuO_______ (填“能”或“否”),要使Fe3+完全沉淀,则溶液的pH至少为_______ (已知该工艺条件下Ksp[Fe(OH)3]≈8×10-38,Kw≈1×10-14,lg2≈0.3,化学上认为当离子浓度小于1×10-5mol·L-1时沉淀完全)。
(4)“热还原”的实验现象是_______ 。
(5)现代工业也可用铜作电极,电解食盐水制备Cu2O,电解过程中首先生成CuCl(难溶于水),则生成氧化亚铜的化学方程式为_______ ;与用黄铜矿制备Cu2O工艺相比电解法的优点有_______ 。

请回答下列问题:
(1)“滤渣1”中含有硫单质及
(2)“操作1”的目的是
(3)“调pH”的过程中能否用CuCO3来代替CuO
(4)“热还原”的实验现象是
(5)现代工业也可用铜作电极,电解食盐水制备Cu2O,电解过程中首先生成CuCl(难溶于水),则生成氧化亚铜的化学方程式为
您最近一年使用:0次
9 . 锰酸锂(LiMn2O4)在电池材料领域有重要用途,可用硫铁矿(主要成分为FeS2)、软锰矿(主要成分为MnO2,含有少量的Fe2O3、Al2O3等杂质)、回收的工业废酸(主要成分为H2SO4)为原料制备,其工业流程如下图所示:
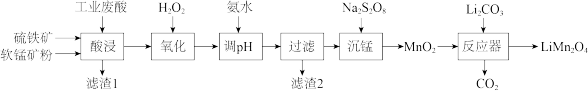
(1)“滤渣1”的主要成分为_______ ,“酸浸”过程中,工业废酸不宜加得过多的原因是_______ 。
(2)已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34;②常温下,氢氧化物沉淀的条件:A13+、Fe3+完全沉淀的pH分别为4.7、3.2;Mn2+开始沉淀的pH为8.1。若氧化后c(Al3+)=0.02mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?_______ (列式计算);要除去Fe3+和Al3+,需要调节溶液的pH的范围为_______ 。
(3)①“沉锰”反应在酸性条件下完成,写出反应的离子方程式_______ ;
②下列关于沉锰制备高纯MnO2的说法中,正确的是_______ (填标号)。
a.若沉锰反应时加入足量浓盐酸并加热,MnO2的产率将降低
b.若沉锰后进行过滤操作,为了加快过滤速率,不断用玻璃棒搅拌
c.过滤所得MnO2须进行洗涤,为检验是否洗涤干净,可通过检测洗出液中是否存在 来判断
来判断
(4)Li2CO3与MnO2按物质的量之比1:4混合均匀加热制取LiMn2O4,反应器中的反应过程为:升温到515℃时,Li2CO3开始分解产生Li2O和CO2;升温到566℃时,MnO2开始分解产生另一种气体X是_______ ,X恰好与Li2CO3分解反应产生的CO2物质的量相等,同时得到固体Y是_______ ;升温到720°C时,Li2O和固体Y发生反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂,写出反应的化学方程式_______ 。

(1)“滤渣1”的主要成分为
(2)已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34;②常温下,氢氧化物沉淀的条件:A13+、Fe3+完全沉淀的pH分别为4.7、3.2;Mn2+开始沉淀的pH为8.1。若氧化后c(Al3+)=0.02mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?
(3)①“沉锰”反应在酸性条件下完成,写出反应的离子方程式
②下列关于沉锰制备高纯MnO2的说法中,正确的是
a.若沉锰反应时加入足量浓盐酸并加热,MnO2的产率将降低
b.若沉锰后进行过滤操作,为了加快过滤速率,不断用玻璃棒搅拌
c.过滤所得MnO2须进行洗涤,为检验是否洗涤干净,可通过检测洗出液中是否存在
 来判断
来判断(4)Li2CO3与MnO2按物质的量之比1:4混合均匀加热制取LiMn2O4,反应器中的反应过程为:升温到515℃时,Li2CO3开始分解产生Li2O和CO2;升温到566℃时,MnO2开始分解产生另一种气体X是
您最近一年使用:0次
解题方法
10 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。
(1)碳族元素位于周期表_______ 区,基态锗原子外围电子的轨道表示式为_______ ,基态锗原子核外有_______ 种空间运动状态不同的电子。
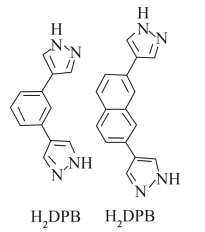
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是_______ 。
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:
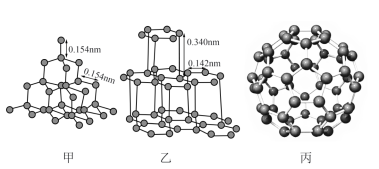
①12g金刚石和石墨中含有的σ键数目之比为_______ 。
②金刚石的熔点高于C60,但低于石墨,原因是_______ 。
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是_______ 。
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:
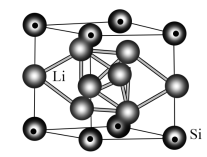
①该晶体的化学式为_______ 。
②若晶胞参数为apm,该晶体的密度ρ=_______  。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:

①12g金刚石和石墨中含有的σ键数目之比为
②金刚石的熔点高于C60,但低于石墨,原因是
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:

①该晶体的化学式为
②若晶胞参数为apm,该晶体的密度ρ=
 。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
您最近一年使用:0次



