名校
解题方法
1 . 类比迁移的思维方法可以推测许多物质的性质。但类比是相对的,不能违背客观事实。下列类比迁移结果正确的是
A. 分子的空间结构为三角锥形,则 分子的空间结构为三角锥形,则 分子的空间结构也为三角锥形 分子的空间结构也为三角锥形 |
B. 与浓硫酸共热可制 与浓硫酸共热可制 ,则 ,则 与浓硫酸共热可制 与浓硫酸共热可制 |
| C.乙酸不能使酸性高锰酸钾溶液褪色,则乙二酸也不能使酸性高锰酸钾溶液褪色 |
D.将少量 通入 通入 溶液中生成 溶液中生成 ,则将少量 ,则将少量 通入 通入 溶液中生成 溶液中生成 |
您最近一年使用:0次
2024-06-02更新
|
251次组卷
|
2卷引用:甘肃省陇南市部分学校2023-2024学年高三下学期化学押题考试(三模)化学试题
名校
解题方法
2 . 掌握化学实验技能是进行科学探究的基本保证。下列有关实验操作原理描述正确的是
A.实验室配制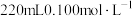 邻苯二甲酸氢钾溶液,可选用 邻苯二甲酸氢钾溶液,可选用 规格的容量瓶 规格的容量瓶 |
| B.除去苯中混有的苯酚,可加入溴水后过滤 |
| C.蒸馏、萃取、重结晶和色谱法都可用于分离、提纯有机物 |
D.实验室用熟石灰与 固体混合加热制取氨气 固体混合加热制取氨气 |
您最近一年使用:0次
2024-06-02更新
|
262次组卷
|
2卷引用:甘肃省陇南市部分学校2023-2024学年高三下学期化学押题考试(三模)化学试题
名校
解题方法
3 . 中华文化博大精深,蕴含着许多化学知识。下列说法正确的是
| A.“何意百炼刚,化为绕指柔”中,经“百炼”的钢的硬度比纯铁的硬度小 |
B.“西真人醉忆仙家。飞佩丹霞羽化”中所呈现的丹霞地貌是由于岩层中含有 |
| C.杭州第19届亚运会吉祥物“琮琮”的名字源自良渚玉琮,玉琮的主要材质是铜锌合金 |
| D.明荷花纹玉壶的雕刻过程中发生了化学变化 |
您最近一年使用:0次
2024-06-02更新
|
288次组卷
|
2卷引用:甘肃省陇南市部分学校2023-2024学年高三下学期化学押题考试(三模)化学试题
解题方法
4 . 磷酸锌 ,在水中几乎不溶,其在水中的溶解度随温度的升高而降低,常用作氯化橡胶合成高分子材料的阻燃剂。实验室采用“氨—碳酸铵浸取法”制备磷酸锌的实验步骤如下:
,在水中几乎不溶,其在水中的溶解度随温度的升高而降低,常用作氯化橡胶合成高分子材料的阻燃剂。实验室采用“氨—碳酸铵浸取法”制备磷酸锌的实验步骤如下:
步骤I:分别配制 的
的 溶液和
溶液和 的氨水,并将二者以体积比为
的氨水,并将二者以体积比为 混合。
混合。
步骤Ⅱ:在 下,用足量的
下,用足量的 、氨水混合液浸取粗
、氨水混合液浸取粗 (杂质难溶,且不参与反应),装置如下图甲。浸取后,过滤除去杂质得到
(杂质难溶,且不参与反应),装置如下图甲。浸取后,过滤除去杂质得到 溶液。
溶液。
步骤Ⅲ:向 溶液中分批滴加稍过量的
溶液中分批滴加稍过量的 溶液,保持
溶液,保持 、回流条件下发生转化反应,装置如下图乙所示。
、回流条件下发生转化反应,装置如下图乙所示。
(1)图甲中有一处错误,请指出_______ ,仪器D的名称为_______ 。
(2)装置E的作用是_______ ,步骤I中配制 溶液时,最好选用规格为
溶液时,最好选用规格为_______ (填字母)的量筒量取蒸馏水。
a. b.
b. c.
c. d.
d.
(3)步骤Ⅱ中“浸取”粗 时,不采取更高温度的原因是
时,不采取更高温度的原因是_______ ;“浸取”过程中发生反应的化学方程式为_______ 。
(4)步骤Ⅲ充分反应后经过滤、洗涤、干燥得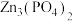 ,洗涤沉淀时,用
,洗涤沉淀时,用_______ (填“热水”或“冷水”),原因是_______ 。
(5)步骤Ⅲ中转化反应的主反应除生成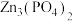 外,还生成一种磷酸正盐和一种温室气体,则该主反应的化学方程式为
外,还生成一种磷酸正盐和一种温室气体,则该主反应的化学方程式为_______ 。
(6)本实验中使用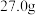 质量分数为
质量分数为 的粗
的粗 ,最终得到
,最终得到 ,则该实验中
,则该实验中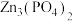 的产率为
的产率为_______ 。
 ,在水中几乎不溶,其在水中的溶解度随温度的升高而降低,常用作氯化橡胶合成高分子材料的阻燃剂。实验室采用“氨—碳酸铵浸取法”制备磷酸锌的实验步骤如下:
,在水中几乎不溶,其在水中的溶解度随温度的升高而降低,常用作氯化橡胶合成高分子材料的阻燃剂。实验室采用“氨—碳酸铵浸取法”制备磷酸锌的实验步骤如下:步骤I:分别配制
 的
的 溶液和
溶液和 的氨水,并将二者以体积比为
的氨水,并将二者以体积比为 混合。
混合。步骤Ⅱ:在
 下,用足量的
下,用足量的 、氨水混合液浸取粗
、氨水混合液浸取粗 (杂质难溶,且不参与反应),装置如下图甲。浸取后,过滤除去杂质得到
(杂质难溶,且不参与反应),装置如下图甲。浸取后,过滤除去杂质得到 溶液。
溶液。步骤Ⅲ:向
 溶液中分批滴加稍过量的
溶液中分批滴加稍过量的 溶液,保持
溶液,保持 、回流条件下发生转化反应,装置如下图乙所示。
、回流条件下发生转化反应,装置如下图乙所示。
(1)图甲中有一处错误,请指出
(2)装置E的作用是
 溶液时,最好选用规格为
溶液时,最好选用规格为a.
 b.
b. c.
c. d.
d.
(3)步骤Ⅱ中“浸取”粗
 时,不采取更高温度的原因是
时,不采取更高温度的原因是(4)步骤Ⅲ充分反应后经过滤、洗涤、干燥得
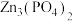 ,洗涤沉淀时,用
,洗涤沉淀时,用(5)步骤Ⅲ中转化反应的主反应除生成
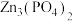 外,还生成一种磷酸正盐和一种温室气体,则该主反应的化学方程式为
外,还生成一种磷酸正盐和一种温室气体,则该主反应的化学方程式为(6)本实验中使用
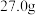 质量分数为
质量分数为 的粗
的粗 ,最终得到
,最终得到 ,则该实验中
,则该实验中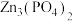 的产率为
的产率为
您最近一年使用:0次
名校
解题方法
5 . 下列化学用语表达正确的是
A.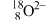 的结构示意图: 的结构示意图: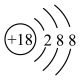 |
B.基态 的价电子排布图: 的价电子排布图: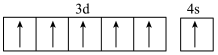 |
C.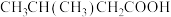 用系统命名法命名:3-甲基丁酸 用系统命名法命名:3-甲基丁酸 |
D. 的VSEPR模型: 的VSEPR模型: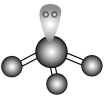 |
您最近一年使用:0次
6 . 资源和环境问题仍是社会关注的焦点。碳捕集、利用与封存(简称 ),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离
),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离 ,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
(1)一定条件下, 催化加氢制
催化加氢制 时,发生的主要反应有:
时,发生的主要反应有:
反应①:
反应②: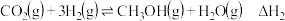
反应③:
(1)反应②的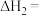
_______  ,该反应的自发条件是
,该反应的自发条件是_______ (填“低温”“高温”或“任意温度”)。
(2) 催化加氢法可制备乙烯,反应原理为
催化加氢法可制备乙烯,反应原理为 。向
。向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示: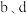 分别代表的是
分别代表的是_______ 、_______ 的物质的量随温度的变化关系。
②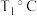 时,
时, 的平衡转化率为
的平衡转化率为_______ (结果保留三位有效数字)。
(3)一定温度下,分别按 起始物质的量之比为
起始物质的量之比为 发生反应
发生反应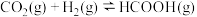 ,保持总压强为
,保持总压强为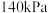 ,测得
,测得 的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为_______ 。X点条件下,用平衡分压代替平衡浓度计算的平衡常数
_______  (已知:分压=总压×物质的量分数)。
(已知:分压=总压×物质的量分数)。 材料作光电阴极,以
材料作光电阴极,以 饱和的
饱和的 的
的 溶液作电解液
溶液作电解液 ,将
,将 转化为
转化为 ,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
,原理如图丙所示。根据图示,写出光电阴极的电极反应式:_______ 。
 ),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离
),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离 ,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:(1)一定条件下,
 催化加氢制
催化加氢制 时,发生的主要反应有:
时,发生的主要反应有:反应①:

反应②:
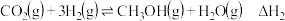
反应③:

(1)反应②的
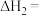
 ,该反应的自发条件是
,该反应的自发条件是(2)
 催化加氢法可制备乙烯,反应原理为
催化加氢法可制备乙烯,反应原理为 。向
。向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
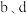 分别代表的是
分别代表的是②
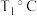 时,
时, 的平衡转化率为
的平衡转化率为(3)一定温度下,分别按
 起始物质的量之比为
起始物质的量之比为 发生反应
发生反应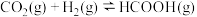 ,保持总压强为
,保持总压强为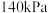 ,测得
,测得 的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
 (已知:分压=总压×物质的量分数)。
(已知:分压=总压×物质的量分数)。
 材料作光电阴极,以
材料作光电阴极,以 饱和的
饱和的 的
的 溶液作电解液
溶液作电解液 ,将
,将 转化为
转化为 ,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
您最近一年使用:0次
名校
7 . M、X、Y、Z、Q为相邻两个短周期的主族元素,且原子序数依次增大。这五种元素可形成化合物甲,其结构式如图所示,1mol甲含58mol电子,并且含有1mol配位键。下列说法正确的是
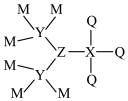
| A.Q是五种元素中原子半径最大的 |
B.水中溶解性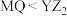 |
| C.Q、Y、Z三种元素的最简单氢化物具有相同的电子数 |
D.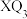 中所有原子均达到 中所有原子均达到 稳定结构 稳定结构 |
您最近一年使用:0次
2024-05-30更新
|
146次组卷
|
3卷引用:2024届甘肃省高三下学期二模化学试题
名校
解题方法
8 . 氢能是一种重要的清洁能源,由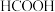 可以制得
可以制得 。在催化剂作用下,
。在催化剂作用下,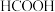 催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是
催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是
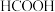 可以制得
可以制得 。在催化剂作用下,
。在催化剂作用下,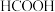 催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是
催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是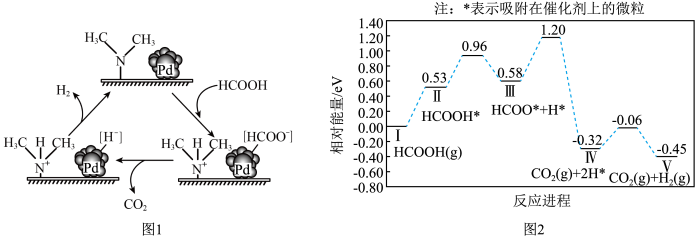
A.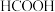 催化释放氢的过程中有非极性键的断裂与形成 催化释放氢的过程中有非极性键的断裂与形成 |
B.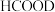 催化释放氢反应除生成 催化释放氢反应除生成 外,还生成 外,还生成 |
C.在催化剂表面解离 键比解离 键比解离 键难 键难 |
D.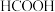 催化释放氢的热化学方程式为: 催化释放氢的热化学方程式为: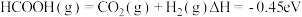 |
您最近一年使用:0次
2024-05-29更新
|
297次组卷
|
3卷引用:甘肃省民乐县第一中学2023-2024学年高三下学期5月第一次模拟考化学试卷
名校
解题方法
9 . 下列实验操作及现象与实验结论不相符的是
| 选项 | 实验目的 | 实验操作及现象 | 实验结论 |
| A | 检验乙醇中是否含有水 | 向乙醇中加入无水硫酸铜固体,固体变浅蓝色 | 乙醇中含有水 |
| B | 检验某溶液中是否含 | 向某溶液中滴加硝酸酸化的 溶液,有白色沉淀生成 溶液,有白色沉淀生成 | 该溶液中可能含有 |
| C | 配制1.00 的 的 溶液 溶液 | 称取10.6g  固体于100mL容量瓶中,加入蒸馏水溶解至液面与容量瓶刻度线相平 固体于100mL容量瓶中,加入蒸馏水溶解至液面与容量瓶刻度线相平 | 成功配制1.00 的 的 溶液 溶液 |
| D | 探究 的还原性 的还原性 | 向盛有硫酸亚铁溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制的氯水,溶液呈红色 |  具有还原性 具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-29更新
|
711次组卷
|
8卷引用:甘肃省白银市靖远县2024届高三下学期全真模拟化学试题
名校
10 . 钒属于稀有金属,在天然矿物中含量很低。从硫酸厂废弃的钒触媒(主要成分为 、
、 、
、 、
、 )中回收
)中回收 的流程如图所示。
的流程如图所示。
(1)V元素在元素周期表中的位置为___________ 。
(2)“活化焙烧”的目的是使 转化为
转化为 。已知反应过程中
。已知反应过程中 能被
能被 氧化生成
氧化生成 ,
, 自身分解也可以生成
自身分解也可以生成 ,则该步骤所得尾气中硫元素的主要存在形式有
,则该步骤所得尾气中硫元素的主要存在形式有___________ (填化学式)。
(3)常温下稀 溶液的pH
溶液的pH___________ 7(填“>”“<”或“=”,已知 的
的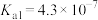 ,
, ,
, 的
的 )。“浸出”步骤中有
)。“浸出”步骤中有 生成,写出该步骤中
生成,写出该步骤中 转化为
转化为 的离子方程式
的离子方程式___________ 。“活化焙烧”时可能有少量的 未完全转化,推测“浸出”步骤中加入少量
未完全转化,推测“浸出”步骤中加入少量 的主要作用是
的主要作用是___________ 。
(4)“浓缩”后,溶液中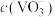 的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
___________ mol/L[ ,假设沉钒过程中溶液体积不变]。
,假设沉钒过程中溶液体积不变]。
(5)含钒离子在储能领域应用广泛。如图所示的全钒液储能电池装置可实现化学能和电能相互转化,该装置储能时电势高的电极的电极反应式为___________ ,若储能时转移2mol电子,则正极液储罐中 的净变化为
的净变化为___________ mol。
 、
、 、
、 、
、 )中回收
)中回收 的流程如图所示。
的流程如图所示。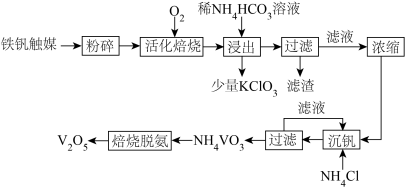
(1)V元素在元素周期表中的位置为
(2)“活化焙烧”的目的是使
 转化为
转化为 。已知反应过程中
。已知反应过程中 能被
能被 氧化生成
氧化生成 ,
, 自身分解也可以生成
自身分解也可以生成 ,则该步骤所得尾气中硫元素的主要存在形式有
,则该步骤所得尾气中硫元素的主要存在形式有(3)常温下稀
 溶液的pH
溶液的pH 的
的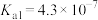 ,
, ,
, 的
的 )。“浸出”步骤中有
)。“浸出”步骤中有 生成,写出该步骤中
生成,写出该步骤中 转化为
转化为 的离子方程式
的离子方程式 未完全转化,推测“浸出”步骤中加入少量
未完全转化,推测“浸出”步骤中加入少量 的主要作用是
的主要作用是(4)“浓缩”后,溶液中
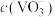 的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
的浓度为0.2mo/L,“沉钒”步骤中钒元素的沉降率为98%,则沉钒后溶液中
 ,假设沉钒过程中溶液体积不变]。
,假设沉钒过程中溶液体积不变]。(5)含钒离子在储能领域应用广泛。如图所示的全钒液储能电池装置可实现化学能和电能相互转化,该装置储能时电势高的电极的电极反应式为
 的净变化为
的净变化为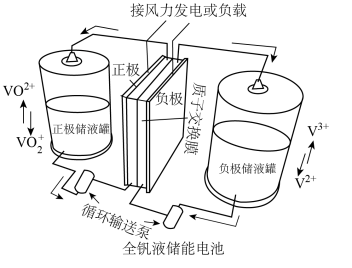
您最近一年使用:0次
2024-05-27更新
|
46次组卷
|
2卷引用:2024届甘肃省民乐县第一中学高三下学期5月模拟考试化学试卷



