名校
解题方法
1 . 压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有 ,直接使用会造成大气污染,
,直接使用会造成大气污染, 菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是
菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是
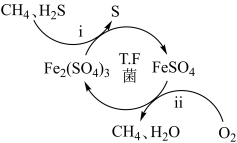
 ,直接使用会造成大气污染,
,直接使用会造成大气污染, 菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是
菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是
| A.该脱硫过程不能在高温下进行 |
B.该脱硫过程是将 转化为 转化为 |
C. 可以视为该脱硫过程中的催化剂 可以视为该脱硫过程中的催化剂 |
D.该脱硫过程的总反应为: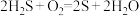 |
您最近一年使用:0次
2021-01-29更新
|
307次组卷
|
14卷引用:甘肃省天水市第一中学2021届高三上学期第一次考试化学试题
甘肃省天水市第一中学2021届高三上学期第一次考试化学试题甘肃省天水市第一中学2019-2020学年高二下学期期末考试化学试题四川省成都市蓉城名校联盟2019-2020学年高二下学期期末联考化学试题黑龙江省哈尔滨市第九中学2021届高三上学期开学考试化学试题安徽省滁州市明光县明光中学2020-2021学年高二上学期开学考试化学试题江西省赣州市会昌县七校2021届高三联合9月月考化学试题山东省济南市商河县第一中学2021届高三上学期阶段性考试化学试题江西省红色七校(分宜中学、会昌中学、莲花中学、南城一中、任弼时中学、瑞金一中、遂川中学)2021届高三上学期第一次联考化学试题江西省吉安市2020-2021学年高一上学期期末教学质量检测化学试题(已下线)第09讲 铁及其重要化合物(精练)-2022年高考化学一轮复习讲练测辽宁省营口市第二高级中学2021-2022学年高三上学期第一次月考化学试题辽宁省兴城市高级中学2021-2022学年高三上学期10月月考化学试题四川省成都外国语学校2021-2022学年高二下学期入学考试化学试题四川省南充市阆中中学校2021-2022学年高二下学期期中学习质量检测化学试题
2 . 甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
[查阅资料]
①CO 能与银氨溶液反应:CO+2[Ag(NH3)2 ]++2OH- = 2Ag↓+2NH +CO
+CO +2NH3。
+2NH3。
②Cu2O 为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O。回答下列问题:
(1)装置A 中反应的化学方程式为_______ 。
(2)按气流方向各装置从左到右的连接顺序为 A→_______ (填字母编号)。
(3)实验中滴加稀盐酸的操作为_______ 。
(4)已知气体产物中含有 CO,则装置 C 中可观察到的现象是_______ ;装置 F 的作用为_______ 。
(5)当反应结束后,装置 D 处试管中固体全部变为红色。
①设计实验证明红色固体中含有 Cu2O:_______ 。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量 0.1mol·L-1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有 Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。

[查阅资料]
①CO 能与银氨溶液反应:CO+2[Ag(NH3)2 ]++2OH- = 2Ag↓+2NH
 +CO
+CO +2NH3。
+2NH3。②Cu2O 为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O。回答下列问题:
(1)装置A 中反应的化学方程式为
(2)按气流方向各装置从左到右的连接顺序为 A→
(3)实验中滴加稀盐酸的操作为
(4)已知气体产物中含有 CO,则装置 C 中可观察到的现象是
(5)当反应结束后,装置 D 处试管中固体全部变为红色。
①设计实验证明红色固体中含有 Cu2O:
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量 0.1mol·L-1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有 Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
| 实验步骤(不要求写 出具体操作过程) | 预期现象和结论 |
| 若观察到溶液不变蓝,则证明红色固体中含有 Cu;若观察到溶液变蓝,则不能证明红色固体中含有 Cu |
您最近一年使用:0次
2021-01-20更新
|
1431次组卷
|
13卷引用:甘肃省师范大学附属中学2019高三上学期期中复习化学试题
甘肃省师范大学附属中学2019高三上学期期中复习化学试题【校级联考】福建省莆田第一中学、第四中学2019届高三下学期一模理科综合化学试题(已下线)2021年高考化学押题预测卷(福建卷)(02)(含考试版、答题卡、参考答案、全解全析)宁夏回族自治区长庆高级中学2019届高三上学期第一次月考化学试题【全国百强校】福建省莆田第一中学2019届高三下学期第四次月考理科综合化学试题四川省南充高级中学2019-2020学年高二3月线上月考理综化学试题辽宁省五校2021届高三上学期期末联考化学试题辽宁省实验中学2021届高三上学期期末考试化学试题黑龙江省鹤岗市第一中学2021届高三下学期2月月考理综化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)四川省成都市高新区高2021届高三第四次阶段质量检测理综化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题(已下线)03 物质成分或反应产物探究类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
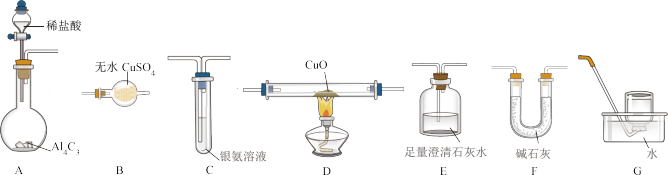
3 . 下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是( )

据此判断下列说法中正确的是( )
| A.由图1知,石墨转变为金刚石是吸热反应 |
| B.由图2知,S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g)ΔH2,则ΔH1>ΔH2 |
| C.由图3知,白磷比红磷稳定 |
| D.由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0 |
您最近一年使用:0次
2020-12-28更新
|
2156次组卷
|
64卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(理)试题甘肃省张掖市第二中学2021-2022学年高三上学期10月月考化学试题陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题高二人教版选修4 第一章 章末知识测评(一)山西省朔州市怀仁一中2019-2020学年高二上学期第一次月考化学试卷河北省鹿泉第一中学2019-2020学年高二9月月考化学试题安徽省潜山第二中学2019-2020学年高二上学期第一次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题安徽省黄山市“八校联盟”2019-2020学年高二上学期期中考试化学试题河北省唐山市海港高级中学2019-2020学年高一下学期期中考试化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第一次月考化学试题陕西省榆林市绥德县绥德中学2019-2020学年高二下学期第二次阶段性测试化学试题(已下线)1.1.2 化学反应的焓变 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1湖南省长沙市第一中学2018-2019学年高一下学期第一次阶段性测试化学试题辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二9月月考化学试题天津市和平区2018-2019高二期末考试化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第一节 反应热 教材帮安徽省安庆市宜秀区白泽湖中学2020-2021学年高二上学期第一次月考化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题湖北省襄阳市五校(宜城一中、枣阳一中、襄州一中、曾都一中、南漳一中)2020-2021学年高二上学期期中联考化学试题辽宁大石桥市第三高级中学2020-2021学年高二上学期期中考试化学试题陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题内蒙古巴彦淖尔市临河三中2020-2021学年高二10月考化学试题福建省福州市八县(市)协作校2020-2021学年高二上学期期中考试化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)四川省阆中东风中学校2020-2021学年高二上学期第三学月调研监测化学试题江苏省南京市第十二中学2020-2021学年高二上学期第一次学情调研测试化学试题四川省成都市阳安中学2020-2021学年高一下学期3月月考化学试题四川省南充市李渡中学2020-2021学年高一下学期第二次月考化学试题(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)贵州省毕节市金沙县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题湖北省枣阳一中2021-2022学年高二上学期10月月考化学试题浙江省诸暨市2018-2019学年高一下学期期末考试化学试题 湖南省邵阳市邵东市2021-2022学年高二上学期期末统考化学试题江苏省扬州市江都区大桥高级中学2021-2022学年高二上学期学情调研(二)化学试题江苏省盐城市东台创新高级中学2021-2022学年高二3月份月检测化学试题重庆市广益中学 2021-2022学年高一下学期第二次月考化学试题湖南省张家界市第一中学2022届高三下学期期中考试化学试题(已下线)第01讲 反应热 焓变(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)1.1.2 化学反应的焓变-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)四川省安岳县兴隆中学2021-2022学年高二上学期期中测试化学试题四川省广安市育才学校2022-2023学年高一上学期9月月考化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题辽宁省葫芦岛市第八高级中学2021–2022学年高二上学期期中考试化学试题浙江省海盐第二高级中学2022-2023学年高二上学期10月第一阶段检测化学试题西藏拉萨那曲高级中学2021-2022学年高二上学期期中考试化学试题辽宁省大连市滨海高中联盟2022-2023学年高一下学期期中考试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第一次调研考试化学试题江苏省苏北三市2022-2023学年高二上学期阶段调研测试化学试题四川省宜宾市第四中学校2023-2024学年高二上学期9月月考化学试题陕西省武功县普集高级中学2023-2024学年高二上学期10月月考化学试题江苏省泰州中学2023-2024学年高二上学期第二次质量检测化学试题四川省泸县第五中学2023-2024学年高二上学期10月月考化学试题宁夏六盘山高级中学2023-2024学年高二上学期第一次月考化学试题四川省内江市资中县第二中学2023-2024学年高二上学期9月月考化学试题贵州省贵阳市三新改革联盟校2023-2024学年高二上学期10月月考化学试题江苏省苏州中学2023-2024学年高二上学期10月月考化学试题辽宁省大连市第四十八中学2023-2024学年高二上学期10月月考化学试题湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题宁夏回族自治区贺兰县第二高级中学2023-2024学年高二上学期10月第一次阶段性考试化学试题
名校
4 . 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图,下列描述正确的是
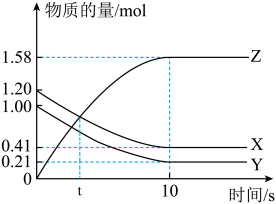

| A.t秒时该反应达到化学平衡状态 |
| B.反应开始到10 s,X物质的量浓度减少0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
您最近一年使用:0次
2020-12-26更新
|
728次组卷
|
6卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题河北省石家庄市藁城区第一中学2020-2021学年高二上学期第一次月考化学试题湖南省张家界市第一中学2022届高三下学期期中考试化学试题(已下线)专题09反应速率、化学平衡-2022年高考真题+模拟题汇编(全国卷)(已下线)专题09反应速率、化学平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题09反应速率、化学平衡-五年(2018~2022)高考真题汇编(全国卷)
名校
解题方法
5 . 碱性硼化钒(VB2)-空气电池工作时反应为4VB2+11O2=4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04 mol 电子时,B装置内共收集到0.448 L气体(标准状况下),则下列说法正确的是( )
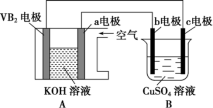
| A.VB2电极发生的电极反应为2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol·L-1 |
您最近一年使用:0次
2020-12-26更新
|
442次组卷
|
11卷引用:2015届甘肃省天水市秦安县高三第一次模拟考试化学试卷
2015届甘肃省天水市秦安县高三第一次模拟考试化学试卷甘肃省高台县第一中学2020届高三上学期期中考试化学试题2014-2015湖北省襄阳市五中高二3月月考化学试卷黑龙江省哈尔滨师范大学附属中学2019届高三上学期第一次月考化学试题四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题黑龙江省牡丹江市第一高级中学2021届高三上学期期末化学试题河南省宏力学校2020-2021学年高二上学期期末考试化学试题黑龙江省大兴安岭实验中学2021-2022学年高三上学期期末考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期末考试化学试题湖南省郴州市2022-2023学年高二上学期期末质量监测化学试题攀枝花市第十五中学校2023-2024学年高三下学期第9次半月考理科综合-高中化学
名校
解题方法
6 . ①NaOH ②Al2(SO4)3 ③Ba(NO3)2 ④FeCl3 ⑤KCl五种溶液,不用任何试剂即可鉴别,被鉴别出来的顺序依次是
| A.①②③④⑤ | B.④①②③⑤ | C.④②③①⑤ | D.①④②③⑤ |
您最近一年使用:0次
2020-12-25更新
|
208次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
名校
解题方法
7 . 短周期主族元素R、X、Y、Z的原子序数依次增大,R元素最高正价和最低负价的代数和为2,在短周期主族元素中X原子半径最大,Y的单质可与某些金属氧化物反应用于焊接钢轨,Z元素形成的单质可使湿润的有色布条褪色。下列说法错误的是
| A.最高价氧化物对应水化物的碱性:X>Y |
| B.R元素的氢化物可用作制冷剂 |
| C.Z元素分别与X、Y元素形成的化合物一定是离子化合物 |
| D.工业上常用电解法冶炼X和Y的单质 |
您最近一年使用:0次
2020-12-24更新
|
991次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题山东省聊城市2021届高三上学期期中考试化学试题(已下线)解密05 物质结构元素周期律(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
名校
解题方法
8 . 我国是少数几个拥有石煤资源的国家之一, 工业上以伴生钒的石煤(主要成分为 ,含少量
,含少量 、
、 等杂质)为原料制备钒的主要流程如下:
等杂质)为原料制备钒的主要流程如下:

已知:① 难溶于水。②
难溶于水。②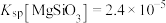 ,
,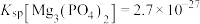 。
。
请问答下列问题:
(1)焙烧。通入空气的条件下,向石煤中加纯碱焙烧,将 转化为
转化为 的化学方程式为
的化学方程式为_____ 。为加快焙烧反应的化学反应速率,可采取的措施为_____ (任写一条)。
(2)除硅、磷。用MgSO4溶液除硅、磷时,Si、P会形成 、
、 沉淀。若沉淀后溶液中
沉淀。若沉淀后溶液中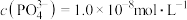 ,则
,则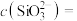
____________  。随着温度升高,除磷率会显著下降,其原因一是温度升高,
。随着温度升高,除磷率会显著下降,其原因一是温度升高, 溶解度增大,二是
溶解度增大,二是_____________ 。
(3)沉钒。该操作产生的滤液中,两种主要的溶质阴离子是____________ ;用实验方法判断此过程中沉钒完全的操作是_____________ 。
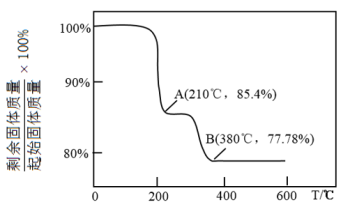
(4)灼烧。在灼烧 的过程中,固体残留率随温度变化的曲线如图所示,则
的过程中,固体残留率随温度变化的曲线如图所示,则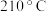 时,剩余固体物质的化学式为
时,剩余固体物质的化学式为_____________ 。
(5)还原。在高温真空条件下,用焦炭还原 可以生成钒单质,该反应的化学方程式为
可以生成钒单质,该反应的化学方程式为_____________ 。
 ,含少量
,含少量 、
、 等杂质)为原料制备钒的主要流程如下:
等杂质)为原料制备钒的主要流程如下:
已知:①
 难溶于水。②
难溶于水。②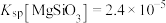 ,
,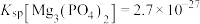 。
。请问答下列问题:
(1)焙烧。通入空气的条件下,向石煤中加纯碱焙烧,将
 转化为
转化为 的化学方程式为
的化学方程式为(2)除硅、磷。用MgSO4溶液除硅、磷时,Si、P会形成
 、
、 沉淀。若沉淀后溶液中
沉淀。若沉淀后溶液中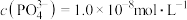 ,则
,则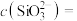
 。随着温度升高,除磷率会显著下降,其原因一是温度升高,
。随着温度升高,除磷率会显著下降,其原因一是温度升高, 溶解度增大,二是
溶解度增大,二是(3)沉钒。该操作产生的滤液中,两种主要的溶质阴离子是
(4)灼烧。在灼烧
 的过程中,固体残留率随温度变化的曲线如图所示,则
的过程中,固体残留率随温度变化的曲线如图所示,则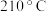 时,剩余固体物质的化学式为
时,剩余固体物质的化学式为
(5)还原。在高温真空条件下,用焦炭还原
 可以生成钒单质,该反应的化学方程式为
可以生成钒单质,该反应的化学方程式为
您最近一年使用:0次
2020-12-19更新
|
847次组卷
|
3卷引用:甘肃省武威第六中学2021届高三下学期第五次诊断考试化学试题
甘肃省武威第六中学2021届高三下学期第五次诊断考试化学试题四川省南充市2021届高三第一次诊断考试理科综合化学试卷(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)
名校
9 . 25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的盐酸,溶液的AG[AG=lg ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法错误 的是
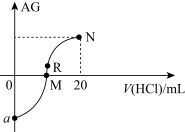
 ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法
| A.若a=-8,则Kb(XOH)=10-5 |
| B.M点表示盐酸和XOH恰好完全反应 |
| C.M点到N点,水的电离程度先增大后减小 |
| D.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-) |
您最近一年使用:0次
2020-12-15更新
|
524次组卷
|
15卷引用:甘肃省兰州市第一中学2020届高三冲刺模拟考试(一)理科综合化学试题
甘肃省兰州市第一中学2020届高三冲刺模拟考试(一)理科综合化学试题 【市级联考】山东省菏泽市2019届高三下学期第一次模拟考试理科综合化学试题【校级联考】河北省中原名校联盟2019届高三下学期3月联考理科综合化学试题福建省漳州市2020届高中毕业班第二次高考适应性测试理综化学试题山东师范大学附属中学2020届普通高等学校招生全国统一考试化学试题(模拟一)四川省泸县第五中学2022届高三三诊模拟考试理科综合化学试题四川省绵阳南山中学2020届高三下学期3月网络考试化学试题聊城一中2020届高三4月份线上模拟化学试题四川省内江市2020届高三下学期3月网络自测化学试题(已下线)考点12 盐类水解及其应用-2020年高考化学命题预测与模拟试题分类精编福建省莆田市第二中学2021届高三10月月考化学试题辽宁省大连市一〇三中学2021届高三上学期第二阶段模拟考试化学试题四川省内江市威远中学2021届高三3月月考化学试题解题达人.化学选择题(2021全国卷)巩固小卷04辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题
10 . 常温下,将NaOH溶液滴加到20mL等浓度的某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p =-lg
=-lg ]。下列叙述不正确的是
]。下列叙述不正确的是

 =-lg
=-lg ]。下列叙述不正确的是
]。下列叙述不正确的是
| A.m点对应的NaOH溶液体积小于10 mL | B.Ka(HA)为10-4.76 |
| C.l点所示溶液中:c(Na+)<c(A-)+c(HA) | D.各点水的电离程度关系:n>m>l |
您最近一年使用:0次
2020-12-11更新
|
1347次组卷
|
7卷引用:甘肃省酒泉市2023届高三下学期第一次诊断考试理综化学试题
甘肃省酒泉市2023届高三下学期第一次诊断考试理综化学试题辽宁省沈阳市法库县高级中学2022届高三下学期4月线上模拟考试化学试题黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题(已下线)小题必刷32 盐类的水解影响因素及应用——2021年高考化学一轮复习小题必刷(通用版本)黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷辽宁省沈阳市第一二〇中学2021-2022学年高三上学期第四次质量监测化学试题(已下线)专题14 水溶液中的离子平衡



