名校
1 . 科学家利用氧化锆锌作催化剂,在一定温度下将 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇 ,其原理为:
,其原理为:
 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题:
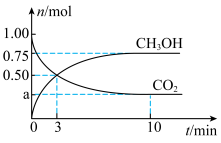
(1)图中
_____ ; 时,
时, 的转化率为
的转化率为_____ 。
(2)下列叙述正确的是_____ (填序号)。
a. 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率
b.由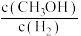 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态
c.当 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态
d.若改变催化剂,则反应达到平衡状态所需的时间一定小于
(3)该温度下达到平衡时,混合气体中 的体积分数为
的体积分数为_____ ,此时体系压强与开始时的压强之比为_____ 。
(4)其他条件不变时,下列措施不能使生成 的反应速率增大的是
的反应速率增大的是_____ (填序号)。
a.增大 的浓度
的浓度
b.将容器的容积变为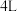
c.恒容条件下充入一定量
d.将恒温恒容容器改为绝热恒容容器
已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量_____ (填“增大”“减小”或“不变”)。
 和
和 转化为重要有机原料甲醇
转化为重要有机原料甲醇 ,其原理为:
,其原理为:
 。在容积为
。在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 发生上述反应。
发生上述反应。 和
和 的物质的量随时间变化如图所示。回答下列问题:
的物质的量随时间变化如图所示。回答下列问题:
(1)图中

 时,
时, 的转化率为
的转化率为(2)下列叙述正确的是
a.
 时
时 的生成速率等于其分解速率
的生成速率等于其分解速率b.由
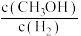 保持不变,可判断该反应达到平衡状态
保持不变,可判断该反应达到平衡状态c.当
 时,该反应一定达到平衡状态
时,该反应一定达到平衡状态d.若改变催化剂,则反应达到平衡状态所需的时间一定小于

(3)该温度下达到平衡时,混合气体中
 的体积分数为
的体积分数为(4)其他条件不变时,下列措施不能使生成
 的反应速率增大的是
的反应速率增大的是a.增大
 的浓度
的浓度b.将容器的容积变为
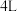
c.恒容条件下充入一定量

d.将恒温恒容容器改为绝热恒容容器
已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量
您最近一年使用:0次
2023-07-12更新
|
608次组卷
|
2卷引用:山东省潍坊市2022-2023学年高一下学期期末考试化学试题
解题方法
2 . 甲烷(CH4)在生产生活中用途广泛,常用作燃料。利用CO、CO2与H2在催化剂作用下可以合成甲烷,回答下列问题:
(1)实验测得CO(g)与H2(g)反应生成CH4(g)和H2O(g)的反应中,每生成2.24L(标准状况)CH4(g),放出热量20.64kJ,则该反应的热化学方程式为_____ 。
(2)已知有关物质的化学键键能数据如表:
试计算反应CO2(g)+4H2(g CH4(g)+2H2O(g)的焓变等于
CH4(g)+2H2O(g)的焓变等于_____ 。
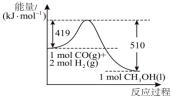
(3)根据如图所示的转化关系判断,生成16gCH3OH(l)放出_____ kJ能量。
(4)科学家已获得了气态N4分子,其空间结构为正四面体形(如图所示),已知断裂1molN-N键吸收193kJ能量,断裂1molN≡N键吸收946kJ能量。
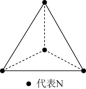
2N2=N4为____ 反应(填吸热或放热),以N4为原料替代N2合成等量NH3时,放出的热量_____ (填变多、变少或不变)。
(1)实验测得CO(g)与H2(g)反应生成CH4(g)和H2O(g)的反应中,每生成2.24L(标准状况)CH4(g),放出热量20.64kJ,则该反应的热化学方程式为
(2)已知有关物质的化学键键能数据如表:
| 化学键 | H-H | C-O | C=O | C-H | H-O |
| 键能/kJ•mol-1 | 436 | 343 | 805 | 413 | 465 |
 CH4(g)+2H2O(g)的焓变等于
CH4(g)+2H2O(g)的焓变等于(3)根据如图所示的转化关系判断,生成16gCH3OH(l)放出

(4)科学家已获得了气态N4分子,其空间结构为正四面体形(如图所示),已知断裂1molN-N键吸收193kJ能量,断裂1molN≡N键吸收946kJ能量。

2N2=N4为
您最近一年使用:0次
3 . 已知铝是一种能够和强碱溶液反应生成氢气的一种特殊金属,其反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,现向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,计算:
(1)Al的物质的量为___________ 。
(2)参加反应的NaOH的物质的量为___________ ;溶液的物质的量浓度___________ 。
(3)生成的H2在标准状况下的体积为___________ 。
(1)Al的物质的量为
(2)参加反应的NaOH的物质的量为
(3)生成的H2在标准状况下的体积为
您最近一年使用:0次
解题方法
4 . I.电解饱和食盐水的化学反应方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,现电解消耗NaCl的质量为175.5 g,则:
2NaOH+Cl2↑+H2↑,现电解消耗NaCl的质量为175.5 g,则:
(1)消耗的NaCl的物质的量是_ 。
(2)生成的Cl2在标准状况下的体积为__ 。
(3)生成的H2的质量是_ 。
II.将3.9g过氧化钠投入一定量的水中,充分反应,所得溶液加水稀释到500mL。
(4)3.9g过氧化钠的物质的量____ 。
(5)反应中生成的气体在标准状况下的体积_____ 。
 2NaOH+Cl2↑+H2↑,现电解消耗NaCl的质量为175.5 g,则:
2NaOH+Cl2↑+H2↑,现电解消耗NaCl的质量为175.5 g,则:(1)消耗的NaCl的物质的量是
(2)生成的Cl2在标准状况下的体积为
(3)生成的H2的质量是
II.将3.9g过氧化钠投入一定量的水中,充分反应,所得溶液加水稀释到500mL。
(4)3.9g过氧化钠的物质的量
(5)反应中生成的气体在标准状况下的体积
您最近一年使用:0次
2020-09-19更新
|
192次组卷
|
2卷引用:山东省潍坊市临朐县实验中学2020-2021学年高一9月月考化学试题
5 . 根据所学知识填写下列空白。
(1)在标准状况下,67.2 L CO2是__ mol,质量为__ g,含有__ 个CO2分子,其中含有_ mol氧原子。
(2)在标准状况下,1.7 g氨气所占的体积约为_ L,它与同条件下__ mol H2S含有相同的氢原子数。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_ ,R的相对原子质量为_ 。
(4仪器 的名称是
的名称是_____ 。
(1)在标准状况下,67.2 L CO2是
(2)在标准状况下,1.7 g氨气所占的体积约为
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为
(4仪器
 的名称是
的名称是
您最近一年使用:0次
6 . 标准状况下4.48 LCO2溶于100 mL3.0 mol/LNaOH溶液,所得产物成分是_____ ,物质的量为________ 。
您最近一年使用:0次
2020-04-04更新
|
101次组卷
|
2卷引用:山东临朐县实验中学2020-2021学年高一11月月考化学试题
名校
7 . 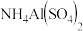 、
、 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:
(1)常温时,
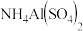 溶液的
溶液的 。
。
则溶液中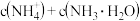
______ c 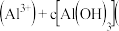 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;
;
______ 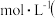 填数值
填数值 。
。
(2)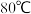 时,
时,
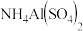 溶液的pH小于3,分析导致pH随温度变化的原因是
溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________  用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答 。
。
(3)常温时,向100mL
 溶液中滴加
溶液中滴加  NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________ 。

(4)浓度均为 溶液和
溶液和 溶液,其中
溶液,其中______ 溶液 大。
大。
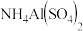 、
、 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:(1)常温时,

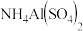 溶液的
溶液的 。
。则溶液中
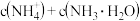
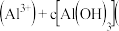 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;
;
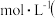 填数值
填数值 。
。(2)
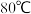 时,
时,
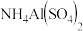 溶液的pH小于3,分析导致pH随温度变化的原因是
溶液的pH小于3,分析导致pH随温度变化的原因是 用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答 。
。(3)常温时,向100mL

 溶液中滴加
溶液中滴加  NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
(4)浓度均为
 溶液和
溶液和 溶液,其中
溶液,其中 大。
大。
您最近一年使用:0次
名校
8 . 十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
 、
、 、
、 之间的关系为
之间的关系为
______ ;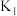 、
、 、
、 的关系为
的关系为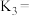
______ 。
(2)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、 等有毒气体转化为无毒气体:
等有毒气体转化为无毒气体: 对于该反应,温度不同
对于该反应,温度不同 ,其他条件相同时,下列图象正确的是
,其他条件相同时,下列图象正确的是______  填序号
填序号 。
。

(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应: 在
在 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
 时,该反应在
时,该反应在 的平均反应速率
的平均反应速率
______ ;该反应的平衡常数
______ ;
 后只改变某一条件,根据上表数据判断改变的条件可能是
后只改变某一条件,根据上表数据判断改变的条件可能是______  填序号
填序号 ;
;
A.加入一定量的活性炭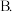 恒温恒压充入氩气
恒温恒压充入氩气
C.适当缩小容器的体积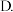 加入合适的催化剂
加入合适的催化剂
(1)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
| 热化学方程式 | 平衡常数 | |
 |  | 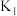 |
 |  |  |
 |  |  |
 、
、 、
、 之间的关系为
之间的关系为
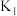 、
、 、
、 的关系为
的关系为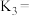
(2)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、
 等有毒气体转化为无毒气体:
等有毒气体转化为无毒气体: 对于该反应,温度不同
对于该反应,温度不同 ,其他条件相同时,下列图象正确的是
,其他条件相同时,下列图象正确的是 填序号
填序号 。
。
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:
 在
在 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:时间 浓度 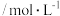 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |  |  |  |  |  |  |
 | 0 | 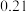 |  |  |  |  |
 | 0 | 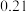 |  |  |  |  |
 时,该反应在
时,该反应在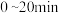 的平均反应速率
的平均反应速率

 后只改变某一条件,根据上表数据判断改变的条件可能是
后只改变某一条件,根据上表数据判断改变的条件可能是 填序号
填序号 ;
;A.加入一定量的活性炭
 恒温恒压充入氩气
恒温恒压充入氩气C.适当缩小容器的体积
 加入合适的催化剂
加入合适的催化剂
您最近一年使用:0次
名校
9 . 室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________ 倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________ ,NaHSO3溶液中的各离子浓度由大到小的顺序为________________ 。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________ (填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的
(2)室温时,NaHSO3的水解平衡常数Kh=
(3)室温时,0.1 mol/L Na2SO3溶液的pH=
您最近一年使用:0次
2018-01-10更新
|
939次组卷
|
4卷引用:山东省高密市第三中学2021-2022学年高二上学期冬学竞赛化学试题
名校
10 . 400 mL某浓度的NaOH溶液与5.6 L Cl2(标准状况)恰好完全反应,计算(写出必要的计算过程):
(1)生成的NaClO的物质的量。_____________
(2)该溶液中NaOH的物质的量浓度。__________________
(1)生成的NaClO的物质的量。
(2)该溶液中NaOH的物质的量浓度。
您最近一年使用:0次
2018-01-08更新
|
215次组卷
|
2卷引用:山东省昌邑市第一中学2017-2018学年高一上学期第二次期末模拟考试化学试题



