名校
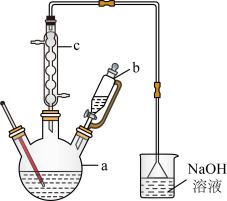
1 . 溴苯是一种化工原料,实验室合成溴苯的仪器装置示意图(夹持及加热装置略去)及有关数据如下:
(1)向a中加入15 无水苯和少量铁屑,向b中小心加入4
无水苯和少量铁屑,向b中小心加入4 液态溴。由b向a中滴入几滴液溴,有白色烟雾产生,是因为生成了
液态溴。由b向a中滴入几滴液溴,有白色烟雾产生,是因为生成了________ 气体;继续滴加至液滴完。装置c的作用是_________________ 。
(2)充分反应后,经过下列步骤分离提纯。
①向a中加入10 水,然后过滤除去未反应的铁屑。
水,然后过滤除去未反应的铁屑。
②滤液依次用10 水、8
水、8 稀
稀 溶液、10
溶液、10 水洗涤。用
水洗涤。用 溶液洗涤的作用是
溶液洗涤的作用是_________________ 。
③向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是_________________ 。
(3)经以上分离操作后,粗溴苯还含有的主要杂质为________ ;要进一步提纯,下列操作中必须进行的是________ (填写字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
物质 | 苯 | 溴 | 溴苯 |
密度/( | 0.88 | 3.12 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解性 | 不溶 | 微溶 | 不溶 |
(1)向a中加入15
 无水苯和少量铁屑,向b中小心加入4
无水苯和少量铁屑,向b中小心加入4 液态溴。由b向a中滴入几滴液溴,有白色烟雾产生,是因为生成了
液态溴。由b向a中滴入几滴液溴,有白色烟雾产生,是因为生成了(2)充分反应后,经过下列步骤分离提纯。
①向a中加入10
 水,然后过滤除去未反应的铁屑。
水,然后过滤除去未反应的铁屑。②滤液依次用10
 水、8
水、8 稀
稀 溶液、10
溶液、10 水洗涤。用
水洗涤。用 溶液洗涤的作用是
溶液洗涤的作用是③向分离出的粗溴苯中加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是
(3)经以上分离操作后,粗溴苯还含有的主要杂质为
A.重结晶 B.过滤 C.蒸馏 D.萃取
您最近一年使用:0次
2022-11-28更新
|
479次组卷
|
3卷引用:2019鲁科版高中化学选择性必修3第1章本章自我评价课后习题
2 . 0.1 某气态链烃充分燃烧可以生成7.2g水。请据此回答下列问题。
某气态链烃充分燃烧可以生成7.2g水。请据此回答下列问题。
(1)试通过计算确定该烃可能的分子式和结构简式______ 。
(2)请对(1)中所确定结构的烃进行系统命名______ 。
(3)若经测定该烃存在支链,预测该烃能否被酸性 溶液氧化、能否与溴水发生反应而使溴水褪色。
溶液氧化、能否与溴水发生反应而使溴水褪色。
(4)写出该烃燃烧的化学方程式______ 。
 某气态链烃充分燃烧可以生成7.2g水。请据此回答下列问题。
某气态链烃充分燃烧可以生成7.2g水。请据此回答下列问题。(1)试通过计算确定该烃可能的分子式和结构简式
(2)请对(1)中所确定结构的烃进行系统命名
(3)若经测定该烃存在支链,预测该烃能否被酸性
 溶液氧化、能否与溴水发生反应而使溴水褪色。
溶液氧化、能否与溴水发生反应而使溴水褪色。(4)写出该烃燃烧的化学方程式
您最近一年使用:0次
解题方法
3 . 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)K和 属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属
属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属 低,试解释原因。
低,试解释原因。_____
(2) 晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为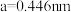 ,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有
,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有_____ 个?试说明分析思路。_____
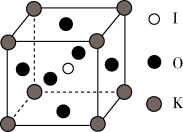
(3)计算K与O间的最短距离_____ 。
(1)K和
 属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属
属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属 低,试解释原因。
低,试解释原因。(2)
 晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为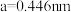 ,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有
,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有
(3)计算K与O间的最短距离
您最近一年使用:0次
解题方法
4 . 金刚砂( )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。

(1)X是______ ?
(2)写出基态 原子的电子排布式
原子的电子排布式______ ; 中
中 的化合价是
的化合价是______ ?
(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角______
(4) 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是______ 晶体?请分析原因______
(5)在 中最小的环上有
中最小的环上有______ 个原子,已知 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是______ 。
 )是重要的工业制品,可由二氧化硅与碳的反应制得:
)是重要的工业制品,可由二氧化硅与碳的反应制得: 。
。 的晶体结构与金刚石的相似,如本章如图所示,其中C原子和
的晶体结构与金刚石的相似,如本章如图所示,其中C原子和 原子的位置是交替的。
原子的位置是交替的。
(1)X是
(2)写出基态
 原子的电子排布式
原子的电子排布式 中
中 的化合价是
的化合价是(3)X可与氧气反应生成Y,判断Y分子的中心原子杂化轨道类型和键角
(4)
 晶体与晶体硅相比,熔点较高的是
晶体与晶体硅相比,熔点较高的是(5)在
 中最小的环上有
中最小的环上有 键的键能为a
键的键能为a ,理论上分解1
,理论上分解1
 形成气态原子所需要的能量是
形成气态原子所需要的能量是
您最近一年使用:0次
5 . 金属和非金属分界线附近的元素(如 、
、 、
、 ),可用于制造半导体材料,是科学研究的热点。试回答下列问题:
),可用于制造半导体材料,是科学研究的热点。试回答下列问题:
(1)锗( )是一种重要的半导体材料,写出基态
)是一种重要的半导体材料,写出基态 原子的价层电子排布式,说明价电子在其最高能级上的分布遵循的原则。
原子的价层电子排布式,说明价电子在其最高能级上的分布遵循的原则。________
(2) 是一种非晶态半导体,也称玻璃半导体。区分晶体与非晶体的最可靠的科学方法是
是一种非晶态半导体,也称玻璃半导体。区分晶体与非晶体的最可靠的科学方法是________ ?
(3) 等是人工合成的新型半导体材料,其晶体结构与金刚石相似,如图所示。每个
等是人工合成的新型半导体材料,其晶体结构与金刚石相似,如图所示。每个 原子周围有
原子周围有________ 个距离最近的 原子?每个晶胞中有
原子?每个晶胞中有________ 个 原子?
原子?

 、
、 、
、 ),可用于制造半导体材料,是科学研究的热点。试回答下列问题:
),可用于制造半导体材料,是科学研究的热点。试回答下列问题:(1)锗(
 )是一种重要的半导体材料,写出基态
)是一种重要的半导体材料,写出基态 原子的价层电子排布式,说明价电子在其最高能级上的分布遵循的原则。
原子的价层电子排布式,说明价电子在其最高能级上的分布遵循的原则。(2)
 是一种非晶态半导体,也称玻璃半导体。区分晶体与非晶体的最可靠的科学方法是
是一种非晶态半导体,也称玻璃半导体。区分晶体与非晶体的最可靠的科学方法是(3)
 等是人工合成的新型半导体材料,其晶体结构与金刚石相似,如图所示。每个
等是人工合成的新型半导体材料,其晶体结构与金刚石相似,如图所示。每个 原子周围有
原子周围有 原子?每个晶胞中有
原子?每个晶胞中有 原子?
原子?
您最近一年使用:0次
6 . 四种常见元素的性质或结构信息见表,试根据信息回答有关问题。
(1)A是哪种元素____ ?说明它在元素周期表中的位置____ ,写出其基态原子的电子排布式____ 。
(2)B位于元素周期表中的哪一区元素____ ?指出它的基态原子的核外电子占据的最高能级和该能级所能容纳的最多电子数____ 、____ 。
(3)写出C元素基态原子的轨道表示式____ ,说明其原子核外有多少对成对电子____ 。
(4)指出D元素基态原子核外填充有电子的能量最高的电子层和该电子层上具有的原子轨道数____ 、____ 。
| 元素 | A | B | C | D |
| 性质或结构信息 | 基态原子有5个原子轨道填充有电子,有3个未成对电子 | 基态原子有16个不同运动状态的电子 | 基态原子的价电子排布为3d104sx,在化合物中只有一种常见化合价 | 基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)B位于元素周期表中的哪一区元素
(3)写出C元素基态原子的轨道表示式
(4)指出D元素基态原子核外填充有电子的能量最高的电子层和该电子层上具有的原子轨道数
您最近一年使用:0次
7 . 元素周期表前四周期的元素A、B、C、D、E,原子序数依次增大。A的核外电子总数与其电子层数相同;B的价电子层中有3个未成对电子;C的最外层电子数为其内层电子数的3倍;D与C同主族;E的最外层只有1个电子,但次外层有18个电子。回答下列问题。
(1)B、C、D中第一电离能最大的是____ (填元素符号),E的价层电子排布式为_____ 。
(2)A和其他元素形成的二元共价化合物中,分子呈三角锥结构的化合物,其中心原子的杂化方式为_______ ;分子中既含有极性共价键,又含有非极性共价键的化合物是_______ (填化学式,写两种)。
(3)这些元素形成的含氧酸中,酸根离子呈三角锥结构的酸是_______ (填化学式)。
(4)这五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如图所示)。该化合物中阴离子为______ ,阳离子中存在的化学键类型有_______ ;该化合物加热时首先失去的组分是_______ ,判断理由是_______ 。

(5) 极易溶于水的原因与氢键有关,
极易溶于水的原因与氢键有关, 的一水合物的合理结构式为
的一水合物的合理结构式为_______ ,理由是_______ 。
(1)B、C、D中第一电离能最大的是
(2)A和其他元素形成的二元共价化合物中,分子呈三角锥结构的化合物,其中心原子的杂化方式为
(3)这些元素形成的含氧酸中,酸根离子呈三角锥结构的酸是
(4)这五种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈狭长的八面体结构(如图所示)。该化合物中阴离子为

(5)
 极易溶于水的原因与氢键有关,
极易溶于水的原因与氢键有关, 的一水合物的合理结构式为
的一水合物的合理结构式为
您最近一年使用:0次
8 . X、Y、Z、T四种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,T在元素周期表的各元素中电负性最大。请回答下列问题。
(1)X元素符号为_______ ,Y属于_______ 区元素,Z元素基态原子的电子排布式为_______ 。
(2) 与
与 分子的立体结构分别是
分子的立体结构分别是_______ 和_______ ,相同条件下两者在水中的溶解度较大的是_______ (写分子式),理由是_______ 。
(3) 中X原子采取的杂化方式是
中X原子采取的杂化方式是_______ , 分子的空间结构是
分子的空间结构是_______ 。
(4)X、Y、Z的最简单气态氢化物的沸点由高到低的排列顺序是_____ ,原因是_______ 。
(5)T的氢化物溶液中存在的氢键_______ 种。
(1)X元素符号为
(2)
 与
与 分子的立体结构分别是
分子的立体结构分别是(3)
 中X原子采取的杂化方式是
中X原子采取的杂化方式是 分子的空间结构是
分子的空间结构是(4)X、Y、Z的最简单气态氢化物的沸点由高到低的排列顺序是
(5)T的氢化物溶液中存在的氢键
您最近一年使用:0次
解题方法
9 . X、Y、Z、R、Q是元素周期表中前四周期的元素,它们的原子序数依次增大且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下:X原子的基态只有一种形状的电子云,并容易形成共价键;Y的基态原子有3个不同的能级,各能级中电子数相等;Z与Y同周期,其第一电离能高于同周期与之相邻的元素;R元素的电负性在同周期元素中最大;Q元素的基态原子在前四周期中未成对电子数最多。据此,请回答下列问题。
(1)写出X的元素符号______ ,基态Q原子的电子排布式______ 。
(2)R元素的基态原子核外电子共占据______ 个原子轨道?
(3)与Q同周期的元素的基态原子中最外层电子数与Q原子相同的元素有______ ?
(4)将X、Y、Z三种元素按电负性由大到小的顺序排列______ (用元素符号表示)。
(5)已知X、Y、Z组成的一种物质的结构式为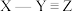 ,尝试推断该物质中Y元素的化合价
,尝试推断该物质中Y元素的化合价______ 。
(1)写出X的元素符号
(2)R元素的基态原子核外电子共占据
(3)与Q同周期的元素的基态原子中最外层电子数与Q原子相同的元素有
(4)将X、Y、Z三种元素按电负性由大到小的顺序排列
(5)已知X、Y、Z组成的一种物质的结构式为
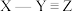 ,尝试推断该物质中Y元素的化合价
,尝试推断该物质中Y元素的化合价
您最近一年使用:0次
解题方法
10 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如表实验。
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)实验目的是____ 。
(2)请解释实验②中加入4.0mL蒸馏水的原因:____ 。
(3)据实验资料记载,Mn2+对该反应有催化作用。某小组同学计划设计实验验证Mn2+对该反应有催化作用,请填写表中空白。
若所加固体对反应确有催化作用,应观察到的现象是____ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色时所需时间/min | |||
| 0.6mol•L-1H2C2O4溶液 | H2O | 0.2mol•L-1KMnO4溶液 | 3.0mol•L-1稀硫酸 | ||
| ① | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| ② | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
(2)请解释实验②中加入4.0mL蒸馏水的原因:
(3)据实验资料记载,Mn2+对该反应有催化作用。某小组同学计划设计实验验证Mn2+对该反应有催化作用,请填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 向试管中加入少量固体 | 室温下溶液颜色褪至色时所需时间/min | |||
| 0.6mol•L-1H2C2O4溶液 | H2O | 0.2mol•L-1KMnO4溶液 | 3.0mol•L-1稀硫酸 | |||
| ③ | 3.0 | t | ||||
您最近一年使用:0次

 )
)

