名校
1 . 化学实验中的颜色变化,可将化学抽象之美具体为形象之美。下列叙述正确的是
A.将 通入水中所得溶液为黄绿色,说明 通入水中所得溶液为黄绿色,说明 与水不发生反应 与水不发生反应 |
B.向淀粉 溶液中通入 溶液中通入 ,溶液变成蓝色,说明 ,溶液变成蓝色,说明 的氧化性强于 的氧化性强于 |
C.向待测液中滴加 溶液,产生白色沉淀,说明待测液中含有 溶液,产生白色沉淀,说明待测液中含有 |
| D.用洁净的铂丝蘸取某溶液进行焰色试验,火焰呈黄色,说明该溶液一定为钠盐溶液 |
您最近一年使用:0次
名校
2 . 高温下,钠可以把 中的钛置换出来,反应的化学方程式为
中的钛置换出来,反应的化学方程式为 。下列说法错误的是
。下列说法错误的是
 中的钛置换出来,反应的化学方程式为
中的钛置换出来,反应的化学方程式为 。下列说法错误的是
。下列说法错误的是A.该反应中 表现了还原性 表现了还原性 |
B.该反应中还原性: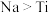 |
C.该反应中有 参与反应时,转移 参与反应时,转移 电子 电子 |
D.依该反应类推,将 投入 投入 稀溶液中,有红色物质生成 稀溶液中,有红色物质生成 |
您最近一年使用:0次
解题方法
3 . 钛( 是一种化学性质稳定的过渡元素,在航空航天、海洋工程和生物医疗等领域具有极为重要的实用价值。工业上以钛铁矿(
是一种化学性质稳定的过渡元素,在航空航天、海洋工程和生物医疗等领域具有极为重要的实用价值。工业上以钛铁矿( ,含
,含 、
、 、
、 等杂质)为主要原料制取
等杂质)为主要原料制取 的流程如下:
的流程如下: 的形式存在于溶液中;
的形式存在于溶液中;
② 煅烧生产
煅烧生产 。
。
回答下列问题:
(1)滤渣1的主要成分为_______________ (填化学式);绿矾中铁的化合价是__________________ 。
(2)“操作X”工序需控制温度不能过高,从产品角度分析原因为_______________________ 。
(3)“水解”析出 ,该反应的离子方程式是
,该反应的离子方程式是______________________________ 。
(4)“洗涤”工序,检验 已洗涤干净的方法为
已洗涤干净的方法为_______________________ 。
(5)写出“高温氯化”工序中反应的化学方程式:____________________________________ 。
(6)镍钛记忆合金可用于飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,若合金的密度为 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是______________  (用含
(用含 和
和 的计算式表示,不必化简)。
的计算式表示,不必化简)。
 是一种化学性质稳定的过渡元素,在航空航天、海洋工程和生物医疗等领域具有极为重要的实用价值。工业上以钛铁矿(
是一种化学性质稳定的过渡元素,在航空航天、海洋工程和生物医疗等领域具有极为重要的实用价值。工业上以钛铁矿( ,含
,含 、
、 、
、 等杂质)为主要原料制取
等杂质)为主要原料制取 的流程如下:
的流程如下:
 的形式存在于溶液中;
的形式存在于溶液中;②
 煅烧生产
煅烧生产 。
。回答下列问题:
(1)滤渣1的主要成分为
(2)“操作X”工序需控制温度不能过高,从产品角度分析原因为
(3)“水解”析出
 ,该反应的离子方程式是
,该反应的离子方程式是(4)“洗涤”工序,检验
 已洗涤干净的方法为
已洗涤干净的方法为(5)写出“高温氯化”工序中反应的化学方程式:
(6)镍钛记忆合金可用于飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,若合金的密度为
 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是 (用含
(用含 和
和 的计算式表示,不必化简)。
的计算式表示,不必化简)。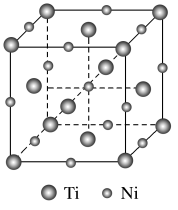
您最近一年使用:0次
名校
4 . 二硫化钼( ,硫元素的化合价为
,硫元素的化合价为 价)难溶于水,具有良好的光、电性能。将
价)难溶于水,具有良好的光、电性能。将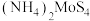
 在空气中加热可得
在空气中加热可得 ,加热时所得剩余固体质量与原始固体质量的比值与温度的关系如图所示(已知:
,加热时所得剩余固体质量与原始固体质量的比值与温度的关系如图所示(已知: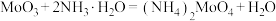 )。下列说法正确的是
)。下列说法正确的是
 ,硫元素的化合价为
,硫元素的化合价为 价)难溶于水,具有良好的光、电性能。将
价)难溶于水,具有良好的光、电性能。将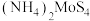
 在空气中加热可得
在空气中加热可得 ,加热时所得剩余固体质量与原始固体质量的比值与温度的关系如图所示(已知:
,加热时所得剩余固体质量与原始固体质量的比值与温度的关系如图所示(已知: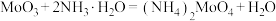 )。下列说法正确的是
)。下列说法正确的是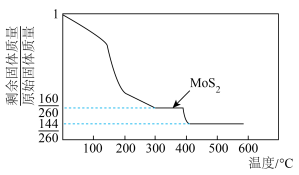
A. 中钼元素( 中钼元素( )的化合价为 )的化合价为 价 价 |
B. 是金属氧化物,也是碱性氧化物 是金属氧化物,也是碱性氧化物 |
C. 可得到 可得到 的一种氧化物,该氧化物的化学式为 的一种氧化物,该氧化物的化学式为 |
D.煅烧 生成 生成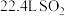 ,反应转移电子的物质的量为 ,反应转移电子的物质的量为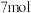 |
您最近一年使用:0次
2024-02-22更新
|
67次组卷
|
2卷引用:安徽省池州市2023-2024学年高三上学期1月期末化学试题
名校
解题方法
5 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
名校
解题方法
6 . 为充分利用资源,变废为宝,可从废旧CPU[含Au(金)、Ag、Cu和Pt(铂)]中回收Au,其化工流程如图:
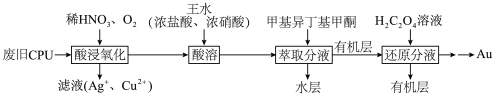
回答下列问题
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是___________ (写出一种即可)。
(2)“酸浸氧化”中,通入氧气的目的是___________ 。
(3)“酸溶”时,Pt、Au分别转化为H2PtCl6和HAuCl4,同时有NO生成。Pt溶解的化学方程式是___________ 。
(4)“萃取分液”后的“水层”中可回收的金属是___________ 。
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是___________ 。
(6)理论上消耗1mol草酸(H2C2O4)可得到Au的质量为___________ g(结果保留一位小数)。
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH3 [Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为
[Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为 ___________ 。已知:①[Ag(NH3)2]+ Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。

回答下列问题
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是
(2)“酸浸氧化”中,通入氧气的目的是
(3)“酸溶”时,Pt、Au分别转化为H2PtCl6和HAuCl4,同时有NO生成。Pt溶解的化学方程式是
(4)“萃取分液”后的“水层”中可回收的金属是
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是
(6)理论上消耗1mol草酸(H2C2O4)可得到Au的质量为
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH3
 [Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为
[Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为  Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
您最近一年使用:0次
7 . 漂白液、漂粉精既可用作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂,下列说法正确的是
A.漂粉精的主要成分仅为 |
| B.漂白液在浓盐酸中能大量存在 |
C.漂粉精暴露在空气中易变质的原因为 |
| D.漂白液可用于漂白棉、麻、纸张的原因为漂白液具有还原性 |
您最近一年使用:0次
名校
解题方法
8 . NaClO、 、
、 为常见高效的消毒剂和漂白剂。
为常见高效的消毒剂和漂白剂。
(1) 是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为
是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为 (未配平)。该反应中
(未配平)。该反应中 与
与 的化学计量数之比为
的化学计量数之比为___________ (不考虑 的分解)。
的分解)。
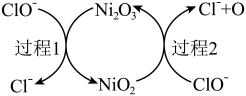
(2)①“84”消毒液的有效成分为NaClO。工业上常用碱性NaClO废液吸收 ,部分催化过程如图所示。“过程1”中
,部分催化过程如图所示。“过程1”中 是
是___________ (填“氧化剂”或“还原剂”),当 和
和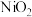 以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为___________ 。
②NaClO可在碱性条件下将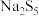 氧化为
氧化为 ,而自身被还原为NaCl,则
,而自身被还原为NaCl,则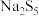 与NaClO的个数比为
与NaClO的个数比为___________ 。
(3)以氯酸钠、硫酸和二氧化硫为原料制备 ,进而再利用
,进而再利用 与
与 溶液反应制备亚氯酸钠(
溶液反应制备亚氯酸钠( ),具体流程如下:
),具体流程如下:
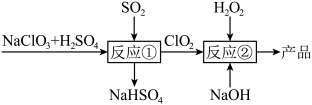
反应①的离子方程式为___________ ;理论上,该流程中参与反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
 、
、 为常见高效的消毒剂和漂白剂。
为常见高效的消毒剂和漂白剂。(1)
 是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为
是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为 (未配平)。该反应中
(未配平)。该反应中 与
与 的化学计量数之比为
的化学计量数之比为 的分解)。
的分解)。(2)①“84”消毒液的有效成分为NaClO。工业上常用碱性NaClO废液吸收
 ,部分催化过程如图所示。“过程1”中
,部分催化过程如图所示。“过程1”中 是
是 和
和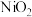 以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
②NaClO可在碱性条件下将
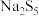 氧化为
氧化为 ,而自身被还原为NaCl,则
,而自身被还原为NaCl,则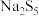 与NaClO的个数比为
与NaClO的个数比为(3)以氯酸钠、硫酸和二氧化硫为原料制备
 ,进而再利用
,进而再利用 与
与 溶液反应制备亚氯酸钠(
溶液反应制备亚氯酸钠( ),具体流程如下:
),具体流程如下:
反应①的离子方程式为
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 高铁酸钠( )和高铁酸钾(
)和高铁酸钾( )是水处理过程中的一种新型的绿色多功能净水剂。
)是水处理过程中的一种新型的绿色多功能净水剂。
(1)高铁酸钾在0~5℃的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成 和
和 。某兴趣小组在实验室模拟湿法制备
。某兴趣小组在实验室模拟湿法制备 ,装置如图所示。
,装置如图所示。
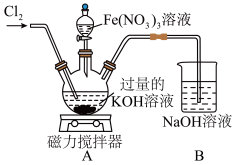
反应温度须控制在0~5℃,采用的控温方法为___________ ,反应中KOH必须过量的原因是___________ 。
(2)高铁酸钠( )可以通过下述反应制取:
)可以通过下述反应制取: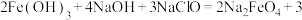
 。
。 中Fe元素的化合价为
中Fe元素的化合价为___________ ,该反应中被还原的物质是___________ (填化学式)。
(3)工业上是先制得高铁酸钠,然后在低温条件下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。干法制备高铁酸钠的主要反应为 ,该反应中
,该反应中 是
是___________ (填“氧化剂”“还原剂”或“氧化剂和还原剂”)。
(4) 的净水原理如图所示。
的净水原理如图所示。
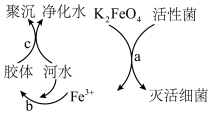
过程a中 体现
体现___________ (填“氧化性”或“还原性”),反应过程中转移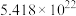 个电子,需
个电子,需___________ mol  。
。
 )和高铁酸钾(
)和高铁酸钾( )是水处理过程中的一种新型的绿色多功能净水剂。
)是水处理过程中的一种新型的绿色多功能净水剂。(1)高铁酸钾在0~5℃的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成
 和
和 。某兴趣小组在实验室模拟湿法制备
。某兴趣小组在实验室模拟湿法制备 ,装置如图所示。
,装置如图所示。
反应温度须控制在0~5℃,采用的控温方法为
(2)高铁酸钠(
 )可以通过下述反应制取:
)可以通过下述反应制取: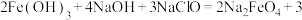
 。
。 中Fe元素的化合价为
中Fe元素的化合价为(3)工业上是先制得高铁酸钠,然后在低温条件下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。干法制备高铁酸钠的主要反应为
 ,该反应中
,该反应中 是
是(4)
 的净水原理如图所示。
的净水原理如图所示。
过程a中
 体现
体现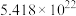 个电子,需
个电子,需 。
。
您最近一年使用:0次
名校
10 . 四氧化三铁( )在工业上应用广泛。
)在工业上应用广泛。 的一种制备方法如图所示,下列说法错误的是
的一种制备方法如图所示,下列说法错误的是
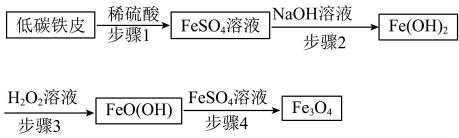
 )在工业上应用广泛。
)在工业上应用广泛。 的一种制备方法如图所示,下列说法错误的是
的一种制备方法如图所示,下列说法错误的是
A.用KSCN溶液检验步骤1得到的 溶液中是否存在 溶液中是否存在 |
| B.步骤2中配制NaOH溶液的蒸馏水需要煮沸 |
C. 中+2价和+3价铁元素的质量之比为2∶1 中+2价和+3价铁元素的质量之比为2∶1 |
D.步骤3涉及反应的化学方程式为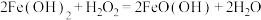 |
您最近一年使用:0次



