真题
1 . 劳动人民的发明创造是中华优秀传统文化的组成部分。下列化学原理描述错误的是
| 发明 | 关键操作 | 化学原理 | |
| A | 制墨 | 松木在窑内焖烧 | 发生不完全燃烧 |
| B | 陶瓷 | 黏土高温烧结 | 形成新的化学键 |
| C | 造纸 | 草木灰水浸泡树皮 | 促进纤维素溶解 |
| D | 火药 | 硫黄、硝石和木炭混合,点燃 | 发生氧化还原反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 焦亚硫酸钠(Na2S2O5)是一种重要的化工原料。工业上,以黄铁矿(主要成分FeS2)生产硫酸的尾气为原料制备焦亚硫酸钠的一种流程如下图所示:
(1)FeS2中铁元素的化合价为_______ 。
(2)“煅烧”时,主要反应的化学方程式为_______ 。
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是_______ 。
(4)因为Na2S2O5具有_______ 性,长期放置Na2S2O5样品会不可避免地存在Na2SO4,检验其中含有SO 的试剂是
的试剂是_______ 。
(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式_______
_______I2+ _______S2O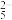 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+
在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为_______ g/L。

(1)FeS2中铁元素的化合价为
(2)“煅烧”时,主要反应的化学方程式为
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是
(4)因为Na2S2O5具有
 的试剂是
的试剂是(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式
_______I2+ _______S2O
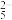 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为
您最近一年使用:0次
解题方法
3 . 电子工业常用覆铜板为基础材料制作印刷电路板。现取一定质量的覆铜板,用油性笔画上设计好的图案,浸入盛有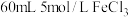 ,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻
,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻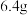 。请计算:
。请计算:
(1) 的物质的量是
的物质的量是_______ mol。
(2)反应过程中,转移电子总数为_______  。
。
(3)为使使用后的“腐蚀液”中金属阳离子完全沉淀,至少需要加入物质的量浓度为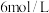 的
的 溶液
溶液_______ mL。
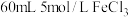 ,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻
,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻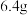 。请计算:
。请计算:(1)
 的物质的量是
的物质的量是(2)反应过程中,转移电子总数为
 。
。(3)为使使用后的“腐蚀液”中金属阳离子完全沉淀,至少需要加入物质的量浓度为
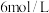 的
的 溶液
溶液
您最近一年使用:0次
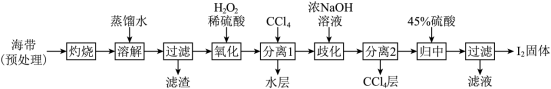
4 . 碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海水提碘是从海藻中提取元素碘的技术。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)_______ ,设计实验检验氧化后所得溶液是否含I2时,可取样于试管,滴加_______ (填试剂名称)。
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为_______ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为_______ 。
Ⅱ.获取重要的还原剂-HI
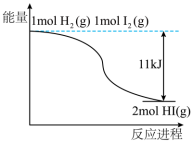
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为 ,其工作原理如图所示:
,其工作原理如图所示:_______ ;
②放电时,转移0.6×6.02×1023个电子,负极质量减少_______ g。
Ⅰ.海带提碘(海带中碘元素以I-形式存在)
(2)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为Ⅱ.获取重要的还原剂-HI
(3)H2和I2反应生成HI过程能量变化如图所示,1molH2(g)、1molHI(g)分子中化学键断裂时分别要吸收能量436kJ、299kJ,则1molI2(g)分子中化学键断裂时需吸收的能量为
(4)优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2-乙烯吡啶(简写P2VP)和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为
 ,其工作原理如图所示:
,其工作原理如图所示: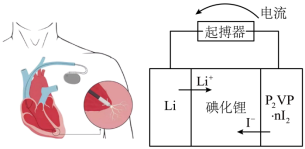
②放电时,转移0.6×6.02×1023个电子,负极质量减少
您最近一年使用:0次
名校
5 . 查阅资料可知:Bi位于周期表的第VA族, 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:
①向稀硫酸酸化的 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。
②继续滴加适量草酸 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。
下列说法正确的是
 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:①向稀硫酸酸化的
 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。②继续滴加适量草酸
 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。下列说法正确的是
| A.Bi的基态原子中只含一个未成对电子 |
B.由操作①现象可知酸性条件下氧化性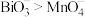 |
C.操作②中每生成标准状况下 ,反应转移1mol电子 ,反应转移1mol电子 |
D.向稀硫酸酸化的 中加入草酸,溶液会变为紫红色 中加入草酸,溶液会变为紫红色 |
您最近一年使用:0次
7日内更新
|
16次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
6 . 某实验小组研究Zn单质与三价铁盐的反应。
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
【实验过程】
【分析解释】
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为___________ 。
(2)实验II中,产生的大量气体为___________ (填化学式)。
(3)实验III中,溶液变成深棕色,NO 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:___________ 。
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为___________ (填实验编号)。
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为___________
【查阅资料】
1.25℃,pH<7溶液显酸性,pH越小,溶液中H+浓度越大,酸性越强。
2.1 mol·L-1的FeCl3溶液, pH>1时开始产生Fe(OH)3沉淀。
3.Fe2++NO
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。【实验过程】
| 实验 | 编号 | 试剂 | 现象 |
| I | 0.1 mol·L-1 FeCl3溶液(pH≈1.30 ) | 黄色溶液很快变浅,有无色气泡产生,无铁产生 |
| II | 1 mol·L-1 FeCl3溶液 (pH≈0.70 ) | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 | |
| III | 1 mol·L-1 Fe(NO3)3溶液(pH≈0.70 ) | 约半小时后,溶液变为深棕色且浑浊,无铁产生 | |
| IV | 0.5 mol·L-1 Fe2(SO4)3溶液(pH≈0.70 ) | 约半小时后,溶液呈浅绿色且浑浊,产生少量铁 |
(1)实验I中,经检验反应后的溶液中存在Fe2+,产生Fe2+的离子方程式为
(2)实验II中,产生的大量气体为
(3)实验III中,溶液变成深棕色,NO
 发生了如下反应,补全该反应的离子方程式:
发生了如下反应,补全该反应的离子方程式:3Zn + NO
NO +8H+=3Zn2++
+8H+=3Zn2++ ___________+4H2O
___________+4H2O
(4)由实验I~IV可知:过量的Zn与Fe3+反应能否得到Fe单质与多种因素有关,能证明“阴离子种类”是影响因素的实验为
(5)一定条件下Fe3+与过量Zn粉反应能够生成Fe单质,其原因与Zn、Fe2+、Fe还原性密切相关,三种微粒还原性由强到弱的顺序为
您最近一年使用:0次
真题
解题方法
7 . 精炼铜产生的铜阳极泥富含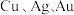 等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。
(2)“浸出液1”中含有的金属离子主要是_______ 。
(3)“浸取2”步骤中,单质金转化为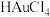 的化学方程式为
的化学方程式为_______ 。
(4)“浸取3”步骤中,“浸渣2”中的_______ (填化学式)转化为 。
。
(5)“电沉积”步骤中阴极的电极反应式为_______ 。“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为_______ (填化学式)。
(6)“还原”步骤中,被氧化的 与产物
与产物 的物质的量之比为
的物质的量之比为_______ 。
(7) 可被
可被 氧化为
氧化为 。从物质结构的角度分析
。从物质结构的角度分析 的结构为(a)而不是(b)的原因:
的结构为(a)而不是(b)的原因:_______ 。
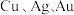 等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
等多种元素。研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。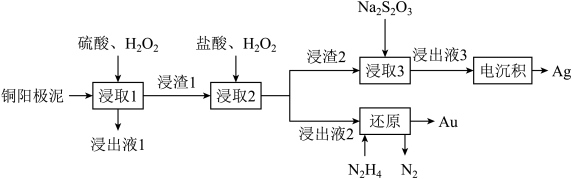
(1)
 位于元素周期表第
位于元素周期表第(2)“浸出液1”中含有的金属离子主要是
(3)“浸取2”步骤中,单质金转化为
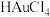 的化学方程式为
的化学方程式为(4)“浸取3”步骤中,“浸渣2”中的
 。
。(5)“电沉积”步骤中阴极的电极反应式为
(6)“还原”步骤中,被氧化的
 与产物
与产物 的物质的量之比为
的物质的量之比为(7)
 可被
可被 氧化为
氧化为 。从物质结构的角度分析
。从物质结构的角度分析 的结构为(a)而不是(b)的原因:
的结构为(a)而不是(b)的原因: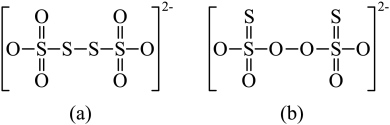
您最近一年使用:0次
真题
8 . 家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
A.用过氧碳酸钠漂白衣物: 具有较强氧化性 具有较强氧化性 |
| B.酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发 |
| C.用柠檬酸去除水垢:柠檬酸酸性强于碳酸 |
| D.用碱液清洗厨房油污:油脂可碱性水解 |
您最近一年使用:0次
7日内更新
|
1884次组卷
|
4卷引用:2024年吉林省高考化学试题
真题
9 .  分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
 分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是A.无色→蓝色:生成 | B.蓝色→无色: 转化为化合态 转化为化合态 |
C. 起漂白作用 起漂白作用 | D.淀粉作指示剂 |
您最近一年使用:0次
7日内更新
|
1839次组卷
|
4卷引用:2024年吉林省高考化学试题
名校
10 . 工业上用 处理氨氮水的原理如图所示。
处理氨氮水的原理如图所示。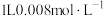 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(
混合,测得溶液中氨去除率、总氮( 和
和 的总和)残余率与
的总和)残余率与 投入量(用x表示)的关系如图所示。下列说法错误的是
投入量(用x表示)的关系如图所示。下列说法错误的是
 处理氨氮水的原理如图所示。
处理氨氮水的原理如图所示。
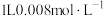 的氨水分别和不同量的
的氨水分别和不同量的 混合,测得溶液中氨去除率、总氮(
混合,测得溶液中氨去除率、总氮( 和
和 的总和)残余率与
的总和)残余率与 投入量(用x表示)的关系如图所示。下列说法错误的是
投入量(用x表示)的关系如图所示。下列说法错误的是
A.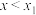 时, 时, 主要被氧化为 主要被氧化为 |
B.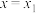 时,生成的 时,生成的 的物质的量为 的物质的量为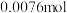 |
C.生成硝氮的离子方程式: |
D. 时,分批加入 时,分批加入 可以降低总氮残余率 可以降低总氮残余率 |
您最近一年使用:0次




