名校
1 . LiAlH4是重要的储氢材料,可与水发生反应: LiAlH4+2H2O = LiAlO2+4H2↑,下列说法中不正确 的是
| A.该反应属于氧化还原反应 | B.还原产物与氧化产物的质量比为1:1 |
| C.H2O既不是氧化剂也不是还原剂 | D.H元素既被氧化,又被还原 |
您最近一年使用:0次
2023-11-26更新
|
56次组卷
|
2卷引用:贵州省毕节市民族中学2023-2024学年上学期高一12月化学试卷
2 . 化学反应纷繁复杂,但我们可以从离子,电子等微观视角对其进行研究以揭示其中规律。回答下列问题:
I.某溶液可能含有 、
、 、
、 、
、 、
、 、
、 中的一种或几种,现对其进行如下实验:
中的一种或几种,现对其进行如下实验:
①取少量溶液于试管中,观察为无色透明溶液;
②在①溶液中,滴加足量氯化钡溶液,产生白色沉淀。过滤后,取适量白色沉淀置于试管中,加入过量稀盐酸,沉淀部分溶解,且有气泡产生;
③在②的滤液中加入稀硝酸酸化的硝酸银溶液,有白色沉淀生成。
(1)该溶液中一定含有的离子有________ (填离子符号,下同),一定不含的离子有_________ ,可能含有的离子有___________ 。
(2)③中产生白色沉淀的离子方程式为___________ 。
II.高锰酸钾、氯酸钾等强氧化剂可与浓盐酸反应产生氧气:已知反应
(3)该反应中还原产物是___________ 。
(4)该反应中盐酸体现的性质是___________ (填字母)。
A.氧化性 B.还原性 C.酸性
(5)该反应中氧化剂与还原剂的物质的量之比为___________ 。
(6)如果该反应转移 ,则生成标准状况下的气体体积为
,则生成标准状况下的气体体积为___________ L。
I.某溶液可能含有
 、
、 、
、 、
、 、
、 、
、 中的一种或几种,现对其进行如下实验:
中的一种或几种,现对其进行如下实验:①取少量溶液于试管中,观察为无色透明溶液;
②在①溶液中,滴加足量氯化钡溶液,产生白色沉淀。过滤后,取适量白色沉淀置于试管中,加入过量稀盐酸,沉淀部分溶解,且有气泡产生;
③在②的滤液中加入稀硝酸酸化的硝酸银溶液,有白色沉淀生成。
(1)该溶液中一定含有的离子有
(2)③中产生白色沉淀的离子方程式为
II.高锰酸钾、氯酸钾等强氧化剂可与浓盐酸反应产生氧气:已知反应

(3)该反应中还原产物是
(4)该反应中盐酸体现的性质是
A.氧化性 B.还原性 C.酸性
(5)该反应中氧化剂与还原剂的物质的量之比为
(6)如果该反应转移
 ,则生成标准状况下的气体体积为
,则生成标准状况下的气体体积为
您最近一年使用:0次
3 . 关于反应 ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是A. 具有还原性 具有还原性 |
B. 既不是氧化剂也不是还原剂 既不是氧化剂也不是还原剂 |
C.该条件下, 的氧化性比 的氧化性比 氧化性强 氧化性强 |
D.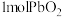 参与反应,转移电子的物质的量为6mol 参与反应,转移电子的物质的量为6mol |
您最近一年使用:0次
名校
4 . 1962年,化学家NeilBartlett用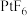 与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙(
与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙( ),实验证明
),实验证明 是一种含有
是一种含有 的离子化合物,常温下很稳定,遇水强烈水解生成
的离子化合物,常温下很稳定,遇水强烈水解生成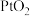 、HF、Xe、
、HF、Xe、 。下列叙述正确的是
。下列叙述正确的是
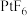 与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙(
与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙( ),实验证明
),实验证明 是一种含有
是一种含有 的离子化合物,常温下很稳定,遇水强烈水解生成
的离子化合物,常温下很稳定,遇水强烈水解生成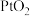 、HF、Xe、
、HF、Xe、 。下列叙述正确的是
。下列叙述正确的是A.在合成 的反应中Xe作氧化剂 的反应中Xe作氧化剂 | B. 水解过程中被还原的元素为Pt和Xe 水解过程中被还原的元素为Pt和Xe |
| C.通常情况下,Xe具有较强的还原性 | D.1 mol  完全水解,转移4 mol电子 完全水解,转移4 mol电子 |
您最近一年使用:0次
2023-10-17更新
|
256次组卷
|
6卷引用:贵州省部分中学2023-2024学年高三上学期第四次月考化学试题
解题方法
5 . 某无色透明溶液中可能大量存在Ag+、Ca2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是_______ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______ 。
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有_______ ,有关的离子方程式为_______ 。
(4)原溶液可能大量共存的阴离子是_______(填字母)。
(5)为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应:2NO+2CO N2+2CO2。
N2+2CO2。
①用双线桥标出电子转移的方向和数目_______ 。
②若消耗30 g的NO得到还原产物的质量为_______ g。
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有
(4)原溶液可能大量共存的阴离子是_______(填字母)。
| A.OH- | B. | C. | D.Cl- |
 N2+2CO2。
N2+2CO2。①用双线桥标出电子转移的方向和数目
②若消耗30 g的NO得到还原产物的质量为
您最近一年使用:0次
6 . 甲酸(HCOOH)可在纳米级Pd表面分解为活性H2和CO2,经下列历程实现NO 的催化还原。已知Fe(Ⅱ)、Fe(Ⅲ)表示Fe3O4中二价铁和三价铁。下列说法
的催化还原。已知Fe(Ⅱ)、Fe(Ⅲ)表示Fe3O4中二价铁和三价铁。下列说法不正确 的是
 的催化还原。已知Fe(Ⅱ)、Fe(Ⅲ)表示Fe3O4中二价铁和三价铁。下列说法
的催化还原。已知Fe(Ⅱ)、Fe(Ⅲ)表示Fe3O4中二价铁和三价铁。下列说法
| A.生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 |
B.在整个历程中,每1molH2可还原2molNO |
| C.HCOOH分解时,只有极性共价键发生了断裂 |
D.反应历程中生成的H+可调节体系pH,有增强NO 氧化性的作用 氧化性的作用 |
您最近一年使用:0次
2023-10-12更新
|
457次组卷
|
4卷引用:贵州省黔东南州从江县2023-2024学年高三上学期期中检测化学试题
贵州省黔东南州从江县2023-2024学年高三上学期期中检测化学试题浙江省义乌五校2023-2024学年高三上学期10月联考化学试题(已下线)专题05 化学反应与能量(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省丽水湖州衢州三地市2024届高三下学期4月教学质量检测化学试题
名校
解题方法
7 . 铁是人类较早使用的金属之一,回答下列问题。
(1)下列所含铁元素只有还原性的物质是___________ (填字母)。
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是___________ (填字母)。
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔(转化为Cu2+)来制造印刷电路板。写出FeCl3溶液与铜发生反应的化学方程式___________ ,若向FeCl3和CuCl2的混合溶液中加入一定量铁粉,最终有固体剩余,则下列有关说法中正确的是___________ (填字母)。
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式___________ ;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ mol。
(5)某“铁基脱氧剂”的主要成分是还原Fe粉,使用一段时间后会部分变质为Fe2O3。将一包使用过一段时间后的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面有大量细小无色气泡产生。溶液中的反应有: 、
、 、
、___________ (写离子方程式)。
(1)下列所含铁元素只有还原性的物质是
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔(转化为Cu2+)来制造印刷电路板。写出FeCl3溶液与铜发生反应的化学方程式
A.固体中一定有铜 B.固体中一定有铁
C.溶液中一定有Fe2+ D.溶液中一定有Cu2+
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式(5)某“铁基脱氧剂”的主要成分是还原Fe粉,使用一段时间后会部分变质为Fe2O3。将一包使用过一段时间后的脱氧剂用稀盐酸浸泡,浸泡过程中粉末表面有大量细小无色气泡产生。溶液中的反应有:
 、
、 、
、
您最近一年使用:0次
2023-10-11更新
|
513次组卷
|
4卷引用:贵州省安顺市 镇宁布依族苗族自治县第一高级中学(镇宁实验学校)2023-2024学年高一上学期12月月考化学试题
解题方法
8 . 下图是氯元素的“价-类”二维图,据此下列分析正确的是


| A.生活中可将“84”消毒液与洁厕灵混用使消毒效果增强 |
B.可用pH试纸分别测定等浓度的 和 和 溶液的pH,比较酸性强弱 溶液的pH,比较酸性强弱 |
C. 溶于水的离子方程式为: 溶于水的离子方程式为: |
D.工业上常用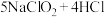 (稀) (稀)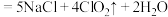 制备 制备 ,该反应氧化产物与还原产物之比为 ,该反应氧化产物与还原产物之比为 |
您最近一年使用:0次
解题方法
9 . 生物地球氮化学循环模式图的一部分如图,请根据所学知识回答问题。
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。

(1)属于氮的固定的是_______ (填标号)。
(2)利用如图装置可以制备、检验和收集NO。
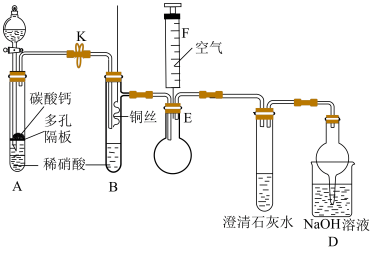
①实验前先打开开关K通入 一段时间,其目的是
一段时间,其目的是_______ 。采用抽拉铜丝与稀硝酸反应的优点为_______ 。
②检验生成的气体为NO的操作是_______ 。
③装置D的作用是_______ 。
(3)NO与 反应生成
反应生成 的离子方程式为
的离子方程式为_______ ,该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)写出铵根经硝化作用直接转化为硝酸根的离子方程式:_______ ,铵根浓度或pH过大,都会使硝化作用减弱的可能原因为_______ 。
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。

(1)属于氮的固定的是
(2)利用如图装置可以制备、检验和收集NO。

①实验前先打开开关K通入
 一段时间,其目的是
一段时间,其目的是②检验生成的气体为NO的操作是
③装置D的作用是
(3)NO与
 反应生成
反应生成 的离子方程式为
的离子方程式为(4)写出铵根经硝化作用直接转化为硝酸根的离子方程式:
您最近一年使用:0次
2023-09-24更新
|
190次组卷
|
4卷引用:贵州省普通高中部分学校2023-2024学年高二上学期第一次联考化学试题
10 . 将9.0g由铜和铁组成的混合物投入100mL稀硝酸中并加热,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法错误的是
| A.第一次与100mL稀硝酸反应后剩余的4.8g金属全部是铜 |
| B.原混合物中铜和铁的质量分别为4.8g和4.2g |
| C.若向“反应后的溶液”中再加入足量稀硝酸,还可得到标准状况下1.12LNO |
| D.加入稀硝酸的浓度为2mol/L |
您最近一年使用:0次



