1 . 酸性KMnO4溶液、H2O2溶液在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除。FeNO33溶液也是重要的氧化试剂,下面是对这三种氧化试剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式:_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(2)取300mL0.2molL-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_______
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474克KMnO4样品溶解酸化后,用0.100molL1的标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在_________________ (填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗标准Na2S2O3溶液12.00mL,则该样品中KMnO4的物质的量是_______ (有关离子方程式为8 +5
+5 +14H=8Mn2++10
+14H=8Mn2++10 +7H2O)
+7H2O)
(4)在溶FeNO33液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_______ ,又变为棕黄色的离子方程式是_______ 。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式:
(2)取300mL0.2molL-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474克KMnO4样品溶解酸化后,用0.100molL1的标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在
 +5
+5 +14H=8Mn2++10
+14H=8Mn2++10 +7H2O)
+7H2O)(4)在溶FeNO33液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是
您最近一年使用:0次
2 . 水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O +O2+xOH-=Fe3O4+S4O
+O2+xOH-=Fe3O4+S4O +2H2O,下列说法不正确的是
+2H2O,下列说法不正确的是
 +O2+xOH-=Fe3O4+S4O
+O2+xOH-=Fe3O4+S4O +2H2O,下列说法不正确的是
+2H2O,下列说法不正确的是| A.每生成0.5 mol Fe3O4,反应转移的电子总物质的量为2 mol |
B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.x=4 |
D.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为 mol mol |
您最近一年使用:0次
2021-01-08更新
|
296次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题
3 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。某化学小组针对氯气及其化合物展开以下实验。
Ⅰ.氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:
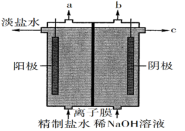
(1)氯气的逸出口是___________ (填“a”或“b”),为了获得比较纯净的NaOH溶液,电解过程中最好选用___________ 离子交换膜(填“阴”或“阳”),电解过程总反应的离子方程式为___________
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________
Ⅱ.“84”消毒液是生活中常见的高效杀毒剂,其主要成分为NaClO。某校学生为了测定蓝月亮牌“84”消毒液中NaClO的浓度,进行了如下实验:
①取10.00mL“84”消毒液于烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中定容后备用。
②取20.00mL稀释后的溶液于锥形瓶中,滴加稀H2SO4和过量的KI溶液,NaClO将KI氧化成I2。
③用淀粉做指示剂,生成的I2用0.0800 mol/L Na2S2O3标准溶液滴定至终点,发生的反应为:I2 + 2S2O =2I-+S4O
=2I-+S4O 。
。
④重复滴定3次。
所得数据如下:
回答下列问题:
(3)步骤①定容时还需要的玻璃仪器是___________ ,Na2S2O3标准溶液应该装在___________ 滴定管中
(4)步骤②发生反应的离子方程式为___________
(5)步骤③滴定终点的现象为___________
(6)若滴定前标准液滴定管尖嘴管处有气泡,滴定结束后气泡消失,则会使测定结果___________ (填“偏高”或“偏低”或“不变”)。经过计算测出蓝月亮牌“84”消毒液中NaClO的物质的量浓度为___________ mol/L(精确到小数点后1位)
Ⅰ.氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:

(1)氯气的逸出口是
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
Ⅱ.“84”消毒液是生活中常见的高效杀毒剂,其主要成分为NaClO。某校学生为了测定蓝月亮牌“84”消毒液中NaClO的浓度,进行了如下实验:
①取10.00mL“84”消毒液于烧杯中,加水稀释并恢复至室温后,转移到1000mL容量瓶中定容后备用。
②取20.00mL稀释后的溶液于锥形瓶中,滴加稀H2SO4和过量的KI溶液,NaClO将KI氧化成I2。
③用淀粉做指示剂,生成的I2用0.0800 mol/L Na2S2O3标准溶液滴定至终点,发生的反应为:I2 + 2S2O
 =2I-+S4O
=2I-+S4O 。
。④重复滴定3次。
所得数据如下:
| 待测液体积(mL) | 标准液滴定前读数(mL) | 标准液滴定后读数(mL) | 消耗标准液体积(mL) | |
| 1 | 20.00 | 0.02 | 20.02 | |
| 2 | 20.00 | 0.24 | 20.26 | |
| 3 | 20.00 | 0.12 | 20.10 | |
| 4 | 20.00 | 0.20 | 21.20 |
(3)步骤①定容时还需要的玻璃仪器是
(4)步骤②发生反应的离子方程式为
(5)步骤③滴定终点的现象为
(6)若滴定前标准液滴定管尖嘴管处有气泡,滴定结束后气泡消失,则会使测定结果
您最近一年使用:0次
名校
解题方法
4 . 全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下:
___________NaIO3+___________NaHSO3→3NaHSO4+___________Na2SO4+___________I2+___________H2O(未配平)
完成下列填空:
(1)配平上述化学方程式________ ,标出电子转移的方向和数目_________ 。
(2)该反应实质是两步反应:①IO +3HSO
+3HSO →3SO
→3SO +I-+3H+,则第二步反应的离子方程式为②
+I-+3H+,则第二步反应的离子方程式为②___________ ;若要使碘酸钠的利用率最高,碘酸钠在第一步和第二步反应中的用量之比是___________ 。
(3)过滤反应析出的碘沉淀得到粗碘,再用升华法即可得到99%左右的碘产品。碘原子最外层电子排布式是___________ ,碘升华克服的微粒间作用力为___________ 。
(4)能说明氯、碘两种元素非金属性相对强弱的依据是___________ 。(选填编号)
a.原子的最外层都有7个电子
b.ICl中碘元素为+1价
c.酸性:HClO3>HIO3
d.氯化钠、碘化钠与浓硫酸共热,分别生成氯化氢、单质碘
(5)检验亚硫酸钠固体是否氧化变质的方法是___________ 。
___________NaIO3+___________NaHSO3→3NaHSO4+___________Na2SO4+___________I2+___________H2O(未配平)
完成下列填空:
(1)配平上述化学方程式
(2)该反应实质是两步反应:①IO
 +3HSO
+3HSO →3SO
→3SO +I-+3H+,则第二步反应的离子方程式为②
+I-+3H+,则第二步反应的离子方程式为②(3)过滤反应析出的碘沉淀得到粗碘,再用升华法即可得到99%左右的碘产品。碘原子最外层电子排布式是
(4)能说明氯、碘两种元素非金属性相对强弱的依据是
a.原子的最外层都有7个电子
b.ICl中碘元素为+1价
c.酸性:HClO3>HIO3
d.氯化钠、碘化钠与浓硫酸共热,分别生成氯化氢、单质碘
(5)检验亚硫酸钠固体是否氧化变质的方法是
您最近一年使用:0次
2020-12-29更新
|
490次组卷
|
3卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
5 . 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
 +KMnO4→
+KMnO4→ + MnO2
+ MnO2
 +HCl→
+HCl→ +KCl
+KCl
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______ (填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反应装置中应选用______ 冷凝管(填“直形”或“球形”)。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________ ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理__________ 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______ 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______ 。
(6)若要得到纯度更高的苯甲酸,可通过在水中__________ 的方法提纯。
 +KMnO4→
+KMnO4→ + MnO2
+ MnO2 +HCl→
+HCl→ +KCl
+KCl| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·mL−1) | 溶解性 |
| 甲苯 | 92 | −95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反应装置中应选用
(3)加入适量饱和亚硫酸氢钠溶液的目的是
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
(6)若要得到纯度更高的苯甲酸,可通过在水中
您最近一年使用:0次
名校
解题方法
6 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如图:
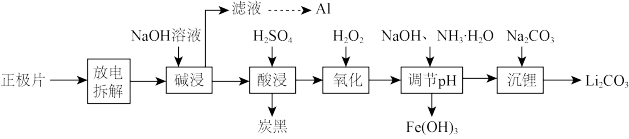
已知:碳酸锂在水中的溶解度:0℃时1.54g,90℃时0.85g,100℃时0.71g。
(1)上述流程中要得到Li2CO3的操作是____________________ 。
(2) “氧化”发生反应的离子方程式为________________ ;若用HNO3代替H2O2,不足之处是______ 。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________ mol·L-1。
②“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如表:
则最佳的沉淀pH=_______ 。
(4) “沉锂”时所得的沉淀应用_______ 洗涤(填“热水”或“冷水”)。
(5)甲醇燃料电池在工作时,正极发生反应的物质是______ ,该电池在酸性条件放电时正极的电极反应式为___________________ 。

已知:碳酸锂在水中的溶解度:0℃时1.54g,90℃时0.85g,100℃时0.71g。
(1)上述流程中要得到Li2CO3的操作是
(2) “氧化”发生反应的离子方程式为
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为
②“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如表:
| pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
| ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
| ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=
(4) “沉锂”时所得的沉淀应用
(5)甲醇燃料电池在工作时,正极发生反应的物质是
您最近一年使用:0次
名校
解题方法
7 . (1)硫代硫酸钠在稀硫酸溶液中不能稳定存在,用离子方程式解释原因:_________ ;实验过程中,为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率大小________ 。
(2)重铬酸钾(K2Cr2O7)是一种中学化学常用的强氧化剂,用离子方程式表示在橙黄色的重铬酸钾(K2Cr2O7)水溶液中Cr2O 与CrO
与CrO 的平衡关系:
的平衡关系:________ ;向重铬酸钾中加入少量NaOH固体,现象为:_________ 。
(3) 常温下,氯化铁溶液遇到硫氰化钾会变为红色,写出这一过程的化学方程式:_______________ ,向一支大试管中加入5mL 0.1mol·L-1KI溶液和1滴0.1mol·L-1FeCl3溶液,用力振荡,为证明I-与Fe3+的反应为可逆反应,下列实验设计正确的是 ( )
A 取少量反应后的溶液于试管,加淀粉溶液,观察现象
B 取少量反应后溶液于试管,滴加3滴0.1mol·L-1KSCN溶液,观察现象
C 取少量反应后溶液于试管,滴加AgNO3溶液,观察现象
D 取少量反应后溶液于试管,滴K3[Fe(CN)6]溶液,检验是否有Fe2+生成
(2)重铬酸钾(K2Cr2O7)是一种中学化学常用的强氧化剂,用离子方程式表示在橙黄色的重铬酸钾(K2Cr2O7)水溶液中Cr2O
 与CrO
与CrO 的平衡关系:
的平衡关系:(3) 常温下,氯化铁溶液遇到硫氰化钾会变为红色,写出这一过程的化学方程式:
A 取少量反应后的溶液于试管,加淀粉溶液,观察现象
B 取少量反应后溶液于试管,滴加3滴0.1mol·L-1KSCN溶液,观察现象
C 取少量反应后溶液于试管,滴加AgNO3溶液,观察现象
D 取少量反应后溶液于试管,滴K3[Fe(CN)6]溶液,检验是否有Fe2+生成
您最近一年使用:0次
名校
解题方法
8 . (1)在25℃ 时,某Na2SO4溶液中c(SO42-) = 5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) :c(OH-) = ___________ 。
(2)t℃ 时,水的离子积为1×10-12,将pH=11的NaOH溶液V1 L与pH=1的稀硫酸V2 L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1 :V2 =________ 。
(3)水电离生成H3O+ 和OH- 叫做水的自偶电离。同水一样,液氨也有自偶电离,其自偶电离的电离方程式为:________________________________ 。
(4)写出草酸溶液使酸性高锰酸钾溶液褪色的离子方程式______________________________ 。
(2)t℃ 时,水的离子积为1×10-12,将pH=11的NaOH溶液V1 L与pH=1的稀硫酸V2 L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1 :V2 =
(3)水电离生成H3O+ 和OH- 叫做水的自偶电离。同水一样,液氨也有自偶电离,其自偶电离的电离方程式为:
(4)写出草酸溶液使酸性高锰酸钾溶液褪色的离子方程式
您最近一年使用:0次
2020-10-11更新
|
379次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2020-2021学年高二10月月考化学试题
名校
9 . 把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离子方程式的说法正确的是( )


| A.配平后的化学计量数依次为3、1、2、6、3 |
| B.若有1 mol S被氧化,则生成2 mol S2- |
| C.氧化剂与还原剂的物质的量之比为1∶2 |
| D.2 mol S参加反应有3 mol电子发生转移 |
您最近一年使用:0次
2020-10-10更新
|
156次组卷
|
18卷引用:黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题
黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题福建省安溪一中、养正中学、惠安一中、泉州实验中学2019-2020学年高二下学期期末联考化学试题(已下线)2011届云南省昆明市高三复习5月适应性检测(理综)化学部分(已下线)2011届江西省临川二中高三下学期第一次模拟考试(理综)化学部分(已下线)2012届四川省成都外国语学校高三第二次月考理科综合化学试卷(已下线)2012届浙江省重点中学协作体高三3月调研理综部分(已下线)2013学年湖北省广水市育才高中高三第一次月考化学试卷山东省枣庄市第二中学2020届高三上学期第一次阶段性检测化学试题(已下线)考点03 氧化还原反应——《备战2020年高考精选考点专项突破题集》夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用(提升练)2020届高三化学化学二轮复习——高考常考题:情境下氧化还原反应方程式书写【精编选择26题】(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训云南文山州马关县第一中学2019-2020学年高一上学期期末考试化学试题山东省德州市齐河县实验中学2021届高三第一次月考化学试题甘肃省张掖市第二中学2021届高三上学期9月月考化学试题(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)第14讲 硫、二氧化硫【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)宁夏银川市唐徕中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
10 . Ⅰ.ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是______ 。
Ⅱ.已知一定条件下可以发生下列反应:H2O2+2Fe2++2H+=2Fe3++2H2O、H2O2+2Fe3+=2Fe2++2H++O2↑
(1)与上述反应类比,I2也能与H2O2发生类似反应。请在空格处填入合适的化学方程式:H2O2+I2=2HIO;____ ;总反应的化学方程式为_______ 。
(2)在H2SO4和KI的混合溶液中加入过量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉溶液变蓝。有同学认为该反应的离子方程式为H2O2+2I-=I2+O2↑+2H+,该离子方程式是否正确____ (填“正确”或“不正确”),理由是______ 。
(3)在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为____ 。
Ⅱ.已知一定条件下可以发生下列反应:H2O2+2Fe2++2H+=2Fe3++2H2O、H2O2+2Fe3+=2Fe2++2H++O2↑
(1)与上述反应类比,I2也能与H2O2发生类似反应。请在空格处填入合适的化学方程式:H2O2+I2=2HIO;
(2)在H2SO4和KI的混合溶液中加入过量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉溶液变蓝。有同学认为该反应的离子方程式为H2O2+2I-=I2+O2↑+2H+,该离子方程式是否正确
(3)在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为
您最近一年使用:0次



