名校
解题方法
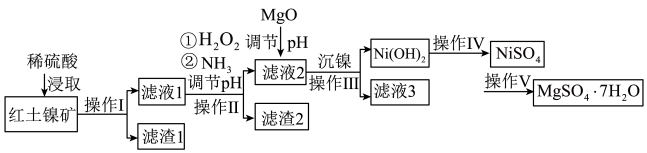
1 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;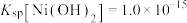 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;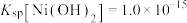 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1018次组卷
|
7卷引用:湖南省株洲市炎陵县2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: (橙色)
(橙色) (黄色)
(黄色) 。回答下列问题:
。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是_______ ,写出该反应的化学方程式:_______ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。
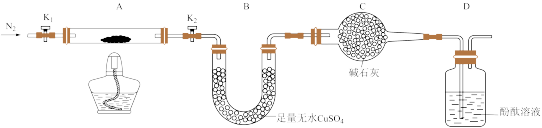
①实验过程中通入N2的主要目的是_______ 。
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为_______ 。
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_______ (填“偏大”“偏小”或“无影响”);滴定时边滴边摇动锥形㼛,眼睛应观察_______ 。
②滳定结果如下表所示:
该样品中氮的质量分数为_______ (结果保留两位小数)。
 (橙色)
(橙色) (黄色)
(黄色) 。回答下列问题:
。回答下列问题:(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使
 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
②滳定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.06 |
| 2 | 25.00 | 1.98 | 21.97 |
| 3 | 25.00 | 0.20 | 21.20 |
| 4 | 25.00 | 0.45 | 20.45 |
您最近一年使用:0次
2022-11-02更新
|
233次组卷
|
2卷引用:湖南省株洲市攸县第二中学2022-2023学年高二上学期期中考试化学试题
名校
3 . 碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90%SrCO3,少量MgCO3、CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
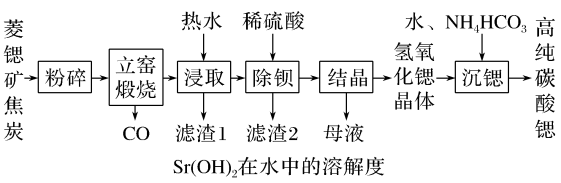
(1)元素Sr在元素周期表的位置_______ 。
(2)菱锶矿、焦炭混合粉碎的目的是_______ 。
(3)“立窑煅烧”中SrCO3与焦炭反应生成两种氧化物,则该反应的化学方程式为_______ 。
(4)“浸取”中用热水浸取而不用冷水的原因是_______ 。
(5)“沉锶”中反应的化学方程式为_______ 。
(6)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。某种锶铁氧体(xSrO·yFe2O3)中Sr与Fe的质量比为0.13,则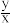 为
为_______ (取整数)。

| 温度/℃ | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度/(g/100g) | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)菱锶矿、焦炭混合粉碎的目的是
(3)“立窑煅烧”中SrCO3与焦炭反应生成两种氧化物,则该反应的化学方程式为
(4)“浸取”中用热水浸取而不用冷水的原因是
(5)“沉锶”中反应的化学方程式为
(6)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。某种锶铁氧体(xSrO·yFe2O3)中Sr与Fe的质量比为0.13,则
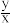 为
为
您最近一年使用:0次
2022-10-20更新
|
183次组卷
|
2卷引用:湖南省株洲市攸县第二中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 下列离子方程式书写错误的是
A.向碘化亚铁溶液中滴加少量稀硝酸: |
B.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:Fe2++ +Ba2++2OH-=BaSO4↓+Fe(OH)2↓ +Ba2++2OH-=BaSO4↓+Fe(OH)2↓ |
C.乙酰水杨酸 与NaOH溶液共热: 与NaOH溶液共热: +3OH- +3OH-  +CH3COO-+2H2O +CH3COO-+2H2O |
D.AgCl溶于过量浓氨水中: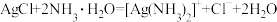 |
您最近一年使用:0次
名校
5 . 硫脲[CS(NH2)2]是一种白色而有光泽的晶体,熔点为176~178℃,溶于冷水,可用作药物的原料等。实验室可用如图所示的装置(夹持、加热装置已略)制备少量的硫脲。回答下列问题:

(1)装置A用于制取H2S气体,下列气体的制备也可在启普发生器中进行的是____ (填标号)。
a.锌粒与稀硫酸制备H2 b.铜片与浓硫酸制备SO2
c.石灰石与盐酸制备CO2 d.高锰酸钾粉末与浓盐酸制备Cl2
(2)装置B中盛放的适宜试剂是____ 。
(3)装置C用于产品的制备,反应过程中以合适的流速通入H2S气体,反应温度控制在50℃,直至有少量晶体析出。
①装置C中仪器W的名称是____ 。
②NH2CN、Na2S在水中反应生成硫脲的化学方程式是____ ,通H2S的目的是____ 。
(4)测定产品纯度的实验步骤如下:
步骤I:称取ag产品溶解并转移到500mL容量瓶中定容后得溶液A;
步骤II:吸取20.00mL溶液A于碘量瓶中,准确加入V1mLc1mol·L-1I2溶液和20.00mLNaOH溶液于暗处放置[发生反应:2NaOH+I2=NaIO+NaI+H2O,4NaIO+CS(NH2)2+H2O=CO(NH2)2+4NaI+H2SO4]
步骤III:加100mL水及10.00mL盐酸摇匀(此时溶液接近中性,加盐酸的目的是使过量的NaIO和NaI反应生成I2),用c2mol·L-1Na2S2O3溶液滴定,接近终点时,加入3.00mL淀粉,继续滴定(发生反应:I2+2Na2S2O3=Na2S4O6+2NaI)至终点,消耗Na2S2O3溶液V2mL。
若产品中的杂质不参加反应,则产品中CS(NH2)2的质量分数为_____ (列出含c1、V1、c2、V2、a的计算式);若用Na2S2O3溶液滴定前不加稀盐酸中和,则滴定时消耗Na2S2O3溶液的体积将____ (填“偏大”“偏小”或“不变”)。

(1)装置A用于制取H2S气体,下列气体的制备也可在启普发生器中进行的是
a.锌粒与稀硫酸制备H2 b.铜片与浓硫酸制备SO2
c.石灰石与盐酸制备CO2 d.高锰酸钾粉末与浓盐酸制备Cl2
(2)装置B中盛放的适宜试剂是
(3)装置C用于产品的制备,反应过程中以合适的流速通入H2S气体,反应温度控制在50℃,直至有少量晶体析出。
①装置C中仪器W的名称是
②NH2CN、Na2S在水中反应生成硫脲的化学方程式是
(4)测定产品纯度的实验步骤如下:
步骤I:称取ag产品溶解并转移到500mL容量瓶中定容后得溶液A;
步骤II:吸取20.00mL溶液A于碘量瓶中,准确加入V1mLc1mol·L-1I2溶液和20.00mLNaOH溶液于暗处放置[发生反应:2NaOH+I2=NaIO+NaI+H2O,4NaIO+CS(NH2)2+H2O=CO(NH2)2+4NaI+H2SO4]
步骤III:加100mL水及10.00mL盐酸摇匀(此时溶液接近中性,加盐酸的目的是使过量的NaIO和NaI反应生成I2),用c2mol·L-1Na2S2O3溶液滴定,接近终点时,加入3.00mL淀粉,继续滴定(发生反应:I2+2Na2S2O3=Na2S4O6+2NaI)至终点,消耗Na2S2O3溶液V2mL。
若产品中的杂质不参加反应,则产品中CS(NH2)2的质量分数为
您最近一年使用:0次
2022-06-18更新
|
136次组卷
|
3卷引用:湖南省株洲市第八中学2021-2022学年高二下学期期末考试化学试题
名校
6 . 氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍的实验步骤如下:
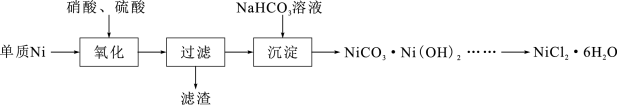
已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)在三颈烧瓶中(装置见如图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。
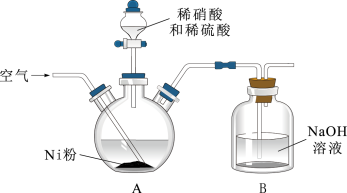
①向A装置中通入空气的作用除搅拌外还有___________ 。
②若镍粉过量,判断反应完成的现象是___________ 。
(2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
①沉淀反应的离子方程式为___________ 。
②检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是___________ 。
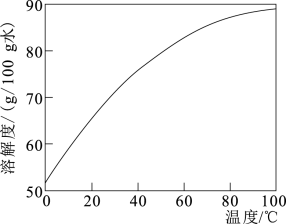
(3)所得NiCO3·Ni(OH)2固体中混有少量Fe(OH)3。请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,搅拌,___________ 。 [NiCl2溶解度曲线如图所示。实验中须 选用的仪器和试剂:pH计、盐酸、NiCO3]

已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)在三颈烧瓶中(装置见如图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。

①向A装置中通入空气的作用除搅拌外还有
②若镍粉过量,判断反应完成的现象是
(2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
①沉淀反应的离子方程式为
②检验NiCO3·Ni(OH)2沉淀已经洗涤完全的方法是
(3)所得NiCO3·Ni(OH)2固体中混有少量Fe(OH)3。请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,搅拌,

您最近一年使用:0次
2022-05-31更新
|
772次组卷
|
4卷引用:湖南省株洲市第二中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
7 . 工业上用含三价钒( )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:

【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,将 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
(2)酸浸:
① 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是_______ 。
②酸度对钒和铝的溶解量的影响如图所示:
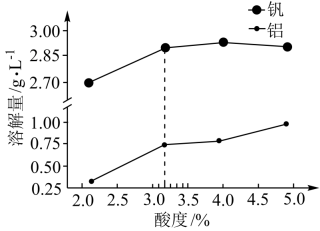
酸浸时溶液的酸度控制在大约3.2%,根据图推测,酸浸时不选择更高酸度的原因是_______ 。
(3)转沉:将浸出液中的钒转化为 固体,其流程如下:
固体,其流程如下:

①浸出液中加入石灰乳的作用是_______ 。
②已知 的溶解度小于
的溶解度小于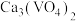 。向
。向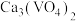 沉淀中加入
沉淀中加入 溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:
溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:_______ 。
③向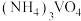 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是_______ 。
(4)测定产品中 的纯度:称取ag产品,先用硫酸溶解,得到
的纯度:称取ag产品,先用硫酸溶解,得到 溶液。再加入
溶液。再加入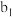 mL
mL 
 溶液(
溶液(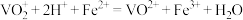 )。最后用
)。最后用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 mL。已知
mL。已知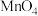 被还原为
被还原为 ,假设杂质不参与反应。则产品中
,假设杂质不参与反应。则产品中 的质量分数是
的质量分数是_______ 。( 的摩尔质量:
的摩尔质量: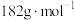 )
)
(5)全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时 发生氧化反应,电池原理(电解液中含
发生氧化反应,电池原理(电解液中含 )如图:
)如图:
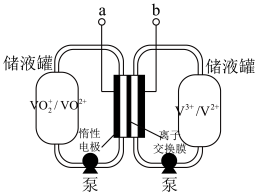
①a是_______ (填“正极”或“负极”)。
②该蓄电池反应方程式为_______ (标出“充电”“放电”方向)。
 )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 转化为
转化为 的化学方程式是
的化学方程式是(2)酸浸:
①
 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是②酸度对钒和铝的溶解量的影响如图所示:

酸浸时溶液的酸度控制在大约3.2%,根据图推测,酸浸时不选择更高酸度的原因是
(3)转沉:将浸出液中的钒转化为
 固体,其流程如下:
固体,其流程如下:
①浸出液中加入石灰乳的作用是
②已知
 的溶解度小于
的溶解度小于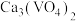 。向
。向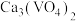 沉淀中加入
沉淀中加入 溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:
溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:③向
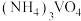 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是(4)测定产品中
 的纯度:称取ag产品,先用硫酸溶解,得到
的纯度:称取ag产品,先用硫酸溶解,得到 溶液。再加入
溶液。再加入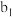 mL
mL 
 溶液(
溶液(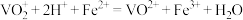 )。最后用
)。最后用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 mL。已知
mL。已知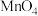 被还原为
被还原为 ,假设杂质不参与反应。则产品中
,假设杂质不参与反应。则产品中 的质量分数是
的质量分数是 的摩尔质量:
的摩尔质量: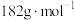 )
)(5)全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时
 发生氧化反应,电池原理(电解液中含
发生氧化反应,电池原理(电解液中含 )如图:
)如图:
①a是
②该蓄电池反应方程式为
您最近一年使用:0次
2022-05-30更新
|
384次组卷
|
3卷引用:湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
8 . 利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)回收铂的一种工艺流程如下。

已知:①“沉铂”时发生的反应为[ PtCl6]2- +2 = (NH4)2PtCl6↓。
= (NH4)2PtCl6↓。
②隔绝空气“煅烧”时有两种单质生成,其中一种是 N2。
下列说法正确的是

已知:①“沉铂”时发生的反应为[ PtCl6]2- +2
 = (NH4)2PtCl6↓。
= (NH4)2PtCl6↓。②隔绝空气“煅烧”时有两种单质生成,其中一种是 N2。
下列说法正确的是
| A.“酸浸”时应在较高温度下进行 |
| B.滤液②可返回“酸浸”工序循环利用 |
C.“溶解”时发生的离子反应为3Pt+ 16H++4 +18Cl-= 3[ PtCl6]2- +4NO↑+8H2O +18Cl-= 3[ PtCl6]2- +4NO↑+8H2O |
| D.隔绝空气“煅烧”时每生成117.0g Pt,理论上产生标准状况下13.44 L N2 |
您最近一年使用:0次
2022-05-26更新
|
874次组卷
|
3卷引用:湖南省株洲市第二中学2021-2022学年高二下学期期末考试化学试题
名校
9 . 以电镀厂含锌废液(主要成分为 ,还含有少量的
,还含有少量的 )为原料制备
)为原料制备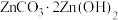 的工艺流程如下:
的工艺流程如下:

溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)“氧化”工序作用之一是除锰,发生反应的离子反应方程式是_______ 。
(2)工业生产中,“试剂a”通常可选用_______ (填字母代号)
A. 溶液 B.
溶液 B. C.稀硫酸 D.
C.稀硫酸 D.
滤渣X的成分是_______ ,调 的范围是
的范围是_______ 。
(3)“沉锌”主要反应的离子反应方程式是_______ ;过滤出的产品经过多次洗涤,如何证明产品已洗净_______ 。
(4)对产品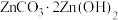 进行系列加工可得单质
进行系列加工可得单质 和
和 ,科研团队进一步研发了可逆
,科研团队进一步研发了可逆 电池,电池工作时复合膜(由a、b膜复合而成)层间的
电池,电池工作时复合膜(由a、b膜复合而成)层间的 解离成
解离成 和
和 。
。 电池工作原理如图所示:
电池工作原理如图所示:

闭合 时,电池复合膜中
时,电池复合膜中 向
向_______ (填“左”或“右”)迁移;闭合 时,
时, 电极发生的电极反应式为
电极发生的电极反应式为_______ 。
 ,还含有少量的
,还含有少量的 )为原料制备
)为原料制备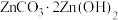 的工艺流程如下:
的工艺流程如下:
溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀 | 1.9 | 7.0 | 3.0 | 6.6 |
完全沉淀 | 3.2 | 9.0 | 4.7 | 9.1 |
回答下列问题:
(1)“氧化”工序作用之一是除锰,发生反应的离子反应方程式是
(2)工业生产中,“试剂a”通常可选用
A.
 溶液 B.
溶液 B. C.稀硫酸 D.
C.稀硫酸 D.
滤渣X的成分是
 的范围是
的范围是(3)“沉锌”主要反应的离子反应方程式是
(4)对产品
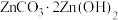 进行系列加工可得单质
进行系列加工可得单质 和
和 ,科研团队进一步研发了可逆
,科研团队进一步研发了可逆 电池,电池工作时复合膜(由a、b膜复合而成)层间的
电池,电池工作时复合膜(由a、b膜复合而成)层间的 解离成
解离成 和
和 。
。 电池工作原理如图所示:
电池工作原理如图所示:
闭合
 时,电池复合膜中
时,电池复合膜中 向
向 时,
时, 电极发生的电极反应式为
电极发生的电极反应式为
您最近一年使用:0次
2022-04-30更新
|
774次组卷
|
4卷引用:湖南省株洲市第八中学2022-2023学年高二上学期期中考试化学试题
湖南省株洲市第八中学2022-2023学年高二上学期期中考试化学试题河北省唐山市2022届高三普通高中学业水平选择性考试第二次模拟演练化学试题湖南省怀化市第三中学2022届高三下学期第三次模拟预测化学试题(已下线)微专题16 热点金属及其化合物制备流程(Li、Sr、Pb、Zn、Ti、Mo)-备战2023年高考化学一轮复习考点微专题
名校
解题方法
10 . 工业上利用无隔膜NaCl电解法脱除低温工业废气中 NO,可有效减少对空气的污染。
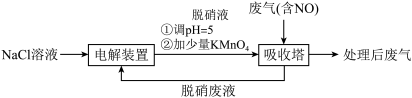
(1)电解NaCl溶液获得脱硝液(含NaClO)分两步进行,第二步反应的离子方程式是___________ 。
(2)脱硝液中含氯微粒的物质的量分数(δ)随pH的分布如图1所示;其他条件相同,NO转化率随脱硝液初始pH(用稀盐酸调节)的变化如图2所示:
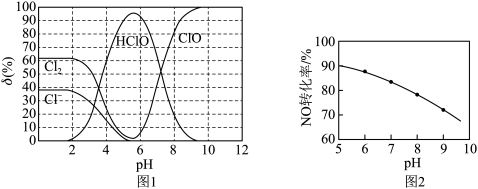
①吸收塔中NO转化为NO 的离子反应方程式是
的离子反应方程式是___________ 。
②脱硝液pH=5时,NO转化率最高,随pH升高,NO转化率会降低,原因是___________ 。
(3)吸收塔中采用气、液逆流(废气从吸收塔底进入,脱硝液从吸收塔顶喷淋)的方式吸收废气,目的是___________ 。
(4)KMnO4可以增加脱硝液的氧化性,显著提高脱硝效率,但脱硝废液电解时无法实现KMnO4的再生,需在脱硝液中及时补充。推测KMnO4无法再生的原因:
Ⅰ. MnO 在阴极直接得到电子被还原;
在阴极直接得到电子被还原;
Ⅱ.脱硝废液中NO 在阴极得电子转化为NO
在阴极得电子转化为NO ,NO
,NO 还原MnO
还原MnO 。
。
进行实验验证:
资料: MnO 为紫红色,MnO
为紫红色,MnO 为墨绿色,MnO
为墨绿色,MnO 与MnO
与MnO 混合溶液颜色会变暗。
混合溶液颜色会变暗。
①实验1中阴极颜色变暗,阴极电极反应式是___________ 。
②根据实验1和2可得到的结论是___________ 。

(1)电解NaCl溶液获得脱硝液(含NaClO)分两步进行,第二步反应的离子方程式是
(2)脱硝液中含氯微粒的物质的量分数(δ)随pH的分布如图1所示;其他条件相同,NO转化率随脱硝液初始pH(用稀盐酸调节)的变化如图2所示:

①吸收塔中NO转化为NO
 的离子反应方程式是
的离子反应方程式是②脱硝液pH=5时,NO转化率最高,随pH升高,NO转化率会降低,原因是
(3)吸收塔中采用气、液逆流(废气从吸收塔底进入,脱硝液从吸收塔顶喷淋)的方式吸收废气,目的是
(4)KMnO4可以增加脱硝液的氧化性,显著提高脱硝效率,但脱硝废液电解时无法实现KMnO4的再生,需在脱硝液中及时补充。推测KMnO4无法再生的原因:
Ⅰ. MnO
 在阴极直接得到电子被还原;
在阴极直接得到电子被还原;Ⅱ.脱硝废液中NO
 在阴极得电子转化为NO
在阴极得电子转化为NO ,NO
,NO 还原MnO
还原MnO 。
。进行实验验证:
| 装置 | 实验 | 复合电解液 | 实验现象 |
 | 1 | 0.66mmol/LKMnO4+ 0.8547mol/LNaCl混合电解液( pH=7) | 阳极溶液颜色基本不变; 阴极溶液颜色逐渐变暗; 25min电解液未呈现墨绿色, pH=12.1 |
| 2 | 0.66mmol/L KMnO4+0.8547mol/L NaCl 、NaNO3混合电解液( pH=7) | 阳极溶液颜色基本不变; 阴极溶液颜色逐渐变暗;25 min电解液呈现墨绿色, pH=12.4 |
 为紫红色,MnO
为紫红色,MnO 为墨绿色,MnO
为墨绿色,MnO 与MnO
与MnO 混合溶液颜色会变暗。
混合溶液颜色会变暗。①实验1中阴极颜色变暗,阴极电极反应式是
②根据实验1和2可得到的结论是
您最近一年使用:0次
2022-04-16更新
|
455次组卷
|
5卷引用:湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题





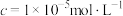 )时的pH
)时的pH

