1 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)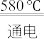 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.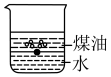 | B.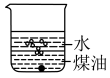 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
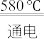 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近半年使用:0次
名校
解题方法
2 . 过氧化钠常作漂白剂、消毒剂。过氧化钠经常因为保存不当容易吸收空气中 而变质。某课外小组欲用以下装置探究过氧化钠与
而变质。某课外小组欲用以下装置探究过氧化钠与 反应后的产物。试回答下列问题:
反应后的产物。试回答下列问题:

(1)写出A中反应的化学方程式___________ 。
(2)B装置的作用是___________ 。
(3)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转变为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式,并用双线桥标出电子转移的方向和数目:___________
(4)该课外小组欲探究某过组化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(5)超氧化钾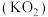 与过氧化钠一样能吸收
与过氧化钠一样能吸收 生成碳酸盐及
生成碳酸盐及 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
 而变质。某课外小组欲用以下装置探究过氧化钠与
而变质。某课外小组欲用以下装置探究过氧化钠与 反应后的产物。试回答下列问题:
反应后的产物。试回答下列问题:
(1)写出A中反应的化学方程式
(2)B装置的作用是
(3)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转变为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式,并用双线桥标出电子转移的方向和数目:
(4)该课外小组欲探究某过组化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(5)超氧化钾
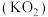 与过氧化钠一样能吸收
与过氧化钠一样能吸收 生成碳酸盐及
生成碳酸盐及 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近半年使用:0次
名校
3 . 按要求完成下列问题:
(1)Na久置空气中最终都是变为________ (填化学式);漂白粉有效成分的化学式________ 。
(2)纯净的H2在Cl2中安静地燃烧,发出________ 色火焰。胆矾的化学式为________ 。
(3)写出金属钠投入水中发生反应的离子方程式是________ 。
(4)在一定量的稀盐酸中,加入少量高铜酸钠(NaCuO2)固体,产生黄绿色气体。写出稀盐酸与高铜酸钠固体反应的化学方程式是________ 。
(1)Na久置空气中最终都是变为
(2)纯净的H2在Cl2中安静地燃烧,发出
(3)写出金属钠投入水中发生反应的离子方程式是
(4)在一定量的稀盐酸中,加入少量高铜酸钠(NaCuO2)固体,产生黄绿色气体。写出稀盐酸与高铜酸钠固体反应的化学方程式是
您最近半年使用:0次
名校
解题方法
4 . 下列表述的方程式或离子方程式正确的是
A.向NaHS溶液中滴加 溶液: 溶液: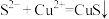 |
B.表示乙醇燃烧热的热化学方程式:  |
C.向酸性 溶液中滴加双氧水: 溶液中滴加双氧水: |
D.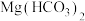 溶液与过量NaOH溶液混合: 溶液与过量NaOH溶液混合: |
您最近半年使用:0次
解题方法
5 . 利用绿矾(FeSO4·7H2O)对某工厂废水(含有强氧化性离子Cr2O )进行处理。
)进行处理。
(1)工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取FeSO4。已知该反应除生成硫酸亚铁外,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:_______________________ 。
(2)请配平下列离子方程式:______ 。
Fe2++ Cr2O +
+  = Fe3++ Cr3++ H2O
= Fe3++ Cr3++ H2O
 )进行处理。
)进行处理。(1)工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取FeSO4。已知该反应除生成硫酸亚铁外,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
(2)请配平下列离子方程式:
Fe2++ Cr2O
 +
+  = Fe3++ Cr3++ H2O
= Fe3++ Cr3++ H2O
您最近半年使用:0次
名校
解题方法
6 . 下列化学反应对应的离子方程式表示正确的是
| A.Fe(OH)2溶于稀硝酸Fe(OH)2+2H+=Fe2++2H2O |
B.NH4HCO3溶于过量的NaOH溶液中:HCO +OH-=CO +OH-=CO +H2O +H2O |
C.KAl(SO4)2中滴加Ba(OH)2使SO 恰好完全沉淀:2Al3++3SO 恰好完全沉淀:2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
您最近半年使用:0次
7 . 配平下列离子方程式。
① Fe3++ SO2+ H2O= Fe2++ SO + H+
+ H+_____ 。
② C2O + MnO
+ MnO + H+= CO2↑+ Mn2++ H2O
+ H+= CO2↑+ Mn2++ H2O_____ 。
① Fe3++ SO2+ H2O= Fe2++ SO
 + H+
+ H+② C2O
 + MnO
+ MnO + H+= CO2↑+ Mn2++ H2O
+ H+= CO2↑+ Mn2++ H2O
您最近半年使用:0次
名校
解题方法
8 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上使用黄铁矿(主要成分为 )制备硫酸的反应原理如下图:
)制备硫酸的反应原理如下图:___________ ;煅烧时发生反应的化学方程式为___________ 。
(2)“氧化”时,发生反应的化学方程式为___________ ;保持其他条件不变,只改变一个反应条件时,生成 的反应速率会如何变化?(填“增大”“减小”或“不变”)
的反应速率会如何变化?(填“增大”“减小”或“不变”)
(3)研究证明,高炉中 与
与 反应不能完全转化为
反应不能完全转化为 和
和 ,据此写出高炉炼铁时
,据此写出高炉炼铁时 与
与 反应的化学方程式:
反应的化学方程式:___________ ;若投入 的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中
的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中 的转化率为
的转化率为___________ 。
 )制备硫酸的反应原理如下图:
)制备硫酸的反应原理如下图: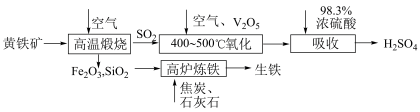
(2)“氧化”时,发生反应的化学方程式为
 的反应速率会如何变化?(填“增大”“减小”或“不变”)
的反应速率会如何变化?(填“增大”“减小”或“不变”)| 改变条件 | 升高温度 | 增大反应容器体积 | 反应达到平衡状态后,延长反应时间 |
生成 的速率 的速率 |
(3)研究证明,高炉中
 与
与 反应不能完全转化为
反应不能完全转化为 和
和 ,据此写出高炉炼铁时
,据此写出高炉炼铁时 与
与 反应的化学方程式:
反应的化学方程式: 的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中
的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中 的转化率为
的转化率为
您最近半年使用:0次
2023-08-20更新
|
354次组卷
|
3卷引用:河北省沧州市东光县等3地海兴县中学等2校2022-2023学年高一下学期3月月考化学试题
名校
解题方法
9 . 铬酸钠( )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(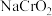 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为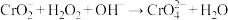 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是
 )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(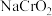 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为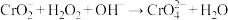 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是| A.反应物中Cr元素的化合价为+4 |
B. 是还原剂 是还原剂 |
| C.该反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.生成2mol水分子时,转移3mol电子 |
您最近半年使用:0次
2023-08-20更新
|
353次组卷
|
2卷引用:湖南省衡阳市名校协作体2022-2023学年高一下学期5月月考化学试题
10 . 铅元素位于周期表ⅣA族,其氧化物铅丹(Pb3O4)可作防锈涂料,围绕铅丹的制备与性质有如下流程。下列有关说法错误的是
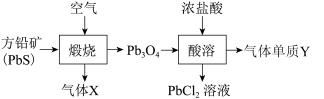

| A.Pb3O4可表示为2PbO·PbO2 |
| B.“煅烧”时PbS只作还原剂,Cl2的氧化性强于Pb3O4 |
| C.气体X既是氧化产物又是还原产物,气体Y为氧化产物 |
| D.“酸溶”时0.1 mol Pb3O4与足量的浓盐酸反应,生成0.1 mol Cl2 |
您最近半年使用:0次
2023-08-11更新
|
92次组卷
|
2卷引用:河北省霸州市第一中学2022-2023学年高二下学期期末考试化学试题



