名校
解题方法
1 . 铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液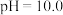 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示:
②萃取的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为___________ 。
(2)“滤渣”的主要成分是___________ (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是___________ 。
(3)请从化学平衡的角度解释“反萃取”过程中加入 的原理和目的
的原理和目的___________ 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液 的范围为
的范围为___________ ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为___________ 。
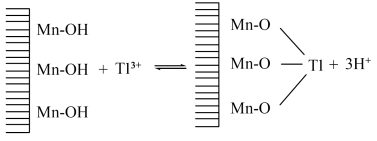
(5)废水中 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为___________ (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收 ,可将离子交换树脂浸入
,可将离子交换树脂浸入___________ 溶液。
a. b.
b. c.
c.
 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: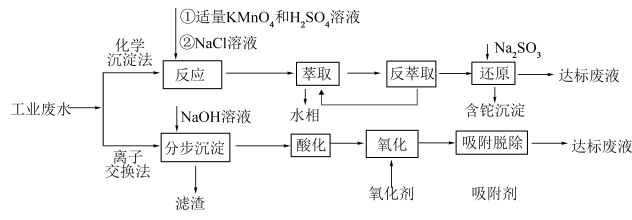
 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液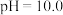 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示: | 离子 |  |  |  |
开始沉淀的 | 2.7 | 6.4 | 1.4 |
沉淀完全的 | 3.7 | 8.0 | 2.8 |

 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为
(2)“滤渣”的主要成分是
(3)请从化学平衡的角度解释“反萃取”过程中加入
 的原理和目的
的原理和目的(4)“分步沉淀”时,沉淀第二种离子时调节溶液
 的范围为
的范围为(5)废水中
 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为 ,可将离子交换树脂浸入
,可将离子交换树脂浸入a.
 b.
b. c.
c.
您最近一年使用:0次
2024-01-13更新
|
850次组卷
|
4卷引用:山东省济宁市2023-2024学年高三上学期1月期末化学试题
山东省济宁市2023-2024学年高三上学期1月期末化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届陕西省西安中学高三下学期三模理综试题-高中化学(已下线)T27-工业流程题
解题方法
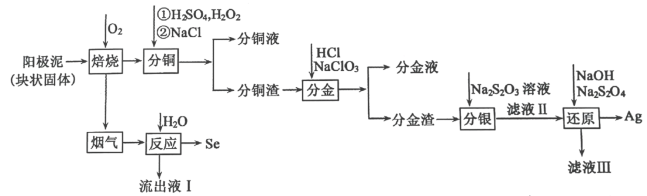
2 . 电解精炼铜的阳极泥中含有 等杂质,工业生产上从其中提取银和硒的流程如图所示:
等杂质,工业生产上从其中提取银和硒的流程如图所示:
已知: 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子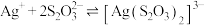 ,常温下该反应的平衡常数
,常温下该反应的平衡常数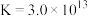 。
。
回答下列问题:
(1)加快“焙烧”速率可采取的一种措施为___________ 。
(2)流出液Ⅰ中溶质的主要成分是___________ ,分铜液中主要的金属阳离子是___________ 。
(3)“分铜”时,反应温度不能过高,原因是___________ ,加入氯化钠的主要目的是___________ 。
(4)“分金”时 转化成
转化成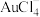 的离子方程式为
的离子方程式为___________ 。
(5)“分银”时发生的反应为 ,该反应中平衡常数
,该反应中平衡常数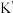
___________ [已知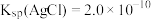 ]。
]。
(6)“还原”过程中 没有参与氧化还原过程,“滤液Ⅲ”中主要含有
没有参与氧化还原过程,“滤液Ⅲ”中主要含有 ,若制得
,若制得 银,则消耗
银,则消耗
___________  。
。
 等杂质,工业生产上从其中提取银和硒的流程如图所示:
等杂质,工业生产上从其中提取银和硒的流程如图所示:
已知:
 在碱性条件下很稳定,有很强的络合能力,与
在碱性条件下很稳定,有很强的络合能力,与 形成配离子
形成配离子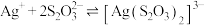 ,常温下该反应的平衡常数
,常温下该反应的平衡常数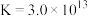 。
。回答下列问题:
(1)加快“焙烧”速率可采取的一种措施为
(2)流出液Ⅰ中溶质的主要成分是
(3)“分铜”时,反应温度不能过高,原因是
(4)“分金”时
 转化成
转化成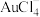 的离子方程式为
的离子方程式为(5)“分银”时发生的反应为
 ,该反应中平衡常数
,该反应中平衡常数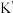
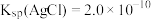 ]。
]。(6)“还原”过程中
 没有参与氧化还原过程,“滤液Ⅲ”中主要含有
没有参与氧化还原过程,“滤液Ⅲ”中主要含有 ,若制得
,若制得 银,则消耗
银,则消耗
 。
。
您最近一年使用:0次
名校
解题方法
3 . 下列离子方程式正确的是
A. 溶液与少量 溶液与少量 溶液反应: 溶液反应: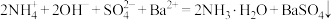 |
B.用热的NaOH溶液溶解S: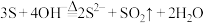 |
C.用 溶液吸收废气中的 溶液吸收废气中的 : :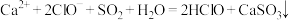 |
D.向 稀溶液中加入盐酸: 稀溶液中加入盐酸: |
您最近一年使用:0次
2024-01-10更新
|
649次组卷
|
2卷引用:山东省淄博第十一中学2023-2024学年高一下学期4月阶段性考试化学试卷
名校
4 . 肼(N2H4)是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用NH3和NaClO溶液反应制备肼,装置如图所示,并探究肼的性质。

回答下列问题:
(1)装置A中的化学方程式为___________ 。装置C中滴入浓盐酸时使用恒压滴液漏斗的优点是___________ 。
(2)装置B中制备肼的化学方程式为___________ 。
(3)图示装置存在的两处缺陷是___________ 。
(4)探究性质:已知N2H4为二元弱碱,在水中的电离与NH3相似。请写出N2H4在水溶液中的第二步电离方程式:___________ ,肼与硫酸反应生成酸式盐的化学式为___________ ,反应后的水溶液中含有多种阳离子,其中阳离子N2H 的电子式为
的电子式为___________ 。
(5)常温下,向N2H4的水溶液中滴加盐酸,溶液的pH与离子浓度的变化关系如图所示,下列说法正确的是___________(填标号)。


回答下列问题:
(1)装置A中的化学方程式为
(2)装置B中制备肼的化学方程式为
(3)图示装置存在的两处缺陷是
(4)探究性质:已知N2H4为二元弱碱,在水中的电离与NH3相似。请写出N2H4在水溶液中的第二步电离方程式:
 的电子式为
的电子式为(5)常温下,向N2H4的水溶液中滴加盐酸,溶液的pH与离子浓度的变化关系如图所示,下列说法正确的是___________(填标号)。

| A.N2H4在水溶液中的第一步电离平衡常数为1.0×10-8 |
| B.N2H5Cl溶液显酸性 |
C.N2H +N2H4 +N2H4 2N2H5+的平衡常数为1.0×109 2N2H5+的平衡常数为1.0×109 |
D.N2H6Cl2溶液中:c(Cl-)=2c(N2H )+2c(N2H )+2c(N2H ) ) |
您最近一年使用:0次
2024-01-02更新
|
402次组卷
|
2卷引用:山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题
名校
解题方法
5 . 随着第三代半导体材料砷化镓、砷化铟的发展,使得高纯砷的需求量越来越大。用含砷废渣(主要成分为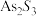 )制备高纯砷工艺流程如图。
)制备高纯砷工艺流程如图。
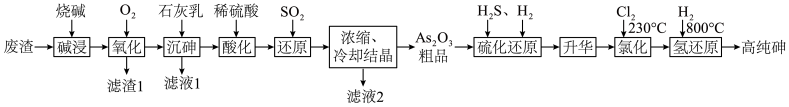
已知:①砷的主要化合价有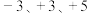 ;
;
②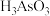 低温可分解;
低温可分解;
③砷与氯气在200~250℃时生成低价氯化物。
回答下列问题:
(1)“碱浸”发生的反应为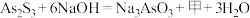 ,则甲的化学式为
,则甲的化学式为___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)“沉砷”生成 的最佳温度是85℃,温度过高,沉淀率却下降,原因为
的最佳温度是85℃,温度过高,沉淀率却下降,原因为___________ 。
(4)“还原”反应的离子方程式为___________ 。
(5)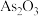 俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的
俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的 导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理
导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理___________ 。
(6)“氢还原”反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)可循环利用的物质有___________ 。
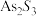 )制备高纯砷工艺流程如图。
)制备高纯砷工艺流程如图。
已知:①砷的主要化合价有
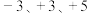 ;
;②
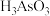 低温可分解;
低温可分解;③砷与氯气在200~250℃时生成低价氯化物。
回答下列问题:
(1)“碱浸”发生的反应为
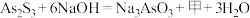 ,则甲的化学式为
,则甲的化学式为(2)“滤渣1”的主要成分为
(3)“沉砷”生成
 的最佳温度是85℃,温度过高,沉淀率却下降,原因为
的最佳温度是85℃,温度过高,沉淀率却下降,原因为(4)“还原”反应的离子方程式为
(5)
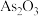 俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的
俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的 导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理
导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理(6)“氢还原”反应中氧化剂和还原剂的物质的量之比为
(7)可循环利用的物质有
您最近一年使用:0次
名校
6 . 一种制取电池级二氧化锰的工艺流程如下图:
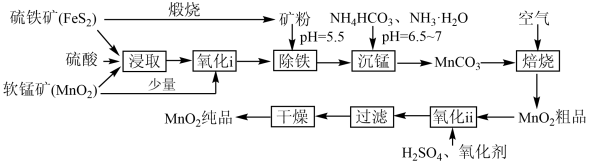
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式___________ 。
(2)“氧化i”过程软锰矿的作用是___________ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是___________ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液
与水形成的浊液 为9,若忽略
为9,若忽略 的第二步水解,则
的第二步水解,则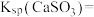
___________ (保留三位有效数字)[已知:室温下亚硫酸( )的电离平衡常数
)的电离平衡常数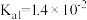 ,
,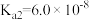 ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
的离子方程式为___________ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
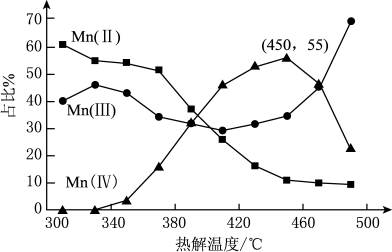
①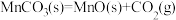
②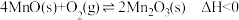
③
为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是___________ (答出两条)。
(5)用氧化还原法测定 样品纯度(杂质不参与下列反应):称取
样品纯度(杂质不参与下列反应):称取 样品
样品 ,试样经过过氧化钠碱熔后,得到
,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 过滤除去
过滤除去 ,用
,用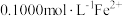 标准溶液滴定
标准溶液滴定 ,用去
,用去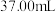 ,则样品中
,则样品中 的质量分数为
的质量分数为___________ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化i”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液
与水形成的浊液 为9,若忽略
为9,若忽略 的第二步水解,则
的第二步水解,则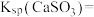
 )的电离平衡常数
)的电离平衡常数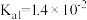 ,
,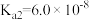 ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
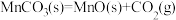
②
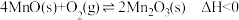
③

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是(5)用氧化还原法测定
 样品纯度(杂质不参与下列反应):称取
样品纯度(杂质不参与下列反应):称取 样品
样品 ,试样经过过氧化钠碱熔后,得到
,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 过滤除去
过滤除去 ,用
,用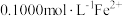 标准溶液滴定
标准溶液滴定 ,用去
,用去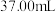 ,则样品中
,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
7 . 硫酸锌是一种重要的无机化工原料,可用于生产防腐剂、立德粉、媒染剂等。一种利用菱锌矿(主要成分为 ,含
,含 及Ca、Mg、Fe、Al、Mn、Cu等元素的化合物)制备
及Ca、Mg、Fe、Al、Mn、Cu等元素的化合物)制备 的工艺流程如下:
的工艺流程如下:

已知:①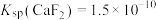 ,
, ;
;
②25℃时部分金属阳离子完全沉淀pH如下表:
回答下列问题:
(1)“焙烧”过程中,金属元素均转化为金属氧化物,能提高焙烧效率的措施有___________ 。
(2)滤渣1的主要成分为___________ ;得到黄铵铁矾[ ]的化学方程式为
]的化学方程式为___________ 。
(3)试剂X最适宜的有___________ (填化学式)。
(4)“氧化除杂”过程中发生反应的离子方程式为___________ ;“转化除杂”主要除去的杂质离子为___________ (填离子符号)。
(5)若取1L“沉钙、镁”后溶液,测得 、
、 浓度均为
浓度均为 ,则至少需通入
,则至少需通入___________ gHF气体才能使 、
、 沉淀完全。
沉淀完全。
 ,含
,含 及Ca、Mg、Fe、Al、Mn、Cu等元素的化合物)制备
及Ca、Mg、Fe、Al、Mn、Cu等元素的化合物)制备 的工艺流程如下:
的工艺流程如下:
已知:①
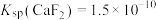 ,
, ;
;②25℃时部分金属阳离子完全沉淀pH如下表:
 |  |  |
| 10.1 | 4.7 | 8.2 |
(1)“焙烧”过程中,金属元素均转化为金属氧化物,能提高焙烧效率的措施有
(2)滤渣1的主要成分为
 ]的化学方程式为
]的化学方程式为(3)试剂X最适宜的有
(4)“氧化除杂”过程中发生反应的离子方程式为
(5)若取1L“沉钙、镁”后溶液,测得
 、
、 浓度均为
浓度均为 ,则至少需通入
,则至少需通入 、
、 沉淀完全。
沉淀完全。
您最近一年使用:0次
名校
解题方法
8 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
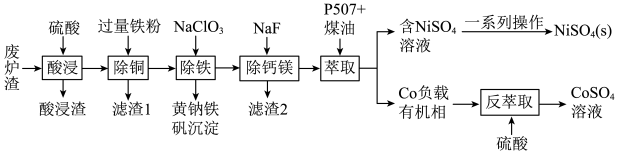
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是___________ 。(写化学式)
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F-)最小为___________ mol·L-1。[已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,Ksp(CaF2)=1.0×10-10(mol/L)3,Ksp(MgF2)=7.5×10-11(mol/L)3]
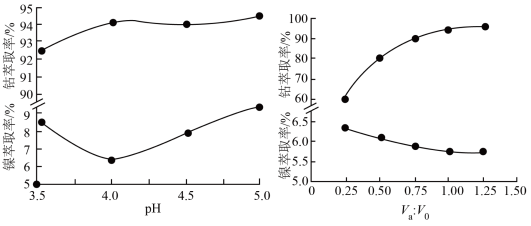
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为___________ 、___________ 。
(5)获得NiSO4(s)的“一系列操作”是___________ 。
(6)该工艺流程中,可循环利用的物质是___________ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为

(5)获得NiSO4(s)的“一系列操作”是
(6)该工艺流程中,可循环利用的物质是
您最近一年使用:0次
2023-12-27更新
|
596次组卷
|
4卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
山东省实验中学2023-2024学年高三上学期11月二诊化学试题山东省淄博市部分学校2023-2024学年高三上学期联考化学试卷(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题
9 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质与NH4Cl类似。工业上主要采用电化学法制备,装置如图1所示,含Fe的催化电极反应机理如图2所示,不考虑溶液体积的变化。下列说法正确的是
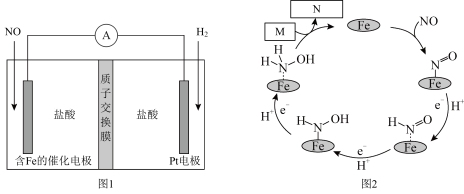

| A.电池工作时,Pt电极为正极 |
| B.图2中,M为H+,N为NH3OH+ |
| C.电池工作时,每消耗2.24LNO(标准状况)左室溶液质量增加3.3g |
| D.电池工作一段时间后,正极区溶液的pH减小 |
您最近一年使用:0次
10 .  大量排放造成环境污染,以
大量排放造成环境污染,以 还原
还原 的的选择性催化还原(
的的选择性催化还原( )技术广泛应用于烟气(含NO、
)技术广泛应用于烟气(含NO、 、
、 等)脱硝。
等)脱硝。
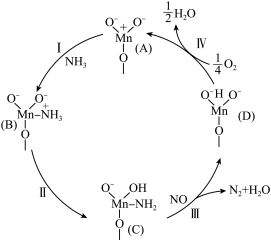
(1)以 催化的
催化的 反应机理如图所示,
反应机理如图所示, 反应的化学方程式为:
反应的化学方程式为:___________ 。
(2)以 催化的
催化的 。
。
①催化剂的制备。将预先制备的一定量的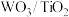 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为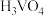 沉淀的离子方程式为
沉淀的离子方程式为___________ ;反应选用 溶液而不选用
溶液而不选用 溶液的原因是
溶液的原因是___________ 。
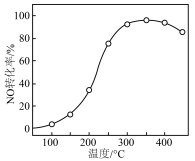
②催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是___________ ;反应温度高于380℃,NO转化率下降,除因为进入反应器的NO被还原的量减少外,还有___________ (用化学方程式表示)。
③废催化剂的回收。回收 并制备
并制备 的过程如下图所示:
的过程如下图所示:
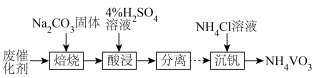
酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
 大量排放造成环境污染,以
大量排放造成环境污染,以 还原
还原 的的选择性催化还原(
的的选择性催化还原( )技术广泛应用于烟气(含NO、
)技术广泛应用于烟气(含NO、 、
、 等)脱硝。
等)脱硝。
(1)以
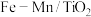 催化的
催化的 反应机理如图所示,
反应机理如图所示, 反应的化学方程式为:
反应的化学方程式为:(2)以
 催化的
催化的 。
。①催化剂的制备。将预先制备的一定量的
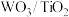 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为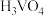 沉淀的离子方程式为
沉淀的离子方程式为 溶液而不选用
溶液而不选用 溶液的原因是
溶液的原因是②催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
③废催化剂的回收。回收
 并制备
并制备 的过程如下图所示:
的过程如下图所示:
酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
您最近一年使用:0次



