解题方法
1 . 钕铁硼因其超强的磁性被誉为“永磁之王”,广泛应用于新能源汽车、信息存储等方面。从钕铁硼废料(主要成分为Nd、铁、硼、铝,少量的硅酸盐)中回收钕元素的工艺流程如图所示:
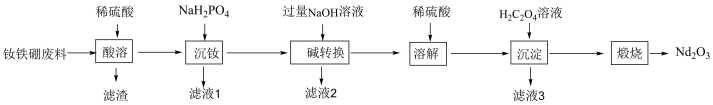
已知:①硼难溶于非氧化性酸, 难溶于水和稀酸,滤液1中主要金属离子为
难溶于水和稀酸,滤液1中主要金属离子为 、
、 ,沉淀时得到
,沉淀时得到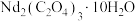 。
。
②部分金属离子( )形成氢氧化物沉淀的pH范围如表:
)形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)“滤渣”的主要成分是___________ (填化学式)。
(2)除去铝元素的操作单元为___________ 。
(3)若“酸溶”后溶液中 的浓度为1.0
的浓度为1.0 ,则“沉钕”时调节pH范围为
,则“沉钕”时调节pH范围为___________ ,“碱转化”过程Nd元素发生反应的离子方程式为___________ 。
(4)“煅烧”过程中固体质量变化( )随温度变化曲线如图所示:
)随温度变化曲线如图所示:

750K时得到的固体是___________ ,若在1000K下进行煅烧,发生反应的化学方程式为___________ 。

已知:①硼难溶于非氧化性酸,
 难溶于水和稀酸,滤液1中主要金属离子为
难溶于水和稀酸,滤液1中主要金属离子为 、
、 ,沉淀时得到
,沉淀时得到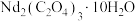 。
。②部分金属离子(
 )形成氢氧化物沉淀的pH范围如表:
)形成氢氧化物沉淀的pH范围如表:| 金属离子 |  |  |  |
| 开始沉淀 | 6.3 | 1.5 | 3.4 |
完全沉淀(离子浓度: ) ) | 8.3 | 2.8 | 4.7 |
(1)“滤渣”的主要成分是
(2)除去铝元素的操作单元为
(3)若“酸溶”后溶液中
 的浓度为1.0
的浓度为1.0 ,则“沉钕”时调节pH范围为
,则“沉钕”时调节pH范围为(4)“煅烧”过程中固体质量变化(
 )随温度变化曲线如图所示:
)随温度变化曲线如图所示:
750K时得到的固体是
您最近一年使用:0次
2023-10-11更新
|
604次组卷
|
3卷引用:山东省潍坊市五县区2023-2024学年高三上学期10月阶段监测化学试题
2 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成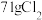 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: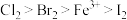 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: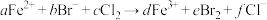 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①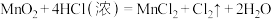
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
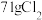 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
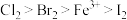 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: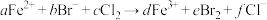 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
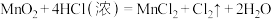
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
800次组卷
|
3卷引用: 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试化学模拟卷(二)
3 . 黄铁矿制硫酸的副产物硒酸泥中含有较高品位的硒元素(其主要成分含量如下表所示),硒酸泥可用于制取硒单质。
步骤1:粗硒的制备

步骤2:粗硒的精制
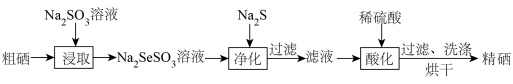
回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的___________ (填化学式),采取“热过滤”的主要原因是___________ 。
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为___________ ,生成H2SeO4的化学方程式为___________ 。反应过程中稀硫酸的浓度要大于3mol·L-1,原因是___________ 。
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为___________ 。若硫脲按此半反应式发生转化,则等物质的量的(NH2)2CS和Na2 SO3,还原能力较强的是___________ 。
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>___________ mol·L-1[ ]。
]。
(5)步骤2中“酸化”时发生反应的离子方程式为___________ 。
| 成分 | Se | S | Fe2O3 | SiO2 | CuO | ZnO |
| 质量分数(%) | 9.10 | 23.80 | 65.01 | 0.31 | 0.87 | 0.91 |

步骤2:粗硒的精制

回答下列问题:
(1)步骤1中“浸取”的主要目的是为了除去硒酸泥中的
(2)步骤1中“氧化浸硒”时主要生成H2SeO3和C1O2,当NaClO3过量会有副产物H2SeO4生成。H2SeO3的化学名称为
(3)步骤1中“还原”时硫脲[(NH2)2CS]和Na2SO3均为还原剂。酸性条件下,硫脲转化成(SCN2H3)2的半反应式为
(4)步骤2中“净化”时,Na2SeSO3溶液中少量的Fe2+转化为FeS沉淀而除去,若沉淀完全后要求Fe2+的浓度小于0.56mg·L-1,则此时溶液中的c(S2-)>
 ]。
]。(5)步骤2中“酸化”时发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 镓、锗相关物质具有明显的军民两用属性,2023年8月起,我国对镓、锗相关物质实施出口管制。从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示:

(1)滤渣I的主要成分:___________ ;碱浸操作需要控制温度为70℃,原因是___________ 。
(2)碱浸操作中GaAs被H2O2氧化,发生的化学方程式为:___________ 。每反应1mol GaAs,转移电子的数目:___________ 。
(3)该工艺得到的Na3AsO4·12H2O纯度较低,可以通过___________ 的方法进行提纯。“旋流电积”所得“尾液”的溶质主要是___________ ,可循环使用,提高效益。
(4)“旋流电积”用到了先进的水系锌基电池,该电池采用了新型的A位K/Na掺杂Ni-Co-Zn-Mn钙钛矿氟化物(K/Na-NCZMF)电极材料,如图所示(注明:0.lM代表0.1mol/L)。

该电池放电时,M极上含锰产物为:___________ ,N极发生的电极反应式:___________ 。

(1)滤渣I的主要成分:
(2)碱浸操作中GaAs被H2O2氧化,发生的化学方程式为:
(3)该工艺得到的Na3AsO4·12H2O纯度较低,可以通过
(4)“旋流电积”用到了先进的水系锌基电池,该电池采用了新型的A位K/Na掺杂Ni-Co-Zn-Mn钙钛矿氟化物(K/Na-NCZMF)电极材料,如图所示(注明:0.lM代表0.1mol/L)。

该电池放电时,M极上含锰产物为:
您最近一年使用:0次
5 . 碲(Te)是重要的稀有元素,被誉为“现代高新技术材料的维生素”。一种从碲化镉废料中(主要成分为CdTe、CdS、SiO2)回收Te和Cd的工艺流程如图所示。

已知:室温下,饱和H2S溶液的浓度为0.01mol·L-1, ,
, ;
; ;
; 。
。
回答下列问题:
(1)“氧化浸出”时,温度控制在80℃的原因是___________ 。“氧化浸出”过程中CdTe反应的离子方程式为___________ 。其他条件不变,双氧水与物料质量比对碲回收率的影响如图所示。质量比高于0.6时,碲回收率降低的原因是___________ 。

(2)“溶浸”过程中,若H2O2过量,将增加___________ (填化学式)的用量。“浸渣”中含有的一种单质是___________ 。
(3)“沉镉”需在酸性环境中进行的原因是___________ 。Cd2+完全沉淀时,为防止H2S气体逸出,溶液中 应控制在
应控制在___________ mol·L-1以下(离子浓度低于10-5mol·L-1视为完全沉淀)。

已知:室温下,饱和H2S溶液的浓度为0.01mol·L-1,
 ,
, ;
; ;
; 。
。回答下列问题:
(1)“氧化浸出”时,温度控制在80℃的原因是

(2)“溶浸”过程中,若H2O2过量,将增加
(3)“沉镉”需在酸性环境中进行的原因是
 应控制在
应控制在
您最近一年使用:0次
解题方法
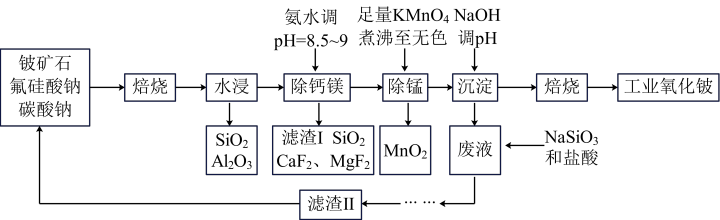
6 . 一种以铍矿石(含BeO、 、
、 及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
已知:Ⅰ.氟硅酸钠( )、
)、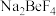 微溶于冷水,溶解度随温度升高有所增大。
微溶于冷水,溶解度随温度升高有所增大。
Ⅱ.常温下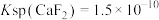 ,
, 。
。
Ⅲ.Be、Al的化合物性质相似。
回答下列问题:
(1)焙烧时Be、Si元素分别转化为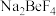 、
、 ,铍矿石中BeO发生反应的化学方程式为
,铍矿石中BeO发生反应的化学方程式为________ 。
(2)水浸时为了增大铍元素的浸出率可采取的措施有________ (答1条即可)。
(3)氨水调pH目的之一是除去未反应的 ,离子方程式为
,离子方程式为________ ,同时产物可除去 、
、 。
。
(4)除锰液中存在 ,常温下,平衡常数
,常温下,平衡常数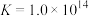 。当溶液中
。当溶液中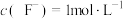 ,
,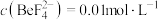 时,加NaOH调pH应稍大于
时,加NaOH调pH应稍大于________ ,若pH过大会造成氧化铍产率________ (填“增大”、“减小”或“不变”)。
(5)废液处理后得到滤渣Ⅱ________ (填化学式)可回收利用。回收滤渣Ⅱ后,废液中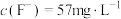 ,每升废液中需要加熟石灰至少
,每升废液中需要加熟石灰至少________ mg,才能达到排放标准 (结果保留整数)。
(结果保留整数)。
 、
、 及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
及少量Ca、Mg、Mn等元素)与配料(氟硅酸钠、碳酸钠)生产氧化铍的工艺流程如下:
已知:Ⅰ.氟硅酸钠(
 )、
)、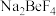 微溶于冷水,溶解度随温度升高有所增大。
微溶于冷水,溶解度随温度升高有所增大。Ⅱ.常温下
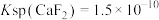 ,
, 。
。Ⅲ.Be、Al的化合物性质相似。
回答下列问题:
(1)焙烧时Be、Si元素分别转化为
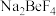 、
、 ,铍矿石中BeO发生反应的化学方程式为
,铍矿石中BeO发生反应的化学方程式为(2)水浸时为了增大铍元素的浸出率可采取的措施有
(3)氨水调pH目的之一是除去未反应的
 ,离子方程式为
,离子方程式为 、
、 。
。(4)除锰液中存在
 ,常温下,平衡常数
,常温下,平衡常数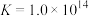 。当溶液中
。当溶液中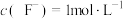 ,
,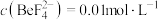 时,加NaOH调pH应稍大于
时,加NaOH调pH应稍大于(5)废液处理后得到滤渣Ⅱ
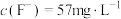 ,每升废液中需要加熟石灰至少
,每升废液中需要加熟石灰至少 (结果保留整数)。
(结果保留整数)。
您最近一年使用:0次
7 . 城市污水中含有一定量的 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是
 、
、 ,向污水中加入菌体和
,向污水中加入菌体和 溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现
溶液,在菌体的作用下依次发生过程Ⅰ、过程Ⅱ,从而实现 、
、 的脱除,其过程如图所示。下列说法正确的是
的脱除,其过程如图所示。下列说法正确的是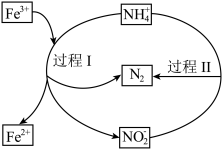
A.“过程Ⅰ”中 为催化剂 为催化剂 |
B. 的氧化性强于 的氧化性强于 |
C.“过程Ⅱ”中氧化产物和还原产物的质量之比为 |
D.“过程Ⅰ”中 和 和 的物质的量之比为 的物质的量之比为 ,则氧化剂与还原剂物质的量之比为 ,则氧化剂与还原剂物质的量之比为 |
您最近一年使用:0次
2023-09-23更新
|
584次组卷
|
10卷引用:山东省滨州市2023-2024学年高三上学期11月期中考试化学试题
山东省滨州市2023-2024学年高三上学期11月期中考试化学试题湘豫名校联考2023-2024学年高三上学期一轮诊断化学试题河南省信阳市信阳高级中学2024届高三上学期9月一模化学试题黑龙江省双鸭山市第一中学2023-2024学年高三上学期10月月考化学试题(已下线)选择题11-15湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题江西省赣州市信丰中学2023-2024学年高一上学期11月月考化学试题河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题(已下线)选择题6-10河南省洛阳市宜阳县第一高级中学2023-2024学年高一上学期(研学班)期末考试化学试卷
名校
解题方法
8 . 研究小组以 (绿色固体)、
(绿色固体)、 等物质为原料制备无水
等物质为原料制备无水 (紫色固体,易升华),制备装置如图所示(夹持装置略)。
(紫色固体,易升华),制备装置如图所示(夹持装置略)。

(1)仪器A的名称为_______ 。
(2)B处的装置为_______ (填选项),装的药品为_______ 。
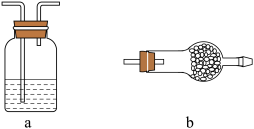
(3)本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、_______ 。
(4)反应管的温度升到 时发生反应,生成
时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为_______ 。 有剧毒,与水反应生成两种酸性气体,
有剧毒,与水反应生成两种酸性气体, 分子中
分子中 原子的杂化方式为
原子的杂化方式为_______ ,C装置中生成的盐是_______ (填化学式)。
(5)反应管右端有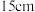 在加热炉外,其作用是
在加热炉外,其作用是_______ 。
(6)反应完成后,得到固体产品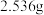 。则该实验的产率为
。则该实验的产率为_______  。[已知
。[已知 的式量为152;
的式量为152; 的式量为158.5]
的式量为158.5]
 (绿色固体)、
(绿色固体)、 等物质为原料制备无水
等物质为原料制备无水 (紫色固体,易升华),制备装置如图所示(夹持装置略)。
(紫色固体,易升华),制备装置如图所示(夹持装置略)。
(1)仪器A的名称为
(2)B处的装置为

(3)本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、(4)反应管的温度升到
 时发生反应,生成
时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为 有剧毒,与水反应生成两种酸性气体,
有剧毒,与水反应生成两种酸性气体, 分子中
分子中 原子的杂化方式为
原子的杂化方式为(5)反应管右端有
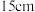 在加热炉外,其作用是
在加热炉外,其作用是(6)反应完成后,得到固体产品
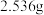 。则该实验的产率为
。则该实验的产率为 。[已知
。[已知 的式量为152;
的式量为152; 的式量为158.5]
的式量为158.5]
您最近一年使用:0次
2023-09-10更新
|
193次组卷
|
3卷引用: 山东省日照市五莲县第一中学2024届高三上学期阶段性测试化学试题
名校
解题方法
9 . 以含钴废料(主要成分 ,难溶于水,还含有少量
,难溶于水,还含有少量 、
、 、PbO杂质)为原料,制备
、PbO杂质)为原料,制备 工艺流程如图所示。
工艺流程如图所示。

流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)滤渣1为___________ (填化学式,下同);滤渣2为___________ 。
(2)“浸取”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ ( 中Co转化为
中Co转化为 )。
)。
(3)“氧化”时加入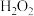 的作用是
的作用是___________ (用离子方程式表示),“沉锂”时加入NaF的作用是___________ 。
(4)“调pH”时,pH的范围为___________ 。
(5)“沉钴”时, 溶液滴加过快会导致产品不纯,其原因是
溶液滴加过快会导致产品不纯,其原因是___________ 。
 ,难溶于水,还含有少量
,难溶于水,还含有少量 、
、 、PbO杂质)为原料,制备
、PbO杂质)为原料,制备 工艺流程如图所示。
工艺流程如图所示。
流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
(1)滤渣1为
(2)“浸取”时,
 发生反应的化学方程式为
发生反应的化学方程式为 中Co转化为
中Co转化为 )。
)。(3)“氧化”时加入
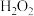 的作用是
的作用是(4)“调pH”时,pH的范围为
(5)“沉钴”时,
 溶液滴加过快会导致产品不纯,其原因是
溶液滴加过快会导致产品不纯,其原因是
您最近一年使用:0次
2023-08-15更新
|
203次组卷
|
2卷引用: 山东省日照市五莲县第一中学2024届高三上学期阶段性测试化学试题
名校
解题方法
10 . 铋酸钠(NaBiO3)在酸性条件下可将Mn2+氧化成MnO ,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
 ,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是| A.常温下,NaBiO3和Bi(NO3)3均可溶于水 |
B.制备NaBiO3的化学方程式为Bi(NO3)3+4NaOH+NaClO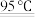 NaBiO3↓+NaCl+3NaNO3+2H2O NaBiO3↓+NaCl+3NaNO3+2H2O |
| C.将Bi(NO3)3溶解于稀HNO3溶液中的目的是增强酸性 |
| D.用NaBiO3分析测定锰元素的过程中,NaBiO3发生氧化反应 |
您最近一年使用:0次
2023-08-15更新
|
470次组卷
|
3卷引用: 山东省日照市五莲县第一中学2024届高三上学期阶段性测试化学试题



