解题方法
1 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。由镍矿渣[主要含 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: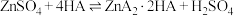
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式_______ ,滤渣1的主要成分是_______ 。
(2)已知“除铁”时,NaClO的作用是将 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式_______ 。
(3)“除钙”时,加入 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式_______ 。
(4)若已知萃取剂的密度大于水的密度,则应保留_______ 液体。(填“上层”或“下层”)在完成“萃取”操作后,后续操作依次为_______ 、_______ 。
 、NiS,还含锌、铁、钙的氧化物、
、NiS,还含锌、铁、钙的氧化物、 等]制备草酸镍晶体的流程如图:
等]制备草酸镍晶体的流程如图: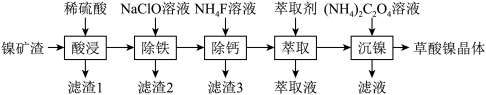
 与萃取剂(用HA表示)存在:
与萃取剂(用HA表示)存在: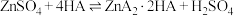
(1)“酸浸”过程中,生成了一种臭鸡蛋气味的气体,写出相应反应的离子方程式
(2)已知“除铁”时,NaClO的作用是将
 氧化为
氧化为 并转化为
并转化为 沉淀而除去,若将氧化剂改为
沉淀而除去,若将氧化剂改为 ,写出
,写出 与
与 反应生成
反应生成 的化学方程式
的化学方程式(3)“除钙”时,加入
 溶液使钙离子转化为
溶液使钙离子转化为 沉淀,写出
沉淀,写出 的电子式
的电子式(4)若已知萃取剂的密度大于水的密度,则应保留
您最近一年使用:0次
名校
解题方法
2 . 硫及其化合物的“价-类”二维图如下图所示,回答下列问题:___________ ,Y的化学式是___________ 。
(2)检验 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入___________ ,无明显现象,再加入___________ 溶液,若产生白色沉淀,则溶液中含有 。
。
(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。
①请用“双线桥”法标明该反应电子转移的方向和数目___________ 。
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为___________ L。
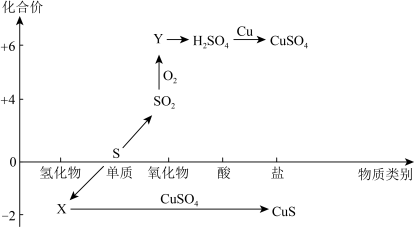
(2)检验
 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入 。
。(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓)
 CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。①请用“双线桥”法标明该反应电子转移的方向和数目
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为
您最近一年使用:0次
3 . 金属 可以在高温条件下还原
可以在高温条件下还原 制备熔点较高金属
制备熔点较高金属 ,金属
,金属 是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原
是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原 制备金属
制备金属 ,工艺流程如图。下列说法
,工艺流程如图。下列说法不正确 的是
 可以在高温条件下还原
可以在高温条件下还原 制备熔点较高金属
制备熔点较高金属 ,金属
,金属 是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原
是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原 制备金属
制备金属 ,工艺流程如图。下列说法
,工艺流程如图。下列说法
A.工业上可通过电解熔融 制取金属 制取金属 |
B.用金属 还原 还原 过程中需要通入 过程中需要通入 作保护气 作保护气 |
C.“真空蒸馏”的目的是使 、 、 气化,实现与 气化,实现与 的分离 的分离 |
D.制得海绵针中含有少量金属 ,可以用稀盐酸浸泡除 ,可以用稀盐酸浸泡除 |
您最近一年使用:0次
名校
解题方法
4 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入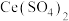 与
与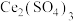 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=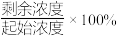 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。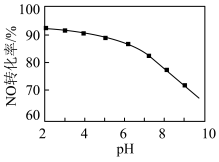
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入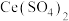 与
与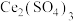 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。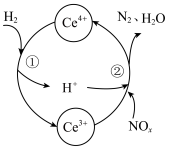
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=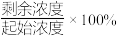 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是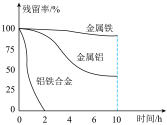
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
您最近一年使用:0次
2024-05-06更新
|
195次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
5 . 我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),请回答下列问题:
(1)肼又名联氨,其结构式为_____ 。
(2)液态肼与过氧化氢的反应属于_____ (填“吸热”或“放热”)反应。
(3)写出该火箭推进器中相关反应的化学方程式:_____ 。
(4)在一定温度下,向0.5L密闭容器中充入2molN2H4和2molO2发生如下反应:N2H4(g)+O2(g)⇌N2(g)+2H2O(g),其中有关物质的物质的量随时间变化的曲线如图所示,请回答下列问题:_____
②下列能说明该反应达到平衡状态的是_____ 。
A.υ正(N2)=2υ逆(H2O)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.体系的压强不再发生变化
D.混合气体的密度不再发生变化
E.每断开1molO=O键,同时断开4molH-O键
③该反应达到平衡时,O2的体积百分数为_____ (结果保留一位小数)
④下列措施能够增大正反应的化学反应速率的有( )
A.升高反应温度 B.加入适当的催化剂C.向容器中加入氧气 D.向容器中加入氖气
(5)广泛应用的肼(N2H4)燃料电池属于环境友好型电池,该电池以空气中的氧气作氧化剂,氢氧化钠溶液作电解质,其负极的电极方程式:_____
(1)肼又名联氨,其结构式为
(2)液态肼与过氧化氢的反应属于
(3)写出该火箭推进器中相关反应的化学方程式:
(4)在一定温度下,向0.5L密闭容器中充入2molN2H4和2molO2发生如下反应:N2H4(g)+O2(g)⇌N2(g)+2H2O(g),其中有关物质的物质的量随时间变化的曲线如图所示,请回答下列问题:
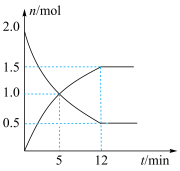
②下列能说明该反应达到平衡状态的是
A.υ正(N2)=2υ逆(H2O)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.体系的压强不再发生变化
D.混合气体的密度不再发生变化
E.每断开1molO=O键,同时断开4molH-O键
③该反应达到平衡时,O2的体积百分数为
④下列措施能够增大正反应的化学反应速率的有
A.升高反应温度 B.加入适当的催化剂C.向容器中加入氧气 D.向容器中加入氖气
(5)广泛应用的肼(N2H4)燃料电池属于环境友好型电池,该电池以空气中的氧气作氧化剂,氢氧化钠溶液作电解质,其负极的电极方程式:
您最近一年使用:0次
名校
6 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
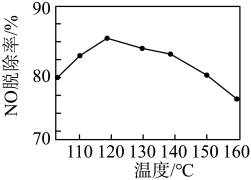
您最近一年使用:0次
名校
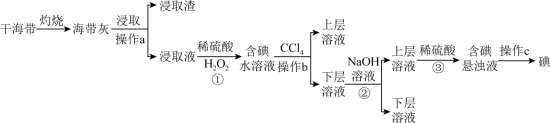
7 . 浩瀚的海洋里蕴藏着丰富的化学资源,从海带中提取碘单质的工艺流程如图。回答下列问题:_______ (填仪器名称)中,用酒精灯充分加热灰化。
(2)浸取液中碘主要以 存在,写出①发生反应的离子方程式
存在,写出①发生反应的离子方程式_______ ,实验步骤①后若检验溶液中碘单质的存在,具体方法是_______ 。
(3)向含有 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象
振荡静置后的实验现象_______ 。
(4)步骤②中加入浓 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为_______ ,步骤③反应中氧化剂与还原剂物质的量之比为_______ 。
(5)步骤②③是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为_______ 法。
(6)操作c的名称为_______ 。
(2)浸取液中碘主要以
 存在,写出①发生反应的离子方程式
存在,写出①发生反应的离子方程式(3)向含有
 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象
振荡静置后的实验现象(4)步骤②中加入浓
 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为(5)步骤②③是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为
(6)操作c的名称为
您最近一年使用:0次
名校
8 . 白硼钙石的主要成分是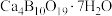 (含有少量
(含有少量 、FeO、
、FeO、 和
和 等杂质),利用白硼钙石制取强还原剂
等杂质),利用白硼钙石制取强还原剂 的工艺流程如下:
的工艺流程如下: 微溶于水,易溶于乙醇;偏硼酸钠(
微溶于水,易溶于乙醇;偏硼酸钠( )易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
(1) 中H的化合价为
中H的化合价为_________ ,该物质所含的化学键类型有_________________ 。
(2)写出“酸浸过滤”中发生的主要化学反应方程式______________________________ 。
(3)“气体”的主要成分为________________ 。“滤渣1”的主要成分是___________________ 。
(4)“操作X”为____________________________ 。
(5)写出“反应Y”的化学方程式________________________________________ 。
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克 的还原能力)可用衡量含氢还原剂的还原能力,则
的还原能力)可用衡量含氢还原剂的还原能力,则 的有效氢含量为
的有效氢含量为__________ (保留2位有效数字)。
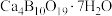 (含有少量
(含有少量 、FeO、
、FeO、 和
和 等杂质),利用白硼钙石制取强还原剂
等杂质),利用白硼钙石制取强还原剂 的工艺流程如下:
的工艺流程如下:
 微溶于水,易溶于乙醇;偏硼酸钠(
微溶于水,易溶于乙醇;偏硼酸钠( )易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。
)易溶于水,溶解度随温度升高而增大,难溶于乙醇,碱性条件下稳定。(1)
 中H的化合价为
中H的化合价为(2)写出“酸浸过滤”中发生的主要化学反应方程式
(3)“气体”的主要成分为
(4)“操作X”为
(5)写出“反应Y”的化学方程式
(6)“有效氢含量”(即:每克含氢还原剂的还原能力相当于多少克
 的还原能力)可用衡量含氢还原剂的还原能力,则
的还原能力)可用衡量含氢还原剂的还原能力,则 的有效氢含量为
的有效氢含量为
您最近一年使用:0次
名校
9 . 碘元素是人体必需的微量元素之一。某小组设计以下实验从海带中提取碘并测定食盐中碘元素的含量。
Ⅰ.海带提碘
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入__________ (填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。 溶液,然后再加入0.5mL
溶液,然后再加入0.5mL ,振荡后静置,若观察到
,振荡后静置,若观察到_________ (填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为______________ 。
(3)萃取实验中,若要使碘尽可能地完全转移到 中,可采取的操作是
中,可采取的操作是______________ 。
Ⅱ.人体碘的重要来源之一是食用加碘食盐(含 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验:
①配制1L 硫代硫酸钠(
硫代硫酸钠( )标准溶液;
)标准溶液;
②用天平准确称取wg食盐样品,加适量蒸馏水使其完全溶解;
③用稀硫酸酸化所得溶液,加入足量KI溶液,使 与KI反应完全生成
与KI反应完全生成 ;
;
④向③中混合液逐滴加入浓度为 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液6.00mL。(已知:
溶液6.00mL。(已知: )
)
已知: 易溶于水,具有强还原性。
易溶于水,具有强还原性。
(4)配制硫代硫酸钠溶液时用分析天平准确称量 固体的质量为
固体的质量为______ g。(保留小数点后2位)
(5)配制前蒸馏水需先煮沸再冷却,其目的是__________ 。
(6)下列情况中,导致所配溶液的物质的量浓度偏低的是________.(填标号)。
(7)上述食盐样品中碘元素的含量为__________ mg/kg(用含w的代数式表示)。
Ⅰ.海带提碘
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入

 溶液,然后再加入0.5mL
溶液,然后再加入0.5mL ,振荡后静置,若观察到
,振荡后静置,若观察到(3)萃取实验中,若要使碘尽可能地完全转移到
 中,可采取的操作是
中,可采取的操作是Ⅱ.人体碘的重要来源之一是食用加碘食盐(含
 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验:①配制1L
 硫代硫酸钠(
硫代硫酸钠( )标准溶液;
)标准溶液;②用天平准确称取wg食盐样品,加适量蒸馏水使其完全溶解;
③用稀硫酸酸化所得溶液,加入足量KI溶液,使
 与KI反应完全生成
与KI反应完全生成 ;
;④向③中混合液逐滴加入浓度为
 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液6.00mL。(已知:
溶液6.00mL。(已知: )
)已知:
 易溶于水,具有强还原性。
易溶于水,具有强还原性。(4)配制硫代硫酸钠溶液时用分析天平准确称量
 固体的质量为
固体的质量为(5)配制前蒸馏水需先煮沸再冷却,其目的是
(6)下列情况中,导致所配溶液的物质的量浓度偏低的是________.(填标号)。
| A.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| B.转移溶液至容量瓶过程中,有少量溶液溅出 |
| C.定容时俯视刻度线读数 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 |
(7)上述食盐样品中碘元素的含量为
您最近一年使用:0次
名校
10 . 有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为 )的pH与原子序数的关系如图2所示。
)的pH与原子序数的关系如图2所示。
(1)元素i位于第五周期且与元素z同族,该元素原子序数为___________ ,该元素单质及其化合物一个重要的应用是____________________ 。
(2)比较d、f、g常见离子的半径大小____________ (由大到小用离子符号表示)。
(3)由元素x、y、z、d四种元素组成的常见的阴阳离子个数比1:1的化合物与氢氧化钡溶液反应的离子方程式为__________________________________ 。
(4)下列可作为比较f和e金属性强弱的依据是__________ 。
a.测两种元素单质的硬度和熔、沸点
b.二者最高价氧化物水化物能相互反应
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(5)元素g、h按照原子个数比1:1可组成满足8电子稳定结构的四原子分子,该物质能够遇水剧烈反应,生成沉淀和气体。写出相应的化学方程式_____________________ 。
(6)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄漏时,消防人员通常采用喷洒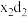 溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为_______________ 。已知eyz含有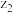 分子中类似的化学键,写出化合物eyz的电子式
分子中类似的化学键,写出化合物eyz的电子式______________ 。
 )的pH与原子序数的关系如图2所示。
)的pH与原子序数的关系如图2所示。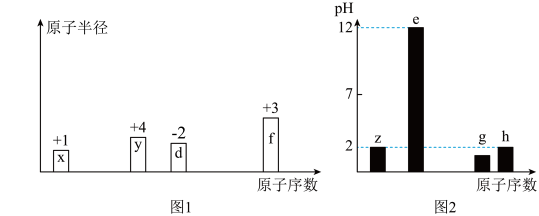
(1)元素i位于第五周期且与元素z同族,该元素原子序数为
(2)比较d、f、g常见离子的半径大小
(3)由元素x、y、z、d四种元素组成的常见的阴阳离子个数比1:1的化合物与氢氧化钡溶液反应的离子方程式为
(4)下列可作为比较f和e金属性强弱的依据是
a.测两种元素单质的硬度和熔、沸点
b.二者最高价氧化物水化物能相互反应
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(5)元素g、h按照原子个数比1:1可组成满足8电子稳定结构的四原子分子,该物质能够遇水剧烈反应,生成沉淀和气体。写出相应的化学方程式
(6)由上述元素中的y、z、e组成的某剧毒化合物eyz不慎泄漏时,消防人员通常采用喷洒
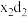 溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
溶液的方式处理,以减少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为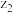 分子中类似的化学键,写出化合物eyz的电子式
分子中类似的化学键,写出化合物eyz的电子式
您最近一年使用:0次



