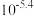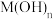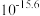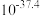名校
解题方法
1 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。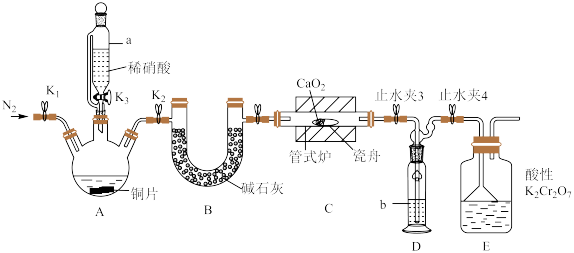
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: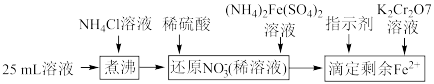
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
今日更新
|
160次组卷
|
4卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
名校
2 . 蒽醌二磺酸钠法(ADA法)对合成氨原料气进行脱硫(H2S)的工艺流程如图所示,该工艺的优势之一在于只要向“再生吸收液”不断通如空气即可实现连续吸收H2S气体。
ii.酒石酸钾钠、EDTA可分别与V4+、Fe3+形成可溶性配合物。
(1)“吸收”时,发生反应的离子方程式为___________ 。
(2)“脱硫”时,NaVO3先转化为Na2V4O9同时可得到S,则该转化过程反应的化学方程式为___________ 。
(3)“还原”时,氧化态ADA(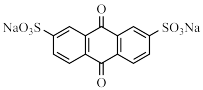 )转化为还原态ADA(
)转化为还原态ADA(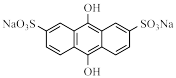 ),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为
),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为___________ ,Na2V4O9参与反应过程中氧化剂和还原剂的物质的量之比为___________ 。
(4)“氧化”时,ADA(还原态)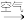 ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是
ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是___________ ;加入EDTA的目的是___________ 。
(5)“再生吸收液”中可循环使用的物质有___________ (填选项字母)。
A.NaOH B.酒石酸钾钠 C.NaVO3 D.EDTA E.ADA
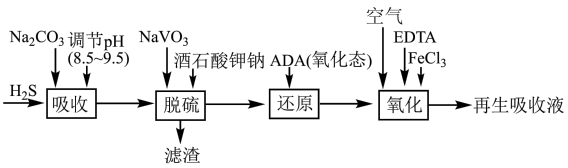
ii.酒石酸钾钠、EDTA可分别与V4+、Fe3+形成可溶性配合物。
(1)“吸收”时,发生反应的离子方程式为
(2)“脱硫”时,NaVO3先转化为Na2V4O9同时可得到S,则该转化过程反应的化学方程式为
(3)“还原”时,氧化态ADA(
 )转化为还原态ADA(
)转化为还原态ADA( ),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为
),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为(4)“氧化”时,ADA(还原态)
 ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是
ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是(5)“再生吸收液”中可循环使用的物质有
A.NaOH B.酒石酸钾钠 C.NaVO3 D.EDTA E.ADA
您最近一年使用:0次
名校
解题方法
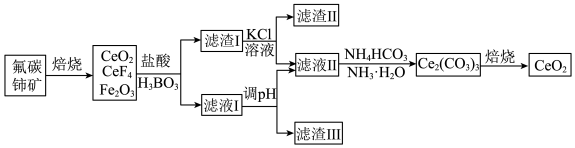
3 . 二氧化饰(CeO2)是一种重要的稀土氧化物,可以用于光催化降解有机污染物,利用氟碳饰矿(主要成分为CeCO3F,含Fe2O3、FeO等杂质)制CeOz的工艺流程如下:
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)CeCO3F中Ce元素的化合价为_______ 。
(2)焙烧氟碳铈矿时,提高焙烧效率的措施有_______ (写出两种),实验室进行焙烧操作时一般在_______ 中进行。
(3)CeCO3F在焙烧时发生反应的化学方程式为_______ 。
(4)上述流程中所加的盐酸要适当过量,其目的是_______ ,操作中可用硫酸和H2O2替换盐酸,其优点是_______ 。
(5)写出从滤液Ⅱ中沉淀铈的离子方程式:_______ 。
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)CeCO3F中Ce元素的化合价为
(2)焙烧氟碳铈矿时,提高焙烧效率的措施有
(3)CeCO3F在焙烧时发生反应的化学方程式为
(4)上述流程中所加的盐酸要适当过量,其目的是
(5)写出从滤液Ⅱ中沉淀铈的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 下列过程中的化学反应,相应的离子方程式书写正确的是
A.KClO与Fe(OH)3在碱性条件下反应制备K2FeO4:3ClO-+2Fe(OH)3=2 +3Cl-+4H++H2O +3Cl-+4H++H2O |
| B.向含lmolFeI2溶液中通入lmolCl2:2I-+Cl2=2Cl-+I2 |
C.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
D.NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性: +H++OH-+Ba2+=BaSO4↓+H2O +H++OH-+Ba2+=BaSO4↓+H2O |
您最近一年使用:0次
名校
5 . 利用高压氨浸法从黄铜矿中提取铜具有提取率高、污染小等优点,被广泛使用。一种由黄铜矿(主要成分为 ,含少量
,含少量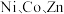 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下:
I.“固液分离”后溶液中主要离子为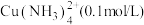 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为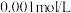 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为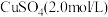 。
。
Ⅱ.不稳定常数对 ,不稳定常数
,不稳定常数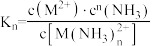
Ⅲ.溶度积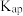
(1)基态 原子的价电子排布式为
原子的价电子排布式为________________ , 中氮原子的杂化方式为
中氮原子的杂化方式为_______________ 。
(2)①浸出前“粉碎磨矿”的目的是_______________ ,②“固液分离”用到的操作是_______________ 。
(3)①“搅拌浸出”主要成分反应的化学方程式为______________ 。(已知:硫元素变成最高价,铁元素变成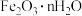 );
);
②铁元素没有以配合物离子存在的原因是__________________ 。
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为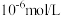 ],需调节
],需调节 至
至___________ ,“萃取”和“反萃取”的作用为________________ 。
 ,含少量
,含少量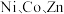 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下: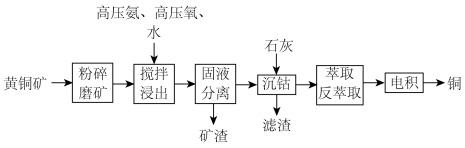
I.“固液分离”后溶液中主要离子为
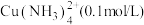 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为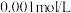 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为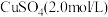 。
。Ⅱ.不稳定常数对
 ,不稳定常数
,不稳定常数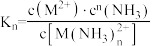
|
|
|
不稳定常数 |
| 0.2 |
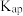
|
|
|
溶度积 |
|
|
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 中氮原子的杂化方式为
中氮原子的杂化方式为(2)①浸出前“粉碎磨矿”的目的是
(3)①“搅拌浸出”主要成分反应的化学方程式为
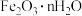 );
);②铁元素没有以配合物离子存在的原因是
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为
 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为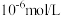 ],需调节
],需调节 至
至
您最近一年使用:0次
名校
解题方法
6 . 锰酸锂 是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。
是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。 中的三种元素位于元素周期表的共
中的三种元素位于元素周期表的共___________ 个区。
A.1 B.2 C.3
2.O元素的第一电离能比N小,但电负性却比N大,原因分别是___________ ,___________ 。
3.“酸浸”可将难溶的 转化为
转化为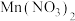 、
、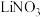 等产物。写出对应的离子方程式
等产物。写出对应的离子方程式___________
4.如果以盐酸代替 和
和 ,会产生一种有毒气体,该气体可能是
,会产生一种有毒气体,该气体可能是___________ 。(填化学式)
5.加入NaOH的目的是使得 转化为
转化为 ,过滤分离,避免后续
,过滤分离,避免后续 中混有
中混有___________ ,常温下, 的
的 是
是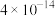 ,为使
,为使 沉淀完全(浓度
沉淀完全(浓度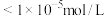 ),溶液的pH应大于
),溶液的pH应大于___________
6.过滤出的 往往用乙醇洗涤,写出用乙醇洗涤的两个优点
往往用乙醇洗涤,写出用乙醇洗涤的两个优点___________ 、___________ 。
 是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。
是Hunter在1981年首先制得的具有三维锂离子通道的正极材料,一直受到国内外很多学者及研究人员的极大关注,是目前包括特斯拉在内的一众电车使用的三元锂电池的前身,现要对其进行回收利用。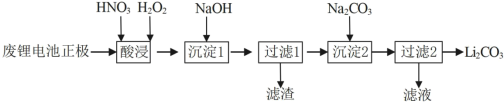
 中的三种元素位于元素周期表的共
中的三种元素位于元素周期表的共A.1 B.2 C.3
2.O元素的第一电离能比N小,但电负性却比N大,原因分别是
3.“酸浸”可将难溶的
 转化为
转化为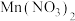 、
、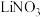 等产物。写出对应的离子方程式
等产物。写出对应的离子方程式4.如果以盐酸代替
 和
和 ,会产生一种有毒气体,该气体可能是
,会产生一种有毒气体,该气体可能是5.加入NaOH的目的是使得
 转化为
转化为 ,过滤分离,避免后续
,过滤分离,避免后续 中混有
中混有 的
的 是
是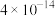 ,为使
,为使 沉淀完全(浓度
沉淀完全(浓度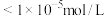 ),溶液的pH应大于
),溶液的pH应大于6.过滤出的
 往往用乙醇洗涤,写出用乙醇洗涤的两个优点
往往用乙醇洗涤,写出用乙醇洗涤的两个优点
您最近一年使用:0次
7 . 锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示:
①“浸取”时, 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。
② 时,
时, ,
, 。
。
③深度除杂标准:溶液中 ≤2.0×10-6。
≤2.0×10-6。
(1)“浸取”温度为 ,锌的浸出率可达
,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(2)“滤渣1”的主要成分为 、
、___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ 。
(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比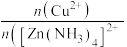 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。
①当 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是___________ (用离子方程式解释)。
②“深度除铜”时 加入量最优选择
加入量最优选择___________ (填标号)。
A.100% B.110% C.120% D.130%
(5) 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:___________ 。
②基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: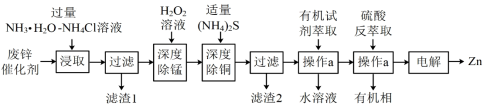
①“浸取”时,
 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。②
 时,
时, ,
, 。
。③深度除杂标准:溶液中
 ≤2.0×10-6。
≤2.0×10-6。(1)“浸取”温度为
 ,锌的浸出率可达
,锌的浸出率可达 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(2)“滤渣1”的主要成分为
 、
、(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比
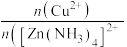 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。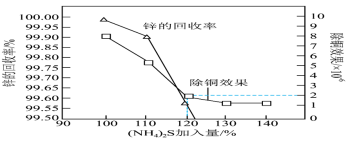
①当
 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是②“深度除铜”时
 加入量最优选择
加入量最优选择A.100% B.110% C.120% D.130%
(5)
 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:
②基态
 原子的价电子排布式为
原子的价电子排布式为
您最近一年使用:0次
解题方法
8 . 硫脲 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.
(1)仪器a的名称为__________ ;试剂X为__________ 。
(2)关闭 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为__________ 。
(3)关闭 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是__________ 。
(4)关闭 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为__________ ;为减少氧化,减压过滤和干燥时最好采用的仪器是__________ 。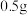 产品配成
产品配成 溶液,取
溶液,取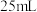 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和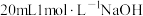 溶液,发生反应:
溶液,发生反应: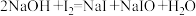 ;
;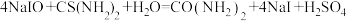 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用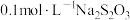 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: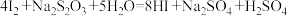 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为__________ ;粗产品中硫脲的质量分数为__________ (用含V的代数式表示)。
 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.
(1)仪器a的名称为
(2)关闭
 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为(3)关闭
 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是(4)关闭
 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
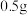 产品配成
产品配成 溶液,取
溶液,取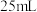 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和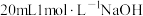 溶液,发生反应:
溶液,发生反应: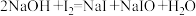 ;
;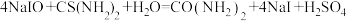 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用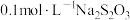 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: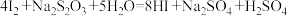 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为
您最近一年使用:0次
名校
解题方法
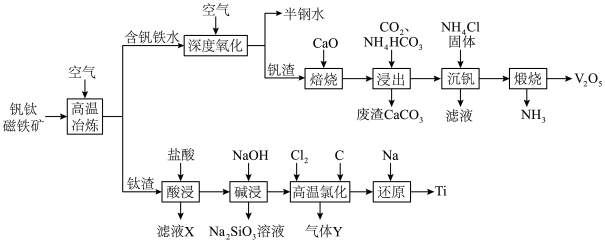
9 . 稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
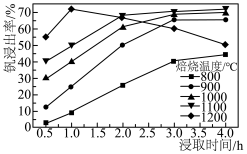
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。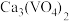 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以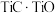 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
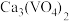 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
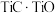 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近一年使用:0次
2024-05-16更新
|
422次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
10 . 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
1.氯离子结构示意图为___________ ,碘在元素周期表中的位置是___________ 。
2.氯气可用来制取漂白粉,漂白粉的有效成分是___________ 。
3.次氯酸钠可用于去除废水中的铵态氮,配平离子方程式并标出电子转移方向和数目。___________
___________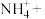 ___________
___________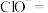 ___________
___________ ___________
___________ ___________
___________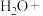 ___________
___________
1.氯离子结构示意图为
2.氯气可用来制取漂白粉,漂白粉的有效成分是
3.次氯酸钠可用于去除废水中的铵态氮,配平离子方程式并标出电子转移方向和数目。
___________
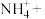 ___________
___________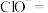 ___________
___________ ___________
___________ ___________
___________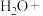 ___________
___________
您最近一年使用:0次



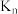 (常温)
(常温)