1 . 磁性氧化铁与过量稀硝酸反应的化学方程式为: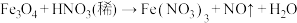 (未配平)。下列有关说法正确的是
(未配平)。下列有关说法正确的是
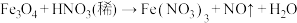 (未配平)。下列有关说法正确的是
(未配平)。下列有关说法正确的是A.上述反应配平后 的化学计量数为28 的化学计量数为28 |
| B.如果硝酸的量不足,则应该有Fe(NO3)2生成 |
C.若有 被还原,则生成2.24LNO气体 被还原,则生成2.24LNO气体 |
| D.23.2g磁性氧化铁完全溶解于稀硝酸中,转移0.2mole- |
您最近一年使用:0次
名校
2 . 铜及其化合物在生产生活有广泛应用,铜在化合物中的常见化合价有+1、+2.已知 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
(1)工业上可用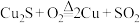 反应制取粗铜,该反应中
反应制取粗铜,该反应中___________ 元素被还原。不考虑杂质的反应,理论上生成1mol的 电子转移的数目为
电子转移的数目为___________
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为___________ 。温度控制在50~60℃的原因除了加快反应速率外,还有___________ 。在 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:___________ 。
(3)现向Cu、 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为___________ 。若将上述混合物用足量的 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为___________ g。若上述混合物中含0.2mol Cu,将该混合物与稀硫酸充分反应,消耗 的物质的量为
的物质的量为___________ mol。
 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。(1)工业上可用
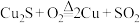 反应制取粗铜,该反应中
反应制取粗铜,该反应中 电子转移的数目为
电子转移的数目为(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入
 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:(3)现向Cu、
 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为 的物质的量为
的物质的量为
您最近一年使用:0次
名校
3 . 废旧磷酸铁锂电池中电极片主要由 、铝箔、少量铜及炭黑组成,回收
、铝箔、少量铜及炭黑组成,回收 、
、 的具体流程如下:
的具体流程如下: 溶于酸,不溶于碱;
溶于酸,不溶于碱; 、
、 在常温下的溶解度分别为
在常温下的溶解度分别为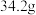 、
、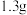 。
。
下列说法错误的是
 、铝箔、少量铜及炭黑组成,回收
、铝箔、少量铜及炭黑组成,回收 、
、 的具体流程如下:
的具体流程如下: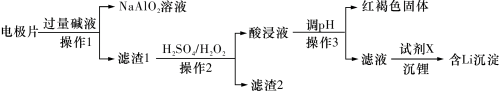
 溶于酸,不溶于碱;
溶于酸,不溶于碱; 、
、 在常温下的溶解度分别为
在常温下的溶解度分别为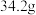 、
、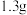 。
。下列说法错误的是
A. 中基态亚铁离子的电子排布式: 中基态亚铁离子的电子排布式: |
B.滤渣1中加入 和 和 可发生反应: 可发生反应: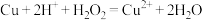 |
C.“调 ”和“沉锂”两个步骤都可以使用 ”和“沉锂”两个步骤都可以使用 ,但试剂的作用不同 ,但试剂的作用不同 |
| D.甲烷和三氧化硫都是由极性键构成的非极性分子 |
您最近一年使用:0次
2024-05-06更新
|
105次组卷
|
3卷引用:湖南省长沙市第一中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
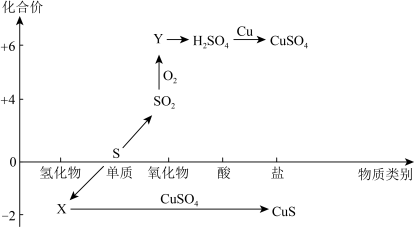
4 . 硫及其化合物的“价-类”二维图如下图所示,回答下列问题:___________ ,Y的化学式是___________ 。
(2)检验 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入___________ ,无明显现象,再加入___________ 溶液,若产生白色沉淀,则溶液中含有 。
。
(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。
①请用“双线桥”法标明该反应电子转移的方向和数目___________ 。
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为___________ L。
(2)检验
 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入 。
。(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓)
 CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。①请用“双线桥”法标明该反应电子转移的方向和数目
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为
您最近一年使用:0次
5 . 实验室模拟“高炉煤气”(主要成分为: 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体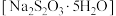 ,其部分实验过程如下:
,其部分实验过程如下: 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: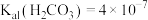 ,
,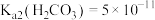 ;
;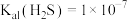 ,
,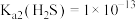 ;
;
(1)用70%硫酸和亚硫酸钠固体制取 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是___________ 。
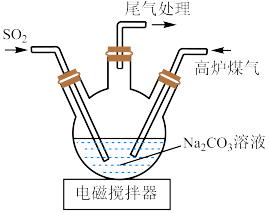
(2)三颈烧瓶中制取 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。
① 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: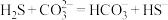 。该反应的平衡常数
。该反应的平衡常数
___________ 。
②写出三颈烧瓶中得到 的化学方程式
的化学方程式___________ 。
(3)尾气中含有大量 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为: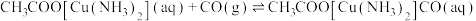
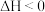
①研究发现尾气中过量 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是___________ 。
②写出吸收液再生的一种方法:___________ ,同时释放 ,达到资源化利用。
,达到资源化利用。
(4) 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: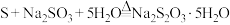 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取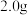 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中,___________ 。(实验中还需要使用的试剂有:乙醇、蒸馏水。)已知: 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:
 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体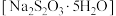 ,其部分实验过程如下:
,其部分实验过程如下: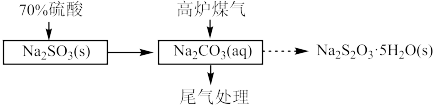
 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: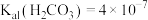 ,
,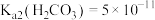 ;
;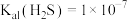 ,
,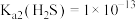 ;
;(1)用70%硫酸和亚硫酸钠固体制取
 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是(2)三颈烧瓶中制取
 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。①
 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: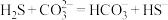 。该反应的平衡常数
。该反应的平衡常数
②写出三颈烧瓶中得到
 的化学方程式
的化学方程式(3)尾气中含有大量
 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为: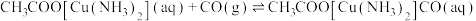
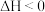
①研究发现尾气中过量
 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是②写出吸收液再生的一种方法:
 ,达到资源化利用。
,达到资源化利用。(4)
 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: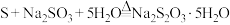 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取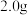 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中, 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:| 温度/℃ | 0 | 10 | 20 | 30 | 40 |
| 溶解度/g | 50.2 | 59.7 | 70.1 | 83.2 | 104 |
您最近一年使用:0次
6 . 金属 可以在高温条件下还原
可以在高温条件下还原 制备熔点较高金属
制备熔点较高金属 ,金属
,金属 是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原
是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原 制备金属
制备金属 ,工艺流程如图。下列说法
,工艺流程如图。下列说法不正确 的是
 可以在高温条件下还原
可以在高温条件下还原 制备熔点较高金属
制备熔点较高金属 ,金属
,金属 是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原
是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原 制备金属
制备金属 ,工艺流程如图。下列说法
,工艺流程如图。下列说法
A.工业上可通过电解熔融 制取金属 制取金属 |
B.用金属 还原 还原 过程中需要通入 过程中需要通入 作保护气 作保护气 |
C.“真空蒸馏”的目的是使 、 、 气化,实现与 气化,实现与 的分离 的分离 |
D.制得海绵针中含有少量金属 ,可以用稀盐酸浸泡除 ,可以用稀盐酸浸泡除 |
您最近一年使用:0次
名校
解题方法
7 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入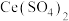 与
与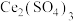 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=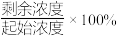 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。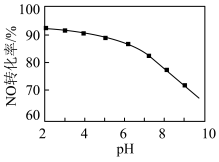
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入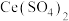 与
与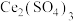 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。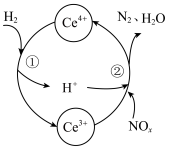
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=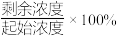 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是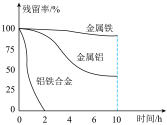
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为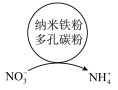
您最近一年使用:0次
2024-05-06更新
|
169次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
8 . 我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),请回答下列问题:
(1)肼又名联氨,其结构式为_____ 。
(2)液态肼与过氧化氢的反应属于_____ (填“吸热”或“放热”)反应。
(3)写出该火箭推进器中相关反应的化学方程式:_____ 。
(4)在一定温度下,向0.5L密闭容器中充入2molN2H4和2molO2发生如下反应:N2H4(g)+O2(g)⇌N2(g)+2H2O(g),其中有关物质的物质的量随时间变化的曲线如图所示,请回答下列问题:_____
②下列能说明该反应达到平衡状态的是_____ 。
A.υ正(N2)=2υ逆(H2O)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.体系的压强不再发生变化
D.混合气体的密度不再发生变化
E.每断开1molO=O键,同时断开4molH-O键
③该反应达到平衡时,O2的体积百分数为_____ (结果保留一位小数)
④下列措施能够增大正反应的化学反应速率的有( )
A.升高反应温度 B.加入适当的催化剂C.向容器中加入氧气 D.向容器中加入氖气
(5)广泛应用的肼(N2H4)燃料电池属于环境友好型电池,该电池以空气中的氧气作氧化剂,氢氧化钠溶液作电解质,其负极的电极方程式:_____
(1)肼又名联氨,其结构式为
(2)液态肼与过氧化氢的反应属于
(3)写出该火箭推进器中相关反应的化学方程式:
(4)在一定温度下,向0.5L密闭容器中充入2molN2H4和2molO2发生如下反应:N2H4(g)+O2(g)⇌N2(g)+2H2O(g),其中有关物质的物质的量随时间变化的曲线如图所示,请回答下列问题:
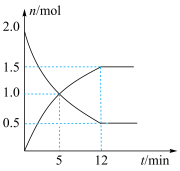
②下列能说明该反应达到平衡状态的是
A.υ正(N2)=2υ逆(H2O)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.体系的压强不再发生变化
D.混合气体的密度不再发生变化
E.每断开1molO=O键,同时断开4molH-O键
③该反应达到平衡时,O2的体积百分数为
④下列措施能够增大正反应的化学反应速率的有
A.升高反应温度 B.加入适当的催化剂C.向容器中加入氧气 D.向容器中加入氖气
(5)广泛应用的肼(N2H4)燃料电池属于环境友好型电池,该电池以空气中的氧气作氧化剂,氢氧化钠溶液作电解质,其负极的电极方程式:
您最近一年使用:0次
名校
9 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
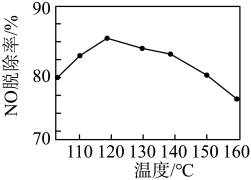
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近一年使用:0次
名校
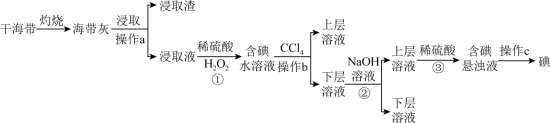
10 . 浩瀚的海洋里蕴藏着丰富的化学资源,从海带中提取碘单质的工艺流程如图。回答下列问题:_______ (填仪器名称)中,用酒精灯充分加热灰化。
(2)浸取液中碘主要以 存在,写出①发生反应的离子方程式
存在,写出①发生反应的离子方程式_______ ,实验步骤①后若检验溶液中碘单质的存在,具体方法是_______ 。
(3)向含有 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象
振荡静置后的实验现象_______ 。
(4)步骤②中加入浓 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为_______ ,步骤③反应中氧化剂与还原剂物质的量之比为_______ 。
(5)步骤②③是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为_______ 法。
(6)操作c的名称为_______ 。
(2)浸取液中碘主要以
 存在,写出①发生反应的离子方程式
存在,写出①发生反应的离子方程式(3)向含有
 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象
振荡静置后的实验现象(4)步骤②中加入浓
 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为(5)步骤②③是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为
(6)操作c的名称为
您最近一年使用:0次



