名校
1 . 某工业废催化剂主要成份为: 和
和 ,还有少量的
,还有少量的 和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示:
和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示:_______ (填化学式)。
(2)水浸渣的主要成份是_______ (填化学式)。
(3)“沉淀”的化学式_______ 。生成该沉淀的化学方程式_______ 。
(4)“沉钒”中需要加入过量的浓 ,结合离子方程式说明原因是
,结合离子方程式说明原因是_______ 。写出生成 的化学方程式
的化学方程式_______ 。
(5)淀粉水解液中_______ (填化学式)起还原作用,用焦亚硫酸钠( )溶液代替淀粉水解液效果相同,写出反应的离子方程式
)溶液代替淀粉水解液效果相同,写出反应的离子方程式_______ 。
(6)利用生物燃料电池原理研究室温下氨的合成,电池工作时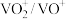 在电极与酶之间传递电子,示意图如图所示。
在电极与酶之间传递电子,示意图如图所示。
_______ mol。
 和
和 ,还有少量的
,还有少量的 和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示:
和FeO,利用该废催化剂回收Cr和V的简化工业流程如下图所示: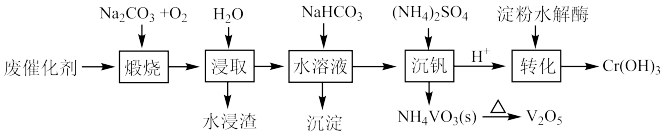
(2)水浸渣的主要成份是
(3)“沉淀”的化学式
(4)“沉钒”中需要加入过量的浓
 ,结合离子方程式说明原因是
,结合离子方程式说明原因是 的化学方程式
的化学方程式(5)淀粉水解液中
 )溶液代替淀粉水解液效果相同,写出反应的离子方程式
)溶液代替淀粉水解液效果相同,写出反应的离子方程式(6)利用生物燃料电池原理研究室温下氨的合成,电池工作时
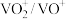 在电极与酶之间传递电子,示意图如图所示。
在电极与酶之间传递电子,示意图如图所示。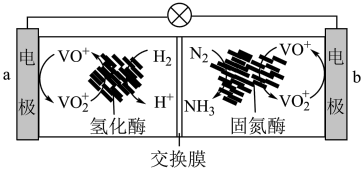
您最近一年使用:0次
解题方法
2 . 选择性催化还原(SCR)脱硝技术可用于减少工业生产中氮氧化物( )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:
Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
(1)反应

___________ ,副反应化学方程式为___________ 。
(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图:___________ ,应选择的最佳催化剂为___________ ,选用合适的催化剂还能抑制催化剂表面出现铵盐结晶现象,结晶会导致___________ 。
Ⅱ.H2―SCR技术
主反应: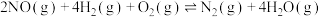
副反应:
(3)恒温下,向容积为1L的容器中充入2mol NO、4mol 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的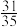 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为___________ ,主反应的
___________ (列出计算式即可)。
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:___________ ,随着电流强度的增大,电解NaCl溶液时NO去除率下降的原因是___________ 。
 )的排放量,主要技术原理如下,回答下列问题:
)的排放量,主要技术原理如下,回答下列问题:Ⅰ.CO―SCR技术
使用某催化剂时,反应机理如下表:
| 反应方程式 | 反应热 | |
| 吸附过程 | 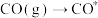 |  |
 |  | |
| 解离过程 |  |  |
| 缔结过程 | 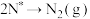 |  |
 |  | |
 | 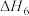 |
(1)反应


(2)将含NO的尾气按一定流速通到不同催化剂表面,不同温度下在气体出口处测得NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图:
的生成量随温度变化关系如下图: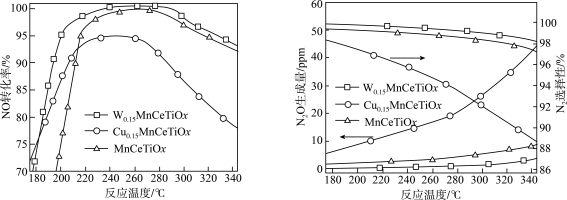
Ⅱ.H2―SCR技术
主反应:
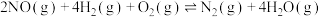
副反应:

(3)恒温下,向容积为1L的容器中充入2mol NO、4mol
 、1mol
、1mol ,发生主、副反应,达到平衡后,测得压强为初始压强的
,发生主、副反应,达到平衡后,测得压强为初始压强的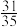 ,且
,且 与
与 的体积分数相等,NO的转化率为
的体积分数相等,NO的转化率为
(4)除以上技术外,还可用电解纸化吸收法将工业尾气中的
 转变为
转变为 。向
。向 NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
NaCl溶液(起始pH调至9)中通入NO,测得电流强度与NO的去除率的关系如图甲所示,溶液中相关成分的浓度变化与电流强度的关系如图乙所示:
您最近一年使用:0次
解题方法
3 . 以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如下。下列说法不正确的是
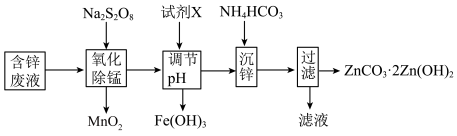
(已知:过二硫酸根的结构式:  )
)
| A.过二硫酸钠(Na2S2O8)中硫的化合价为+7价 |
B.氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、SO |
| C.调节pH时试剂X可以选用ZnO、ZnCO3等物质 |
D.氧化除锰过程中生成MnO2的离子方程:Mn2++S2O +2H2O=MnO2↓+2SO +2H2O=MnO2↓+2SO +4H+ +4H+ |
您最近一年使用:0次
4 . 下列离子方程式正确的是
A.酸性高锰酸钾溶液中滴双氧水褪色:2MnO +7H2O2+6H+=2Mn2++10H2O+6O2↑ +7H2O2+6H+=2Mn2++10H2O+6O2↑ |
| B.向红色Fe(SCN)3溶液中加入过量铁粉:2Fe3++Fe=3Fe2+ |
| C.氯化银中滴加浓氨水:2NH3+AgCl=Ag(NH3)2Cl |
D.明矾溶液中加入过量NaOH溶液:Al3++4OH-=AlO +2H2O +2H2O |
您最近一年使用:0次
解题方法
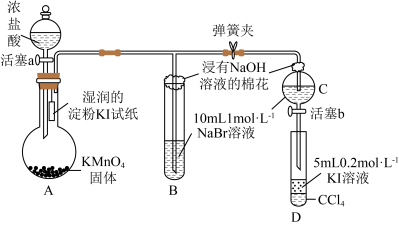
5 . 为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
② 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为___________ 。
(2)A装置中制备氯气的离子方程式为___________ ,HCl的作用是做___________ 。
(3)B装置中主要反应的化学方程式为___________ 。
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是___________ 。
(5)过程③的实验目的是___________ 。
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:___________ 。
(7)下列事实能说明元素Y的非金属性比硫元素强的是___________ 。
a.Y单质通入 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊
b.与 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多
c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
②
 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为
(2)A装置中制备氯气的离子方程式为
(3)B装置中主要反应的化学方程式为
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是
(5)过程③的实验目的是
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:
(7)下列事实能说明元素Y的非金属性比硫元素强的是
a.Y单质通入
 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊b.与
 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
您最近一年使用:0次
名校
6 . 铬酸铅(PbCrO4)是黄色涂料“铬黄”的主要成分,实验室由某合金废料(主要成分为Fe、C、Cr2O3)制备PbCrO4的流程如图:
回答下列问题:
(1)基态82Pb2+的价层电子排布图为_______ 。
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是_______ (用化学方程式解释)。
(3)“滤渣2”中电负性最大的元素是_______ (填元素符号)。
(4)“氧化”时发生反应的离子方程式为_______ 。
(5)“调节pH=6”的目的是_______ 。
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
①结合PbX2的熔点变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ (填“增强”“不变”或“减弱”,后同)、共价性_______ 。
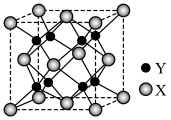
②PbF2的立方晶胞如图所示,其中X代表的离子是_______ (填离子符号);若该晶胞参数为anm,则正、负离子的最小核间距为_______ pm。
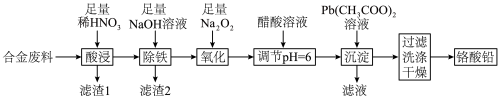
回答下列问题:
(1)基态82Pb2+的价层电子排布图为
(2)“酸浸”时,加热可以加快反应速率,但温度不宜过高的原因是
(3)“滤渣2”中电负性最大的元素是
(4)“氧化”时发生反应的离子方程式为
(5)“调节pH=6”的目的是
(6)二卤化铅(PbX2)是一类重要的含铅化合物,其熔点如下表所示:
| 二卤化铅 | PbF2 | PbCl2 | PbBr2 | PbI2 |
| 熔点/℃ | 824 | 501 | 373 | 402 |
②PbF2的立方晶胞如图所示,其中X代表的离子是
您最近一年使用:0次
2024-05-12更新
|
151次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
7 . 下列化学方程式或离子方程式正确的是
A.工业上制备粗硅: |
B.醋酸除水壶的水垢: |
C.少量 与 与 溶液反应: 溶液反应: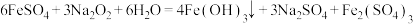 |
D.实验室制备氨气: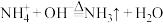 |
您最近一年使用:0次
8 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: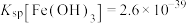 ,
, .
.
(1)“磨细”过程的目的是____________ .
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为____________ .
(3)“滤渣2”主要成分为______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为____________ .
(5)“酸溶1”过程用 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性____________ 。
(6)“焙烧”过程发生反应的化学方程式为____________ 。
(7)已知当 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为______ 。
(8)“操作X”采用的结晶方法为______ 。
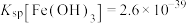 ,
, .
.(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为(8)“操作X”采用的结晶方法为
您最近一年使用:0次
9 . I.材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于传统硅酸盐产品的是_______ (填写序号)
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于_______ (填“纯净物”或“混合物”)。制造玻璃的原料_______ 、_______ 、_______ 。雕花玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式_______ 。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_______ 反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_______ 。
Ⅱ.目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(4)请写出上述反应的化学方程式:_______ 。(需配平)
(5)分析上述反应_______ (是或否)为氧化还原反应。如果是,指出反应中的氧化剂和还原剂,如果不是,说明原因_______ 。
(1)硅酸盐材料是重要的传统无机非金属材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于传统硅酸盐产品的是
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的
Ⅱ.目前,汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(4)请写出上述反应的化学方程式:
(5)分析上述反应
您最近一年使用:0次
名校
解题方法
10 . 重铬酸钾是一种用途广泛的化合物。工业上以铬铁矿[主要成分为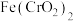 ,还含有
,还含有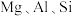 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾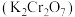 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题: 和
和 。
。
(1)焙烧”时将铬铁矿粉碎的目的是_______ ,滤渣I中能提炼出一种红色油漆颜料,则焙烧时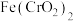 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤渣Ⅱ的主要成分是_______ 。
(3)“除杂”时需加热,其目的是_______ 。
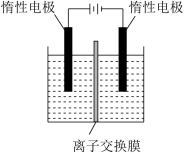
(4)“电解”是利用膜电解技术(装置如图所示),将 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为_______ 。
(5)加入饱和 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是_______ 。
(6)该流程中,能循环利用的物质有_______ (填化学式)。
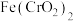 ,还含有
,还含有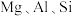 等的氧化物]为主要原料制备重铬酸钾
等的氧化物]为主要原料制备重铬酸钾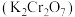 的一种工艺流程如图。回答下列问题:
的一种工艺流程如图。回答下列问题:
 和
和 。
。(1)焙烧”时将铬铁矿粉碎的目的是
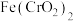 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅱ的主要成分是
(3)“除杂”时需加热,其目的是
(4)“电解”是利用膜电解技术(装置如图所示),将
 转化为
转化为 。阳极池发生反应的总的离子方程式为
。阳极池发生反应的总的离子方程式为
(5)加入饱和
 溶液后蒸发结晶,能得到
溶液后蒸发结晶,能得到 的原因是
的原因是(6)该流程中,能循环利用的物质有
您最近一年使用:0次



