名校
解题方法
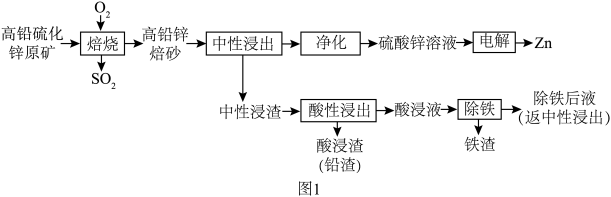
1 . 从高铅硫化锌原矿(主要成分为ZnS、PbS、FeS2、ZnCO3)中提取有价金属的工艺流程如图1所示。回答下列问题:___________ (填一条)。
(2)硫化锌的“焙烧”过程中,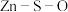 系在温度为1100K下的
系在温度为1100K下的 [
[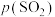 、
、 分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。
分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。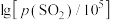 、
、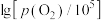 均为-5时,含锌产物为
均为-5时,含锌产物为___________ (填化学式)。
②一定条件下,焙烧过程中A点ZnS发生反应的化学方程式为___________ 。
③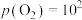 kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为
kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为___________ (填“降低SO2的分压”或“升高SO2的分压”)。
(3)“中性浸渣”中含有ZnO、PbO、Fe2O3。
①“酸性浸出”时加入的酸是___________ (填化学式,下同)。
②“除铁后液”的主要溶质为___________ 。
③“除铁”过程:先加入ZnS将Fe3+还原为Fe2+,再加入ZnO并通入O2,将其转化为FeOOH.若1 molFe2+转化为FeOOH,则在标准状况下消耗___________ LO2。
(4)“电解”时电极均为Pt极,则阳极反应式为___________ 。
(2)硫化锌的“焙烧”过程中,
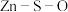 系在温度为1100K下的
系在温度为1100K下的 [
[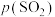 、
、 分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。
分别为平衡时两种物质的分压]的等温平衡状态图如图2所示。 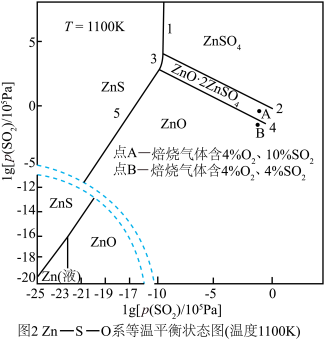
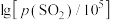 、
、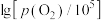 均为-5时,含锌产物为
均为-5时,含锌产物为②一定条件下,焙烧过程中A点ZnS发生反应的化学方程式为
③
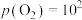 kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为
kPa时,若要使ZnSO4转化成更多的ZnO,需进行的操作为(3)“中性浸渣”中含有ZnO、PbO、Fe2O3。
①“酸性浸出”时加入的酸是
②“除铁后液”的主要溶质为
③“除铁”过程:先加入ZnS将Fe3+还原为Fe2+,再加入ZnO并通入O2,将其转化为FeOOH.若1 molFe2+转化为FeOOH,则在标准状况下消耗
(4)“电解”时电极均为Pt极,则阳极反应式为
您最近一年使用:0次
名校
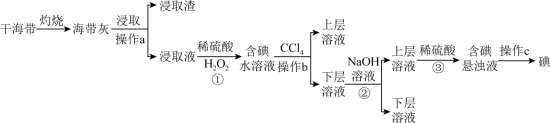
2 . 浩瀚的海洋里蕴藏着丰富的化学资源,从海带中提取碘单质的工艺流程如图。回答下列问题:_______ (填仪器名称)中,用酒精灯充分加热灰化。
(2)浸取液中碘主要以 存在,写出①发生反应的离子方程式
存在,写出①发生反应的离子方程式_______ ,实验步骤①后若检验溶液中碘单质的存在,具体方法是_______ 。
(3)向含有 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象
振荡静置后的实验现象_______ 。
(4)步骤②中加入浓 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为_______ ,步骤③反应中氧化剂与还原剂物质的量之比为_______ 。
(5)步骤②③是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为_______ 法。
(6)操作c的名称为_______ 。
(2)浸取液中碘主要以
 存在,写出①发生反应的离子方程式
存在,写出①发生反应的离子方程式(3)向含有
 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象
振荡静置后的实验现象(4)步骤②中加入浓
 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为(5)步骤②③是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为
(6)操作c的名称为
您最近一年使用:0次
名校
解题方法
3 . 金属镓( )是合成半导体材料砷化镓(
)是合成半导体材料砷化镓( )的重要基础材料,一种由砷化镓废料(主要成分
)的重要基础材料,一种由砷化镓废料(主要成分 ,含
,含 、
、 等杂质)制备镓的实验流程如下。
等杂质)制备镓的实验流程如下。
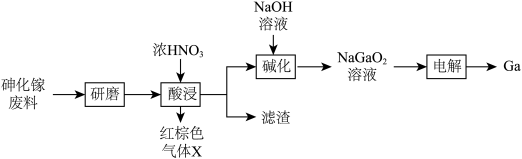
已知:
i. 和
和 位于同一主族,性质相似。
位于同一主族,性质相似。
ii. 难溶于水。
难溶于水。
(1)“研磨”的目的是_______ 。
(2)“滤渣”的主要成分是_______ (填化学式)。
(3)写出“酸浸”过程发生反应的化学方程式_______ 。若取A、B两组样品分别进行实验,“酸浸”时向A中不断通入 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
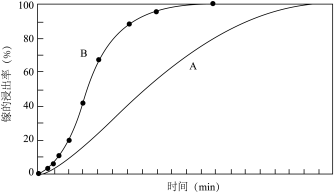
浸出速率A____ B(填>、=或<),推测A、B曲线变化的原因是______ 。
(4)“碱化”时发生反应的离子方程式为_______ 。
 )是合成半导体材料砷化镓(
)是合成半导体材料砷化镓( )的重要基础材料,一种由砷化镓废料(主要成分
)的重要基础材料,一种由砷化镓废料(主要成分 ,含
,含 、
、 等杂质)制备镓的实验流程如下。
等杂质)制备镓的实验流程如下。
已知:
i.
 和
和 位于同一主族,性质相似。
位于同一主族,性质相似。ii.
 难溶于水。
难溶于水。(1)“研磨”的目的是
(2)“滤渣”的主要成分是
(3)写出“酸浸”过程发生反应的化学方程式
 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
浸出速率A
(4)“碱化”时发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 某小组为探究含硫化合物(NH4)2S2O8的性质,设计如下实验探究(NH4)2S2O8的氧化性。实验操作:向小试管中加入2mL0.2mol/LKI溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量0.2mol/L(NH4)2S2O8溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1)(NH4)2S2O8与KI反应的离子方程式为___________ 。
已知:I2可与S2O 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:
(2)上述实验Ⅱ中的V1=___________ ;V2=___________ 。
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
(3)验证猜想1的实验设计为___________ (填“实验Ⅲ”或“实验Ⅳ”下同)。
(4)实验Ⅲ中下层溶液显浅紫色的原因为___________ 。
(5)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 。
。(1)(NH4)2S2O8与KI反应的离子方程式为
已知:I2可与S2O
 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:| 试验编号 | 0.2mol/LKI溶液/mL | 0.01mol/LNa2S2O3溶液/mL | 蒸馏水/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 变色时间/s |
| Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| Ⅱ | 4.0 | 1.0 | V1 | 2 | V2 | 30 |
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
| 试验编号 | 0.2mol/LKI溶液/mL | 0.001mol/L碘水/mL | 0.01mol/LNa2S2O3溶液/mL | CCl4/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 实验现象 |
| Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(4)实验Ⅲ中下层溶液显浅紫色的原因为
(5)由上述实验可知
您最近一年使用:0次
解题方法
5 . 稀土针铁硼永磁材料广泛应用于新能源汽车、节能环保家电、国防军事等工业领域。工业上以钕铁硼废料[含钕( ,质量分数为
,质量分数为 )、
)、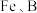 ]为主要原料回收高纯度钕的工艺流程如下。
]为主要原料回收高纯度钕的工艺流程如下。
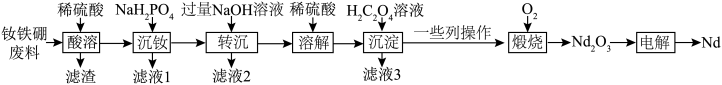
已知:① 的稳定价态为
的稳定价态为 价;
价; 的活动性较强,与稀硫酸反应产生
的活动性较强,与稀硫酸反应产生 ;硼难溶于稀硫酸。钕离子可与过量
;硼难溶于稀硫酸。钕离子可与过量 生成可溶性配合物;
生成可溶性配合物;
②常温下,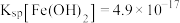 。回答下列问题:
。回答下列问题:
(1)常温下,“沉钕”过程中调节溶液的 为2.3,钕全部以
为2.3,钕全部以 沉淀完全。若溶液中
沉淀完全。若溶液中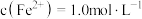 ,
,_____ (填“有”或“无”) 沉淀生成;酸性太强会使“沉钕”不完全,原因是
沉淀生成;酸性太强会使“沉钕”不完全,原因是_____ 。
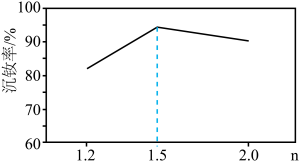
(2)“沉淀”过程得到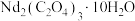 晶体。此过程中,草酸实际用量与理论计算量的比值
晶体。此过程中,草酸实际用量与理论计算量的比值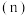 和沉钕率的关系如图所示,对沉钕率变化趋势进行解释:
和沉钕率的关系如图所示,对沉钕率变化趋势进行解释:_____ 。
(3)“滤液2”的溶质主要为_____ (填化学式);“滤液3”中的_____ (填化学式)可在上述流程中循环利用。
(4)“一系列操作”包括_____ ;空气中“煅烧”时生成无毒的气体,反应的化学方程式为_____ 。
 ,质量分数为
,质量分数为 )、
)、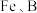 ]为主要原料回收高纯度钕的工艺流程如下。
]为主要原料回收高纯度钕的工艺流程如下。
已知:①
 的稳定价态为
的稳定价态为 价;
价; 的活动性较强,与稀硫酸反应产生
的活动性较强,与稀硫酸反应产生 ;硼难溶于稀硫酸。钕离子可与过量
;硼难溶于稀硫酸。钕离子可与过量 生成可溶性配合物;
生成可溶性配合物;②常温下,
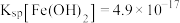 。回答下列问题:
。回答下列问题:
(1)常温下,“沉钕”过程中调节溶液的
 为2.3,钕全部以
为2.3,钕全部以 沉淀完全。若溶液中
沉淀完全。若溶液中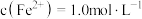 ,
, 沉淀生成;酸性太强会使“沉钕”不完全,原因是
沉淀生成;酸性太强会使“沉钕”不完全,原因是(2)“沉淀”过程得到
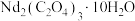 晶体。此过程中,草酸实际用量与理论计算量的比值
晶体。此过程中,草酸实际用量与理论计算量的比值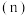 和沉钕率的关系如图所示,对沉钕率变化趋势进行解释:
和沉钕率的关系如图所示,对沉钕率变化趋势进行解释:(3)“滤液2”的溶质主要为
(4)“一系列操作”包括
您最近一年使用:0次
名校
解题方法
6 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: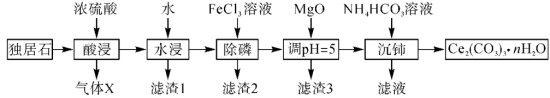
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
2024-03-03更新
|
151次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
7 . 我国力争实现2030年前“碳达峰”、2060年前“碳中和”的目标,二氧化碳的捕捉与封存是目标实现的重要途径。回答下列问题:
I.常温下,某同学用 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
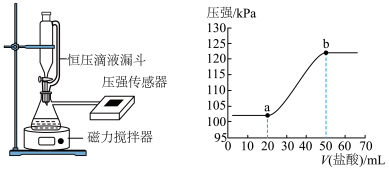
(1) 段反应的离子方程式为
段反应的离子方程式为___________ 。
(2)所得溶液的溶质成分为___________ (填化学式), 溶液的浓度为
溶液的浓度为___________  。
。
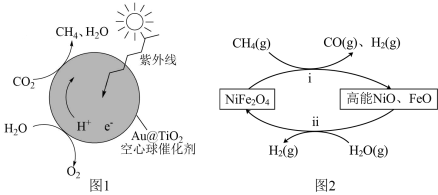
Ⅱ.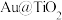 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
(3)图1中 为
为___________ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”),空心球催化过程的总反应方程式为___________ 。
(4)图2第i步反应转移 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为___________  ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则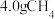 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为___________  。
。
I.常温下,某同学用
 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
(1)
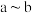 段反应的离子方程式为
段反应的离子方程式为(2)所得溶液的溶质成分为
 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
(3)图1中
 为
为(4)图2第i步反应转移
 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为 ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则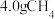 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
名校
8 . 一种制取电池级二氧化锰的工艺流程如下图:
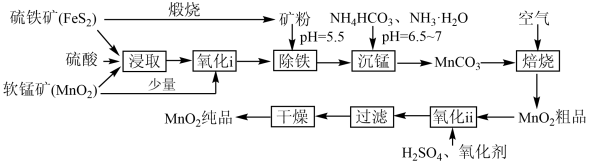
回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式___________ 。
(2)“氧化i”过程软锰矿的作用是___________ 。“氧化ⅱ”过程中,将Mn(Ⅱ)转化为Mn(Ⅳ)的最适宜氧化剂是___________ (填标号)。
a. b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液
与水形成的浊液 为9,若忽略
为9,若忽略 的第二步水解,则
的第二步水解,则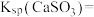
___________ (保留三位有效数字)[已知:室温下亚硫酸( )的电离平衡常数
)的电离平衡常数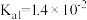 ,
,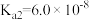 ]
]
(4)“沉锰”过程 转化为
转化为 的离子方程式为
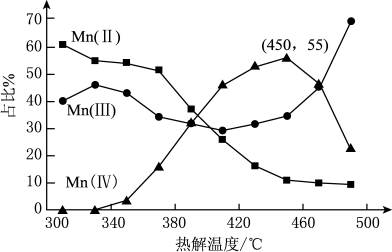
的离子方程式为___________ 。在一定空气流速下,相同时间内“焙烧” ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①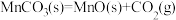
②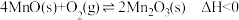
③
为了增大产物中 的占比,可以采用的措施是
的占比,可以采用的措施是___________ (答出两条)。
(5)用氧化还原法测定 样品纯度(杂质不参与下列反应):称取
样品纯度(杂质不参与下列反应):称取 样品
样品 ,试样经过过氧化钠碱熔后,得到
,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 过滤除去
过滤除去 ,用
,用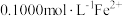 标准溶液滴定
标准溶液滴定 ,用去
,用去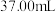 ,则样品中
,则样品中 的质量分数为
的质量分数为___________ (保留3位有效数字)。

回答下列问题:
(1)“浸取”过程有硫单质生成,写出该过程中主要反应的化学方程式
(2)“氧化i”过程软锰矿的作用是
a.
 b.
b. c.
c.
(3)工业上煅烧硫铁矿产生的
 气体可以用石灰乳吸收。常温下,测得
气体可以用石灰乳吸收。常温下,测得 与水形成的浊液
与水形成的浊液 为9,若忽略
为9,若忽略 的第二步水解,则
的第二步水解,则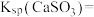
 )的电离平衡常数
)的电离平衡常数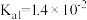 ,
,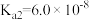 ]
](4)“沉锰”过程
 转化为
转化为 的离子方程式为
的离子方程式为 ,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
,产物中不同价态Mn的占比随热解温度的变化如图。“焙烧”过程中涉及如下化学反应:
①
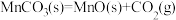
②
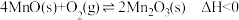
③

为了增大产物中
 的占比,可以采用的措施是
的占比,可以采用的措施是(5)用氧化还原法测定
 样品纯度(杂质不参与下列反应):称取
样品纯度(杂质不参与下列反应):称取 样品
样品 ,试样经过过氧化钠碱熔后,得到
,试样经过过氧化钠碱熔后,得到 溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时
溶液,配成溶液经加热煮沸除去过氧化物,酸化溶液,此时 歧化为
歧化为 和
和 过滤除去
过滤除去 ,用
,用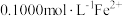 标准溶液滴定
标准溶液滴定 ,用去
,用去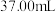 ,则样品中
,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
9 . 在如图所示的物质转化关系中。C、G、I、M为常见单质,G和M化合可生成最常见液体A,E为黑色粉末,F中含有钠元素,K为一种含有铁元素的白色沉淀,N为红褐色絮状沉淀,I为黄绿色气体,化合物B的摩尔质量为24 。(部分生成物和反应条件未列出)
。(部分生成物和反应条件未列出)

(1)M的化学式为___________ 。
(2)B的化学式为___________ 。
(3)反应②的化学方程式为___________ 。
(4)反应③的化学方程式为___________ 。
(5)C和A的蒸气在高温下反应的化学方程式为___________ ,点燃该反应产生的气体前,则必须对该气体进行___________ 。
 。(部分生成物和反应条件未列出)
。(部分生成物和反应条件未列出)
(1)M的化学式为
(2)B的化学式为
(3)反应②的化学方程式为
(4)反应③的化学方程式为
(5)C和A的蒸气在高温下反应的化学方程式为
您最近一年使用:0次
2023-12-24更新
|
156次组卷
|
2卷引用:山东省菏泽市曹县第一中学2023-2024学年高一上学期 月考化学试题
解题方法
10 . 稀土在电子材料、磁体、催化剂等方面的应用非常广泛。现以氟碳铈矿(含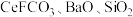 等)为原料制备氧化铈
等)为原料制备氧化铈 ,并测定其纯度。工艺流程如下:
,并测定其纯度。工艺流程如下:
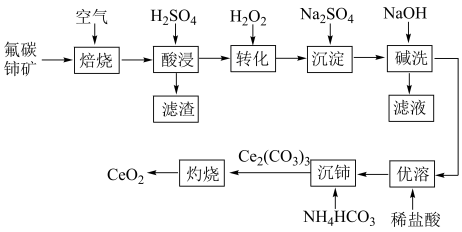
已知:
①盐酸优溶法是稀土生产工艺中的一种常用方法:
②沉淀时发生的主要反应为 ;
;
请回答下列问题:
(1)“滤渣”的成分是___________ 。
(2)稀土“酸浸”时,稀土的浸出率和酸度、温度有关,如图所示,应选择的适宜的条件为___________ 。

(3)“转化”时发生反应的离子方程式为___________ 。
(4)洗涤 沉淀时,通常用含
沉淀时,通常用含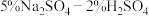 热液洗涤
热液洗涤 次,其主要目的为
次,其主要目的为___________ 。
(5)研究发现在空气中加热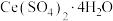 [摩尔质量:
[摩尔质量: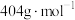 ]也可以得到
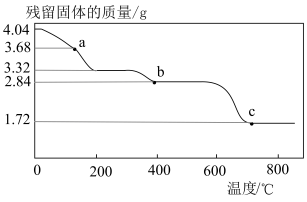
]也可以得到 ,准确称取
,准确称取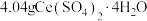 样品,在空气中进行加热,残留固体的质量随温度的变化如图所示,则固体成分为
样品,在空气中进行加热,残留固体的质量随温度的变化如图所示,则固体成分为 的点为
的点为___________ 。
(6)取所得产品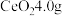 ,用高氯酸和磷酸混合液加热溶解后,用
,用高氯酸和磷酸混合液加热溶解后,用 硫酸亚铁铵
硫酸亚铁铵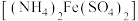 溶液滴定,滴定时发生的反应为
溶液滴定,滴定时发生的反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液
,达到滴定终点时消耗硫酸亚铁铵溶液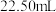 ,则该产品的纯度为
,则该产品的纯度为___________ (结果保留小数点后两位)。
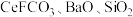 等)为原料制备氧化铈
等)为原料制备氧化铈 ,并测定其纯度。工艺流程如下:
,并测定其纯度。工艺流程如下:
已知:
①盐酸优溶法是稀土生产工艺中的一种常用方法:
②沉淀时发生的主要反应为
 ;
;请回答下列问题:
(1)“滤渣”的成分是
(2)稀土“酸浸”时,稀土的浸出率和酸度、温度有关,如图所示,应选择的适宜的条件为

(3)“转化”时发生反应的离子方程式为
(4)洗涤
 沉淀时,通常用含
沉淀时,通常用含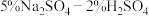 热液洗涤
热液洗涤 次,其主要目的为
次,其主要目的为(5)研究发现在空气中加热
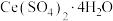 [摩尔质量:
[摩尔质量: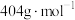 ]也可以得到
]也可以得到 ,准确称取
,准确称取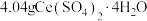 样品,在空气中进行加热,残留固体的质量随温度的变化如图所示,则固体成分为
样品,在空气中进行加热,残留固体的质量随温度的变化如图所示,则固体成分为 的点为
的点为
(6)取所得产品
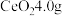 ,用高氯酸和磷酸混合液加热溶解后,用
,用高氯酸和磷酸混合液加热溶解后,用 硫酸亚铁铵
硫酸亚铁铵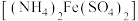 溶液滴定,滴定时发生的反应为
溶液滴定,滴定时发生的反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液
,达到滴定终点时消耗硫酸亚铁铵溶液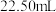 ,则该产品的纯度为
,则该产品的纯度为
您最近一年使用:0次



