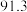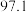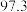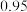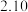1 . 连二亚硫酸钠( )也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
)也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
回答下列问题:
(1)仪器a的名称是___________ ,用装置A制备 时所选用的酸,你认为下列最适宜选用的是
时所选用的酸,你认为下列最适宜选用的是___________ (填字母)。
A.浓盐酸 B.质量分数为70%的
C.稀硝酸 D.质量分数为10%的稀硫酸
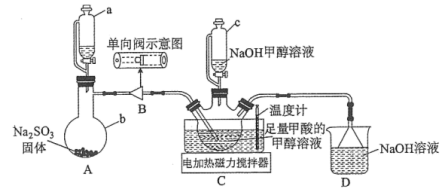
(2)单向阀的作用是___________ ,制备保险粉前先打开仪器a的活塞的目的是___________ 。
(3)已知三颈烧瓶中的甲酸转化为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:___________ 。
(4) 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:___________ 。
(5) 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:___________ (写出实验操作、现象及结论)。
(6)称取粗产品 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应(
溶液恰好完全反应( ),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到
),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为___________ (含 、
、 的表达式)。
的表达式)。
 )也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取
)也叫做保险粉,是一种重要的化工产品,易溶于水、难溶于甲醇,在碱性介质中比较稳定,在空气中易被氧化。某化学小组用如图所示装置(夹持仪器已省略)制取 。
。
回答下列问题:
(1)仪器a的名称是
 时所选用的酸,你认为下列最适宜选用的是
时所选用的酸,你认为下列最适宜选用的是A.浓盐酸 B.质量分数为70%的

C.稀硝酸 D.质量分数为10%的稀硫酸
(2)单向阀的作用是
(3)已知三颈烧瓶中的甲酸转化为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(4)
 是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:
是一种常用的还原剂,写出它与酸性高锰酸钾溶液反应的离子方程式:(5)
 固体隔绝空气加热使之完全分解得到固体产物
固体隔绝空气加热使之完全分解得到固体产物 、
、 和
和 气体,设计实验方案检验产物中含有的
气体,设计实验方案检验产物中含有的 :
:(6)称取粗产品
 加水溶解,用NaOH溶液碱化后,加入一定量的
加水溶解,用NaOH溶液碱化后,加入一定量的 溶液恰好完全反应(
溶液恰好完全反应( ),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到
),将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到 银,则粗产品中连二亚硫酸钠的纯度为
银,则粗产品中连二亚硫酸钠的纯度为 、
、 的表达式)。
的表达式)。
您最近一年使用:0次
名校
解题方法
2 . 次硫酸氢钠甲醛(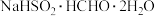 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以Cu、浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以Cu、浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
(1)制备 :将Cu片置于浓
:将Cu片置于浓 中,一定条件下反应生成
中,一定条件下反应生成 。
。
①Cu与浓 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
②该方法制备 时,可以采用的装置是
时,可以采用的装置是___________ (填字母)。

(2)制备 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
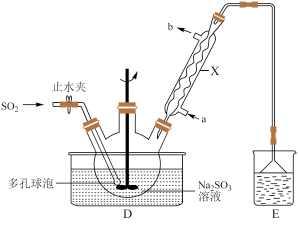
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。
止水夹常温下, 溶液吸收
溶液吸收 的过程中,
的过程中,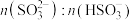 及
及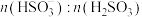 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。
①装置D中多孔球泡的作用是___________ ;装置X的名称为___________ 。
②常温下, 的水解常数
的水解常数
___________ , 溶液呈酸性,用化学平衡原理解释:
溶液呈酸性,用化学平衡原理解释:___________ 。
(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;将滤液真空蒸发浓缩,冷却结晶。
①生成 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为___________ 。
②在真空容器中蒸发浓缩的原因是ⅰ.防止___________ ,ⅱ.防止温度过高使产物分解。
(4)测定产品的纯度:准确称取2.0g产品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。产品的纯度为___________ 。
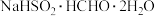 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以Cu、浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以Cu、浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:(1)制备
 :将Cu片置于浓
:将Cu片置于浓 中,一定条件下反应生成
中,一定条件下反应生成 。
。①Cu与浓
 发生反应的化学方程式为
发生反应的化学方程式为②该方法制备
 时,可以采用的装置是
时,可以采用的装置是
(2)制备
 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。
止水夹常温下,
 溶液吸收
溶液吸收 的过程中,
的过程中,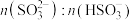 及
及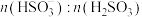 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。①装置D中多孔球泡的作用是
②常温下,
 的水解常数
的水解常数
 溶液呈酸性,用化学平衡原理解释:
溶液呈酸性,用化学平衡原理解释:(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;将滤液真空蒸发浓缩,冷却结晶。
①生成
 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为②在真空容器中蒸发浓缩的原因是ⅰ.防止
(4)测定产品的纯度:准确称取2.0g产品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知
 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。产品的纯度为
您最近一年使用:0次
2024-01-05更新
|
249次组卷
|
2卷引用:陕西省宝鸡教育联盟2023-2024学年高三上学期第五次联考化学试题
名校
解题方法
3 . 孔雀石主要成分是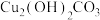 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
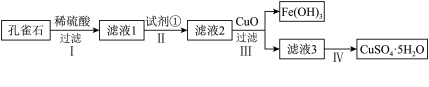
有关物质沉淀的pH数据如下:
(1)步骤Ⅰ加稀硫酸充分反应,过滤得到滤渣的主要成分是___________ (填化学式),该物质进一步提纯后可用于制造___________ 。提高步骤Ⅰ反应速率的措施是___________ (写一条即可)。
(2)步骤Ⅱ中试剂①应选用试剂___________ (填序号)。
a. b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水
相关反应的离子方程式为___________ 。
(3)步骤Ⅲ加入CuO调节溶液pH至___________ (填写范围),目的是___________ 。
(4)由滤液3获得硫酸铜晶体需经过___________ 、___________ 、过滤、洗涤、干燥。
(5)常温下 的
的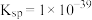 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
___________ 。
(6)用 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的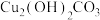 可以生成1.5mol金属铜,则该反应的化学方程式为
可以生成1.5mol金属铜,则该反应的化学方程式为___________ 。
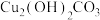 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
有关物质沉淀的pH数据如下:
| 物质 | pH(开始沉淀) | pH(完全沉淀) |
 | 1.9 | 3.2 |
 | 7.0 | 9.0 |
 | 4.7 | 6.7 |
(1)步骤Ⅰ加稀硫酸充分反应,过滤得到滤渣的主要成分是
(2)步骤Ⅱ中试剂①应选用试剂
a.
 b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水相关反应的离子方程式为
(3)步骤Ⅲ加入CuO调节溶液pH至
(4)由滤液3获得硫酸铜晶体需经过
(5)常温下
 的
的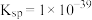 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
(6)用
 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的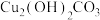 可以生成1.5mol金属铜,则该反应的化学方程式为
可以生成1.5mol金属铜,则该反应的化学方程式为
您最近一年使用:0次
解题方法
4 . 皓矾( )在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS,含有少量
)在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS,含有少量 等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。

回答下列问题:
(1)“酸浸”前,先要对闪锌矿粉碎处理,其目的是_____ ;
(2)“酸浸”时,ZnS和 反应的离子方程式为
反应的离子方程式为_____ ;
(3)“氧化”时,双氧水实际消耗量远大于理论计算值,除温度因素外,可能的原因是_____ ;
(4)“滤渣2”为黄钠铁矾 沉淀,产生该沉淀的离子方程式方
沉淀,产生该沉淀的离子方程式方_____ ;
(5)若“净化”时,将除去 和
和 的反应设计成原电池,正极生成的物质是
的反应设计成原电池,正极生成的物质是_____ (填化学式)。
(6)该工艺产生的废液中含有 ,需要先处理后排放。向废液中加入由
,需要先处理后排放。向废液中加入由 和
和 组成的缓冲溶液调节
组成的缓冲溶液调节 ,再通入
,再通入 发生反应:
发生反应: 。处理后的废液中部分微粒浓度如下:
。处理后的废液中部分微粒浓度如下:
则
_____ ,该废水_____ (填“能”或“不能”)排放。
已知:常温下, ,
, 。当
。当 时认为废水可以排放。
时认为废水可以排放。
 )在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS,含有少量
)在生活中主要用作材料防腐剂和医疗消毒剂。以闪锌矿(主要成分为ZnS,含有少量 等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
等杂质)为主要原料制备皓矾的工艺流程如图(已知:“滤渣1”含有硫等)。
回答下列问题:
(1)“酸浸”前,先要对闪锌矿粉碎处理,其目的是
(2)“酸浸”时,ZnS和
 反应的离子方程式为
反应的离子方程式为(3)“氧化”时,双氧水实际消耗量远大于理论计算值,除温度因素外,可能的原因是
(4)“滤渣2”为黄钠铁矾
 沉淀,产生该沉淀的离子方程式方
沉淀,产生该沉淀的离子方程式方(5)若“净化”时,将除去
 和
和 的反应设计成原电池,正极生成的物质是
的反应设计成原电池,正极生成的物质是(6)该工艺产生的废液中含有
 ,需要先处理后排放。向废液中加入由
,需要先处理后排放。向废液中加入由 和
和 组成的缓冲溶液调节
组成的缓冲溶液调节 ,再通入
,再通入 发生反应:
发生反应: 。处理后的废液中部分微粒浓度如下:
。处理后的废液中部分微粒浓度如下:| 微粒 |  |  |  |  |
浓度/( ) ) | 0.2 | 0.1 | 0.2 | a |

已知:常温下,
 ,
, 。当
。当 时认为废水可以排放。
时认为废水可以排放。
您最近一年使用:0次
解题方法
5 . 羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产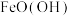 的工艺流程如图:
的工艺流程如图:

已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
(1)羟基氧化铁中铁元素的化合价是______ ,“固体1”的主要成分是______ 。
(2)“酸浸”时FeO与硫酸发生反应的离子方程式为______ 。“试剂X”宜选择的是______ 。
A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)检验“滤液1”中铁元素全部为 的实验操作为
的实验操作为______ 。
(4)将 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入NaOH溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入NaOH溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到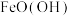 。该反应的离子方程式为
。该反应的离子方程式为______ 。
(5)“滤液3”中,溶质的主要成分是______ (写化学式)。
 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产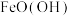 的工艺流程如图:
的工艺流程如图:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。(1)羟基氧化铁中铁元素的化合价是
(2)“酸浸”时FeO与硫酸发生反应的离子方程式为
A.双氧水 B.铁粉 C.铜粉 D.钠块
(3)检验“滤液1”中铁元素全部为
 的实验操作为
的实验操作为(4)将
 配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入NaOH溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到
配制成一定浓度的溶液,恒温条件下边搅拌边按一定比例加入NaOH溶液,同时鼓入空气进行氧化,至反应液全部变为棕黄色悬浊液,即可得到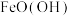 。该反应的离子方程式为
。该反应的离子方程式为(5)“滤液3”中,溶质的主要成分是
您最近一年使用:0次
名校
解题方法
6 . 某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的花肥的主要成分及性质。首先对该花肥的主要成分进行了如下假设:
a.只含有 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液 ,然后进行如下实验:
,然后进行如下实验:
(1)提出假设 的依据是
的依据是___________ (用离子方程式表示)。
(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是___________ (用化学方程式和离子方程式表示)。
(3)实验Ⅱ中所加试剂的名称是___________ ,由此得出的结论是___________ 。
(4)为进一步验证假设,该小组同学进行了如下实验:
实验Ⅳ中新制氯水参加反应的离子方程式是___________ 。
(5)通过以上实验,可得到的结论是___________ 。还可以通过实验___________ 证明 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
a.只含有
 b.含有
b.含有 和
和 c.只含有
c.只含有
将花肥固体粉末溶于水中得到溶液
 ,然后进行如下实验:
,然后进行如下实验:| 实验序号 | 操作 | 现象 |
| Ⅰ | 取 溶液 溶液 ,加入 ,加入 的 的 溶液 溶液 | 产生红褐色沉淀 |
| Ⅱ | 取 溶液 溶液 ,加入1滴___________溶液 ,加入1滴___________溶液 | 溶液显红色 |
 的依据是
的依据是(2)实验Ⅰ的预期现象是先产生白色沉淀,然后变成灰绿色,最后变成红褐色沉淀,产生该预期现象的依据是
(3)实验Ⅱ中所加试剂的名称是
(4)为进一步验证假设,该小组同学进行了如下实验:
| 实验序号 | 操作 | 现象 |
| Ⅲ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 水 水 | 溶液显红色 |
| Ⅳ | 取 溶液 溶液 ,加入1滴 ,加入1滴 溶液,再加入 溶液,再加入 新制氯水 新制氯水 | 溶液显红色,且颜色比实验而的深 |
(5)通过以上实验,可得到的结论是
 的存在(填具体的操作及现象)。
的存在(填具体的操作及现象)。
您最近一年使用:0次
2023-12-26更新
|
116次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高一上学期12月月考化学试题
名校
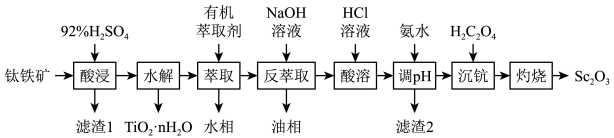
7 . 钪( )是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁(
)是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁( )、还含有少量
)、还含有少量 、
、 、
、 等杂质、从钛铁矿中提取钪的流程如图:
等杂质、从钛铁矿中提取钪的流程如图:
已知:①常温下, 完全沉淀的
完全沉淀的 为1.05,
为1.05, 完全沉淀的
完全沉淀的 为3.2
为3.2
②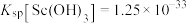 ,
,
回答下列问题:
(1)“酸浸”后钛主要以 的形式存在于溶液中,
的形式存在于溶液中, 中
中 元素的化合价为
元素的化合价为______ . 水解反应的化学方程式为
水解反应的化学方程式为__________________ .
(2)“滤渣1”的主要成分是______ .
(3)探讨影响钪的萃取率的因素:
温度对钪、钛的萃取率影响情况见上表,合适的萃取温度为 ,其理由是
,其理由是______ .
(4)常温下,“酸溶”后滤液中存在的金属阳离子 、
、 、
、 ,浓度均小于
,浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围,是
应控制的范围,是______ .
(5)“沉钪”得到草酸钪[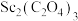 ],将其置于
],将其置于______ (填仪器名称)中,在空气中充分灼烧得到 和一种无毒气体,请写出反应的化学方程式
和一种无毒气体,请写出反应的化学方程式______ .
 )是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁(
)是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁( )、还含有少量
)、还含有少量 、
、 、
、 等杂质、从钛铁矿中提取钪的流程如图:
等杂质、从钛铁矿中提取钪的流程如图:
已知:①常温下,
 完全沉淀的
完全沉淀的 为1.05,
为1.05, 完全沉淀的
完全沉淀的 为3.2
为3.2②
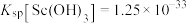 ,
,
回答下列问题:
(1)“酸浸”后钛主要以
 的形式存在于溶液中,
的形式存在于溶液中, 中
中 元素的化合价为
元素的化合价为 水解反应的化学方程式为
水解反应的化学方程式为(2)“滤渣1”的主要成分是
(3)探讨影响钪的萃取率的因素:
| 5 | 10 | 15 | 25 | 30 |
钪的萃取率/% |
|
|
|
|
|
钛的萃取率/% |
|
|
|
|
|
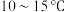 ,其理由是
,其理由是(4)常温下,“酸溶”后滤液中存在的金属阳离子
 、
、 、
、 ,浓度均小于
,浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围,是
应控制的范围,是(5)“沉钪”得到草酸钪[
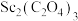 ],将其置于
],将其置于 和一种无毒气体,请写出反应的化学方程式
和一种无毒气体,请写出反应的化学方程式
您最近一年使用:0次
名校
解题方法
8 . 钴在现代有着广泛应用,如草酸钴可作指示剂与催化剂,氯化钴是一种饲料营养强化剂.利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
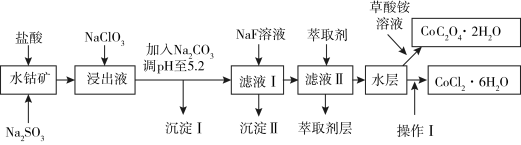
已知:① 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为加快钴矿“浸出”效率,可采取的措施是______ (任选一条),浸出过程中加入的 与
与 反应的离子方程式为
反应的离子方程式为______ .
(2)加入 的作用是
的作用是______ ,后续加入 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是______ .
(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中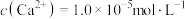 ,则:
,则: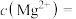
______  .[已知:
.[已知: ,
, ]
]
(4)加入萃取剂可以除去的杂质离子是______ .
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,______ 、过滤、洗涤、减压烘干等过程.
(6)在空气中加热5.49g草酸钴晶体( ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]
经测定,210~290℃过程中产生的气体只有 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是______ .
 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
已知:①
 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物 |
|
|
|
|
|
开始沉淀 | 27 | 7.6 | 7.6 | 4.0 | 7.7 |
沉淀完全 | 3.7 | 9.6 | 9.2 | 5.1 | 9.8 |
(1)为加快钴矿“浸出”效率,可采取的措施是
 与
与 反应的离子方程式为
反应的离子方程式为(2)加入
 的作用是
的作用是 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中
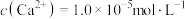 ,则:
,则: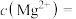
 .[已知:
.[已知: ,
, ]
](4)加入萃取剂可以除去的杂质离子是
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,
(6)在空气中加热5.49g草酸钴晶体(
 ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]温度范围/℃ | 150~210 | 290~320 | 890~920 |
固体质量/g | 4.41 | 2.41 | 2.25 |
 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是
您最近一年使用:0次
2023-12-21更新
|
392次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
名校
解题方法
9 . 锰元素能形成 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知:硫化氢 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。 溶液滴入
溶液滴入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。
(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为___________ (填标号)。
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:___________ 。
(3)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(4)“氧化”: 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为___________ 。
(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。___________ 。
 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:硫化氢
 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
 溶液滴入
溶液滴入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:
(3)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(4)“氧化”:
 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
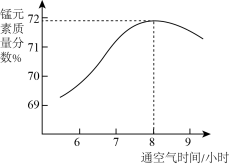
您最近一年使用:0次
2023-12-13更新
|
233次组卷
|
3卷引用:陕西省西安市2023-2024学年高一下学期4月期中联考化学试题
名校
解题方法
10 . ZnS可用作分析试剂、荧光粉的基质、光导体材料。25℃时,实验室以含锌废液(主要成分为 ,含少量的
,含少量的 、
、 )为原料制备活性ZnS的流程如图所示:
)为原料制备活性ZnS的流程如图所示:

已知:①25℃时溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
②25℃时,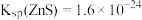 、
、 、
、 。
。
请回答下列问题:
(1)“氧化除锰”阶段生成 的离子方程式为
的离子方程式为______ ;不能用 代替
代替 的原因为
的原因为______ 。
(2)“除铁”时需调节溶液的pH。调pH时Zn不能代替ZnO,原因是______ 。
(3)“沉锌”时若用 代替
代替 可能导致的后果是
可能导致的后果是______ 。
(4)理论计算说明,“沉锌”时用 代替
代替 具有可行性,则用
具有可行性,则用 代替
代替 时,反应的平衡常数为
时,反应的平衡常数为______ 。
 ,含少量的
,含少量的 、
、 )为原料制备活性ZnS的流程如图所示:
)为原料制备活性ZnS的流程如图所示:
已知:①25℃时溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
物质 |
|
|
|
开始沉淀的pH | 1.9 | 6.8 | 6.2 |
完全沉淀的pH | 3.2 | 8.3 | 8.2 |
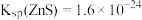 、
、 、
、 。
。请回答下列问题:
(1)“氧化除锰”阶段生成
 的离子方程式为
的离子方程式为 代替
代替 的原因为
的原因为(2)“除铁”时需调节溶液的pH。调pH时Zn不能代替ZnO,原因是
(3)“沉锌”时若用
 代替
代替 可能导致的后果是
可能导致的后果是(4)理论计算说明,“沉锌”时用
 代替
代替 具有可行性,则用
具有可行性,则用 代替
代替 时,反应的平衡常数为
时,反应的平衡常数为
您最近一年使用:0次
2023-12-13更新
|
256次组卷
|
3卷引用:陕西省安康市高新中学2023-2024学年高三上学期阶段性测试四化学试题