名校
1 . 物质类别和元素化合价是研究物质性质的两个重要角度。
Ⅰ.硫在不同价态之间的转化: 溶液
溶液 溶液
溶液
(1)反应①的转化说明
 的类别属于
的类别属于 溶液,从化合价的角度分析,反应②合理的是
溶液,从化合价的角度分析,反应②合理的是a. b.
b. c.
c.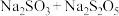
Ⅱ.某兴趣小组模拟工业制取 的装置(夹持和加热装置略)如图所示。
的装置(夹持和加热装置略)如图所示。
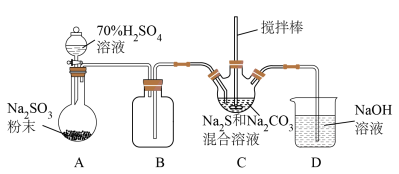
(2)装置A中发生反应的化学方程式为
(3)装置C发生的反应有①
 ;②……;③
;②……;③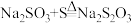 ,反应②的离子方程式为
,反应②的离子方程式为 ,应使三颈烧瓶中
,应使三颈烧瓶中 和
和 恰好完全反应,则三颈烧瓶中
恰好完全反应,则三颈烧瓶中 和
和 物质的量之比应为
物质的量之比应为(4)工业上常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 ,发生反应的离子方程式为
,发生反应的离子方程式为 可用于氰化物解毒,解毒原理为
可用于氰化物解毒,解毒原理为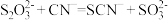 。体外模拟该解毒实验,检验该转化有
。体外模拟该解毒实验,检验该转化有 生成的实验操作是
生成的实验操作是
您最近一年使用:0次
名校
解题方法
2 . 硫酸铁是水处理行业用作净水的混凝剂和污泥的处理剂,广泛用于水的处理。一种以黄铁矿烧渣(主要成分为 、FeO、
、FeO、 等)为原料制取硫酸铁晶体的工艺流程如下:(已知:
等)为原料制取硫酸铁晶体的工艺流程如下:(已知: 不溶于水,不和硫酸反应。)
不溶于水,不和硫酸反应。)
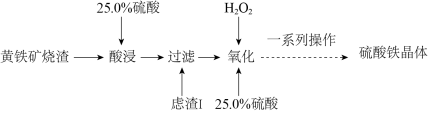
(1)“酸浸”前将黄铁矿烧渣粉碎的目的是
(2)已知:25.0%硫酸的密度
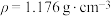 ,则25.0%硫酸的物质的量浓度为
,则25.0%硫酸的物质的量浓度为 的浓硫酸配制500mL 25.0%硫酸,则需用量筒量18
的浓硫酸配制500mL 25.0%硫酸,则需用量筒量18 的浓硫酸的体积为
的浓硫酸的体积为(3)“酸浸”后过滤所得滤液中所含的阳离子有
(4)“氧化”过程发生反应的离子方程式为
 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是(5)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为
您最近一年使用:0次
解题方法
3 . 无水氯化镨( )是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、
)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、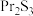 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(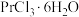 )。
)。

已知:① ;
;
② ;
;
③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
④沉淀时加入氨水逐步调节溶液的pH至6.5,此时滤渣Ⅱ中不含Pr的化合物。
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有_______ (填一种即可)。
(2)滤渣I的主要成分为 和S:
和S:
①写出 的一种用途:
的一种用途:_______ 。
②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:_______ 。
(3)加入 的目的是
的目的是_______ ,其发生反应的离子方程式为_______
(4)滤渣Ⅱ的主要成分为_______ (填化学式)。
(5)利用表中的数据求出
_______ 。
 )是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、
)是制取稀土金属镨及镨合金的主要原料,采用如图工艺流程可由孪生矿(主要含ZnS、FeS、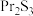 、
、 等)制备氯化镨晶体(
等)制备氯化镨晶体(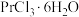 )。
)。
已知:①
 ;
;②
 ;
;③该条件下,溶液中部分金属离子生成氢氧化物开始沉淀和沉淀完全时的pH如表所示:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 5.4 | 2.2 | 7.5 |
沉淀完全( )时的pH )时的pH | 6.4 | 3.2 | 9.0 |
回答下列问题:
(1)为了提高镨元素的浸出率,可采取的措施有
(2)滤渣I的主要成分为
 和S:
和S:①写出
 的一种用途:
的一种用途:②S可用来处理体温计破碎时渗出的液态Hg,还可用来制黑火药(由硫黄粉、硝酸钾和木炭混合而成,爆炸时的生成物为硫化钾、氮气和二氧化碳),写出黑火药爆炸时发生反应的化学方程式:
(3)加入
 的目的是
的目的是(4)滤渣Ⅱ的主要成分为
(5)利用表中的数据求出

您最近一年使用:0次
解题方法
4 .  是高效安全灭菌消毒剂,部分性质如下:
是高效安全灭菌消毒剂,部分性质如下:
实验室可利用反应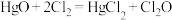 制取
制取 ,装置如图所示:
,装置如图所示:
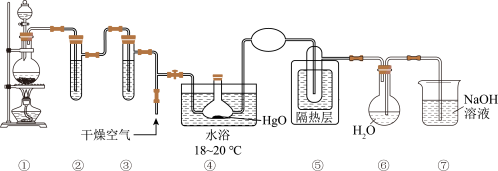
(1)装置⑥中仪器的名称为_______ 。
(2)装置①中制取氯气时需要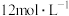 盐酸,若加入盐酸的体积是
盐酸,若加入盐酸的体积是 ,制取氯气的物质的量小于
,制取氯气的物质的量小于 ,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是
,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是_______ 。
(3)③中试剂的名称是_______ 。
(4)④中反应氧化剂和还原剂物质的量比值是_______ 。
(5)⑥中 与水反应制取
与水反应制取 ,反应的化学方程式是
,反应的化学方程式是_______ ; 中混有盐酸,原因是
中混有盐酸,原因是_______ (用化学方程式表示)。
(6)⑦中 溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是_______ 。
 是高效安全灭菌消毒剂,部分性质如下:
是高效安全灭菌消毒剂,部分性质如下:| 物理性质 | 化学性质 |
| 常温下,具有强烈刺激性气味的黄棕色气体 熔点:  ℃;沸点:3.8℃;42℃以上分解为 ℃;沸点:3.8℃;42℃以上分解为 和 和 。 。 | 强氧化性;与有机物、还原剂接触或浓度过高时会发生爆炸;易溶于水且会与水反应生成次氯酸 |
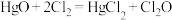 制取
制取 ,装置如图所示:
,装置如图所示:
(1)装置⑥中仪器的名称为
(2)装置①中制取氯气时需要
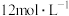 盐酸,若加入盐酸的体积是
盐酸,若加入盐酸的体积是 ,制取氯气的物质的量小于
,制取氯气的物质的量小于 ,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是
,除了考虑盐酸的挥发和生成水的因素外,最主要的原因是(3)③中试剂的名称是
(4)④中反应氧化剂和还原剂物质的量比值是
(5)⑥中
 与水反应制取
与水反应制取 ,反应的化学方程式是
,反应的化学方程式是 中混有盐酸,原因是
中混有盐酸,原因是(6)⑦中
 溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
溶液能吸收多余的氯气,防止污染空气,发生反应的离子方程式是
您最近一年使用:0次
解题方法
5 . 某研究小组以工厂废渣( 、
、 )为原料制取
)为原料制取 工艺流程如图。回答下列问题:
工艺流程如图。回答下列问题:
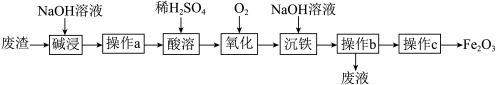
(1)“碱浸”时将固体磨碎的目的是_______ ,发生反应的离子方程式为_______ 。
(2)“操作a”需要的玻璃仪器有_______ 、_______ 、_______ 。
(3)“氧化”过程的离子方程式是_______ 。
(4)操作c的名称是_______ ;从分类的角度, 属于
属于_______ 。
(5)向 、Cu的混合物中加入盐酸,反应后的溶液中检验不出
、Cu的混合物中加入盐酸,反应后的溶液中检验不出 。检验
。检验 试剂名称是
试剂名称是_______ ,反应后溶液中没有 的原因是
的原因是_______ (用离子方程式表示)。
 、
、 )为原料制取
)为原料制取 工艺流程如图。回答下列问题:
工艺流程如图。回答下列问题:
(1)“碱浸”时将固体磨碎的目的是
(2)“操作a”需要的玻璃仪器有
(3)“氧化”过程的离子方程式是
(4)操作c的名称是
 属于
属于(5)向
 、Cu的混合物中加入盐酸,反应后的溶液中检验不出
、Cu的混合物中加入盐酸,反应后的溶液中检验不出 。检验
。检验 试剂名称是
试剂名称是 的原因是
的原因是
您最近一年使用:0次
解题方法
6 . 以废旧催化剂(主要成分为 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
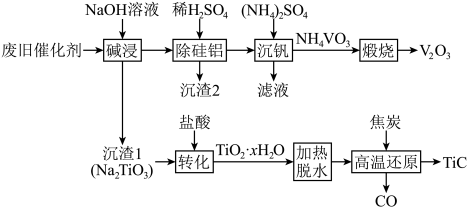
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是_______ (填化学式),实验室中将“沉渣1”从“碱浸”所得的悬浊液中分离出来所需玻璃仪器的名称为_______ 。
(2)“沉渣2”中含有两种成分,它们的化学式为_______ 。
(3)“转化”时发生反应的化学方程式为_______ 。
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为_______ 。
(5)“高温还原”时 发生反应的化学方程式为
发生反应的化学方程式为_______ ,若生成30g还原产物,则转移电子的物质的量为_______ 。
 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是
(2)“沉渣2”中含有两种成分,它们的化学式为
(3)“转化”时发生反应的化学方程式为
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为
(5)“高温还原”时
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 碲(Te)广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为 ,还含有金、银、铂等)回收碲的工艺流程如下:
,还含有金、银、铂等)回收碲的工艺流程如下:
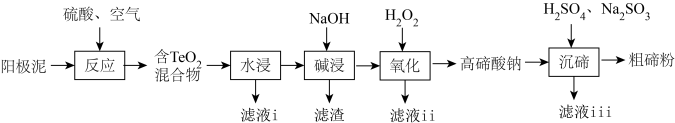
已知: 有强还原性,且
有强还原性,且 、
、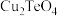 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式: 。
。
回答下列问题:
(1)为提高“反应”效率,可采取的措施为_______ (任答一条)。
(2)滤液i的主要成分是_______ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释铜的浸出率随温度变化的可能原因_______ 。

(3)“氧化”过程中发生反应的离子方程式为_______ 。滤液ⅱ可循环使用,应将其导入到_______ (写操作单元名称)操作中。
(4)“沉碲”过程中发生反应的离子方程式为_______ 。
 ,还含有金、银、铂等)回收碲的工艺流程如下:
,还含有金、银、铂等)回收碲的工艺流程如下:
已知:
 有强还原性,且
有强还原性,且 、
、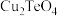 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式: 。
。回答下列问题:
(1)为提高“反应”效率,可采取的措施为
(2)滤液i的主要成分是

(3)“氧化”过程中发生反应的离子方程式为
(4)“沉碲”过程中发生反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 草酸钴主要用作制氧化钴的原料,也可用于制取其他钴化合物。利用废料铝钴膜(含有LiCoO2、Al、Fe)制备草酸钴的工艺如下:
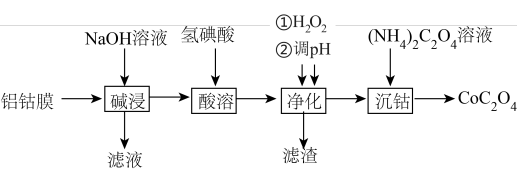
已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
(1)钴酸锂LiCoO2中钴元素的化合价为__________ 。
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式__________ 。
(3)“酸溶”过程LiCoO2发生反应的离子方程式为__________ 。
(4)“净化”过程加入H2O2的目的是__________ 。
(5)调节pH的范围是__________ ,滤渣的成分是__________ (填化学式)。
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法__________ 。

已知:①钴酸锂LiCoO2难溶于水,具有强氧化性。
②氢碘酸是强酸,酸溶后的溶液含有Li+、Fe2+、Co2+。
③金属离子沉淀开始和沉淀完全的pH:
| Fe2+ | Fe3+ | Al3+ | Co2+ | |
| 沉淀开始的pH | 6.5 | 1.5 | 3.3 | 6.6 |
| 沉淀完全的pH | 9.7 | 3.2 | 4.7 | 9.2 |
(1)钴酸锂LiCoO2中钴元素的化合价为
(2)“碱浸”的目的是溶解Al,写出“碱浸”过程发生反应的离子方程式
(3)“酸溶”过程LiCoO2发生反应的离子方程式为
(4)“净化”过程加入H2O2的目的是
(5)调节pH的范围是
(6)“沉钴”后过滤、洗涤,简述洗涤沉淀的方法
您最近一年使用:0次
9 . 甲醇是一种基本的有机化工原料,用途十分广泛。应用CO2催化加氢规模化生产甲醇是综合利用CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,需通过以下两步实现:
I.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) △H2
反应过程中各物质的相对能量变化情况如图所示。
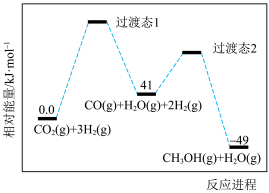
(1)
_______ ,稳定性:过渡态1_______ 过渡态2(填“大于”“小于”或“等于”)。
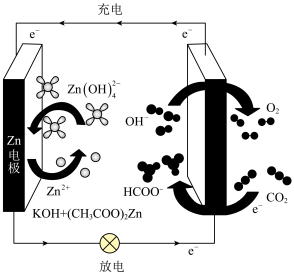
(2)基于催化剂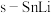 的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为_______ ,若电池工作t min,Zn电极的质量变化为 ,则理论上消耗CO2的物质的量为
,则理论上消耗CO2的物质的量为_______ 。
(3)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有 )的原理示意图如下图所示。
)的原理示意图如下图所示。

①M极的电极反应式为_______ ,N极附近的pH_______ (填“变大”或“变小”或“不变”)。
②写出电解池中 转化为Cr3+的离子方程式
转化为Cr3+的离子方程式_______ 。
I.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) △H2
反应过程中各物质的相对能量变化情况如图所示。

(1)

(2)基于催化剂
 的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为 ,则理论上消耗CO2的物质的量为
,则理论上消耗CO2的物质的量为
(3)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有
 )的原理示意图如下图所示。
)的原理示意图如下图所示。
①M极的电极反应式为
②写出电解池中
 转化为Cr3+的离子方程式
转化为Cr3+的离子方程式
您最近一年使用:0次
10 . 以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取精银、Mn及MnO2的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是_______ 。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:_______ 。
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:
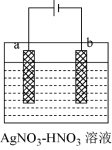
①_______ 极为“粗银电极”(填“a”或“b”)。
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为_______ ;当电路中通过0.025NA电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为_______ mL(保留三位有效数字)。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以
 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:

①
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为
您最近一年使用:0次



