2021高三·全国·专题练习
1 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______________________________ 。
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为____________ mol;产生“气泡”的化学方程式为__________________ 。
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_____________________ (用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________ kg(保留整数)。
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
2 . 氯及其化合物形式多样,用途广泛。回答下列问题:
(1)KClO4是一种白色粉末,其化学名称为_______ ;漂白粉的主要成分是_______ 。
(2)气体ClO2是应用较普遍的安全、无毒的消毒剂,可以用KClO3在稀H2SO4中和草酸反应制备,其化学方程式为_______ 。
(3)氨气可以检验输送氯气的管道是否泄漏,试写出化学反应方程式:_______ 。
(4)向200mLNaOH溶液中通入一定量Cl2恰好完全反应,得到0.1molNaClO3和0.1molNaClO,则原NaOH溶液的物质的量浓度为_______ 。
(1)KClO4是一种白色粉末,其化学名称为
(2)气体ClO2是应用较普遍的安全、无毒的消毒剂,可以用KClO3在稀H2SO4中和草酸反应制备,其化学方程式为
(3)氨气可以检验输送氯气的管道是否泄漏,试写出化学反应方程式:
(4)向200mLNaOH溶液中通入一定量Cl2恰好完全反应,得到0.1molNaClO3和0.1molNaClO,则原NaOH溶液的物质的量浓度为
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
3 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
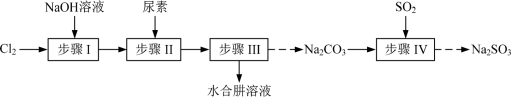
已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_______ ;实验中控制温度除用冰水浴外,还需采取的措施是_______ 。

已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
您最近一年使用:0次
解题方法
4 .  与
与 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
回答下列问题:
(1)氯气的电子式为_______ 。
(2)氯气和氢氧化钠溶液制备漂白液的离子方程式为_______ 。
(3)某兴趣小组通过如下装置(夹持装置略)对 制备、吸收、释放和应用进行了研究。
制备、吸收、释放和应用进行了研究。
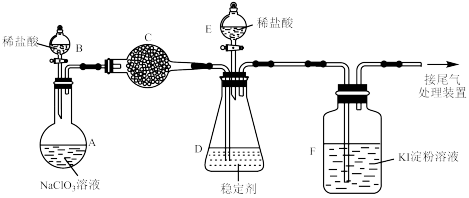
已知:装置C中的药品可以吸收氯气
①打开B的活塞,A中发生反应生成 ,请将化学方程式配平
,请将化学方程式配平_______
_______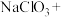 _______
_______ _______
_______ _______
_______ _______
_______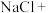 _______
_______ 。
。
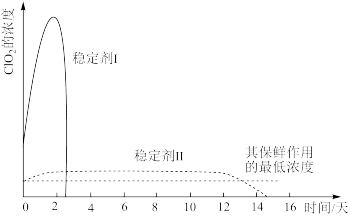
②已吸收 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放 的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_______ ,原因是_______ 。
③关闭B的活塞, 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,在酸性条件下
,在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
 与
与 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。回答下列问题:
(1)氯气的电子式为
(2)氯气和氢氧化钠溶液制备漂白液的离子方程式为
(3)某兴趣小组通过如下装置(夹持装置略)对
 制备、吸收、释放和应用进行了研究。
制备、吸收、释放和应用进行了研究。
已知:装置C中的药品可以吸收氯气
①打开B的活塞,A中发生反应生成
 ,请将化学方程式配平
,请将化学方程式配平_______
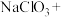 _______
_______ _______
_______ _______
_______ _______
_______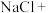 _______
_______ 。
。②已吸收
 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放 的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
的浓度随时间的变化如下图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
③关闭B的活塞,
 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,在酸性条件下
,在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2021-01-27更新
|
669次组卷
|
5卷引用:北京市顺义区2021届高三一模化学试题
北京市顺义区2021届高三一模化学试题(已下线)热点2 电解质与离子反应-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)重点1 离子反应-2021年高考化学专练【热点·重点·难点】(已下线)第12讲 富集在海水中的元素——卤素(精练)-2022年高考化学一轮复习讲练测新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
5 . 工业尾气中的氯气有多种处理方法。
(1)处理尾气中少量氯气的方法如图所示。
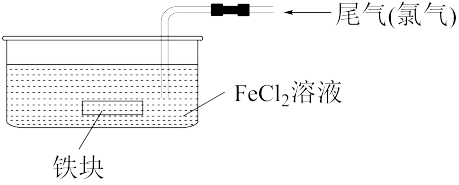
①处理过程中,发生反应的离子方程式为_______ 。
②为维持处理过程的持续进行,需要定期加入的物质是_______ 。
(2)大量氯气可用NaOH溶液处理,标准状况下,处理11.2L Cl2转移电子的物质的量为_______ mol。
(1)处理尾气中少量氯气的方法如图所示。

①处理过程中,发生反应的离子方程式为
②为维持处理过程的持续进行,需要定期加入的物质是
(2)大量氯气可用NaOH溶液处理,标准状况下,处理11.2L Cl2转移电子的物质的量为
您最近一年使用:0次
解题方法
6 . 将一定量的 通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中
通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中 的物质的量为0.06mol,
的物质的量为0.06mol, 的物质的量为0.03mol,请按要求回答下列问题。
的物质的量为0.03mol,请按要求回答下列问题。
(1)该反应的化学方程式为________________________________________________ 。
(2)该反应中,氧化剂与还原剂的物质的量之比为____________ 。
(3)上述反应中,通入 的物质的量为
的物质的量为____________ mol,氢氧化钾溶液的物质的量浓度为__________
mol/L。
 通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中
通入体积为40mL的氢氧化钾溶液中,两者恰好完全反应,测得反应后溶液中有三种含氯元素的离子,其中 的物质的量为0.06mol,
的物质的量为0.06mol, 的物质的量为0.03mol,请按要求回答下列问题。
的物质的量为0.03mol,请按要求回答下列问题。(1)该反应的化学方程式为
(2)该反应中,氧化剂与还原剂的物质的量之比为
(3)上述反应中,通入
 的物质的量为
的物质的量为mol/L。
您最近一年使用:0次
名校
7 . Cl2是一种重整的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸。化学方程式为________________ 。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为_______________ 。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为_______________ 。其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是_____________ 。
②Ⅰ中,生成K2MnO4的化学方程式是____________ 。
③Ⅱ中,浸取时用稀KOH溶液的原因是_____________ 。
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为____________ 。
(1)可与氢气化合制得盐酸。化学方程式为
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为
Ⅰ.将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液慢取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料: K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液源中易发生歧化反应(Mn的化合价既升高又降低)。
①Ⅰ中,粉碎软锰矿的目的是
②Ⅰ中,生成K2MnO4的化学方程式是
③Ⅱ中,浸取时用稀KOH溶液的原因是
④Ⅲ中,CO2和K2MnO4在溶液中反应的离子方程式是:MnO
 +CO2 +H2O→MnO
+CO2 +H2O→MnO +MnO2 +HCO
+MnO2 +HCO (未配平),氧化产物和还原产物的物质的量之比为
(未配平),氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
解题方法
8 . Ⅰ.NaClO是“84”消毒液的有效成分。请回答下列问题:
(1)NaClO中Cl元素的化合价是________ 。
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______________ 。(已知酸性: )
)
(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是____________________ 。
Ⅱ. 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知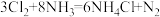 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为______________ 。
(2)喷射石灰乳等碱性物质可以减轻少量 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是__________________ 。
(3)实验室常用烧碱溶液吸收 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为_______________ 。
(1)NaClO中Cl元素的化合价是
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:
 )
)(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是
Ⅱ.
 是一种有毒气体,如果泄漏会造成严重的危害。
是一种有毒气体,如果泄漏会造成严重的危害。(1)已知
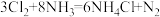 ,化工厂可用浓氨水来检验
,化工厂可用浓氨水来检验 是否泄漏。该反应中被氧化和未被氧化的
是否泄漏。该反应中被氧化和未被氧化的 分子的个数比为
分子的个数比为(2)喷射石灰乳等碱性物质可以减轻少量
 泄漏造成的危害。
泄漏造成的危害。 和石灰乳反应的化学方程式是
和石灰乳反应的化学方程式是(3)实验室常用烧碱溶液吸收
 。若将
。若将 通入热的烧碱溶液中,可以得到NaCl、NaClO和
通入热的烧碱溶液中,可以得到NaCl、NaClO和 的混合液。当混合液中
的混合液。当混合液中 和
和 的个数比为15∶2时,混合液中
的个数比为15∶2时,混合液中 和
和 的个数比为
的个数比为
您最近一年使用:0次
2020-10-02更新
|
987次组卷
|
6卷引用:人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮
人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物4(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用【定心卷】2.2.1 氯气的性质随堂练习-人教版2023-2024学年必修第一册(已下线)【浙江新东方】34吉林省吉林市永吉县第四中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
9 . 利用如图所示的“价-类”二维图,可以从不同角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
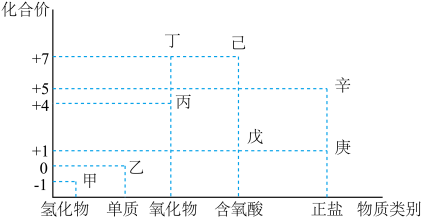
(1)丙的化学式为_____________ ;丁的化学式为_____________ 。
(2)甲、乙、丁、戊中,属于电解质的是__________________________ (填化学式);根据氯元素的化合价判断,乙____________________ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为____________________________ 。
(4)辛在 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是______________ 。

(1)丙的化学式为
(2)甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为
(4)辛在
 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是
您最近一年使用:0次
2020-10-02更新
|
507次组卷
|
2卷引用:人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮
解题方法
10 . 消毒液在我们H常生活中必不可少,请结合相关知识回答下列问题。
(1)生产消毒液是将氯气通入 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为________________________ 。
(2)取少量消毒液滴加 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有________ 离子。
(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的化学方程式:__________________________ ;该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学方程式:_____________________ 。
(1)生产消毒液是将氯气通入
 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为(2)取少量消毒液滴加
 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的化学方程式:
您最近一年使用:0次



