解题方法
1 . 写出下列反应的化学方程式,是离子反应的写离子方程式。
(1) 和
和 溶液的反应
溶液的反应_______ ;
(2) 和石灰乳的反应
和石灰乳的反应_______ ;
(3)把 通
通 溶液中
溶液中_______ ;
(4)将 和
和 混合通入
混合通入 中
中_______ ;
(5)将 通入氢硫酸溶液中
通入氢硫酸溶液中_______ ;
(6)将浓盐酸和 混合加热
混合加热_______ ;
(7)电解饱和食盐水_______ ;
(8)将浓盐酸与漂白液混合_______ ;
(9)向 固体滴加浓盐酸
固体滴加浓盐酸_______ ;
(10)向漂白粉溶液中通入少量 气体
气体_______ 。
(1)
 和
和 溶液的反应
溶液的反应(2)
 和石灰乳的反应
和石灰乳的反应(3)把
 通
通 溶液中
溶液中(4)将
 和
和 混合通入
混合通入 中
中(5)将
 通入氢硫酸溶液中
通入氢硫酸溶液中(6)将浓盐酸和
 混合加热
混合加热(7)电解饱和食盐水
(8)将浓盐酸与漂白液混合
(9)向
 固体滴加浓盐酸
固体滴加浓盐酸(10)向漂白粉溶液中通入少量
 气体
气体
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为_______ ;(CN)2称为“拟卤素”,具有类似Cl2的化学性质,则(CN)2与NaOH水溶液反应的化学方程式为_______ 。
您最近一年使用:0次
解题方法
3 . 工业上是将氯气通入到 的
的 溶液中来制备
溶液中来制备 溶液,若
溶液,若 溶液中
溶液中 的质量分数为
的质量分数为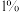 ,则生产
,则生产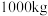 该溶液需消耗氯气的质量为
该溶液需消耗氯气的质量为_______  (保留整数)。
(保留整数)。
 的
的 溶液中来制备
溶液中来制备 溶液,若
溶液,若 溶液中
溶液中 的质量分数为
的质量分数为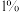 ,则生产
,则生产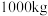 该溶液需消耗氯气的质量为
该溶液需消耗氯气的质量为 (保留整数)。
(保留整数)。
您最近一年使用:0次
22-23高二上·全国·课时练习
4 . 电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2_____ (填“>”“=”或“<”)2L,原因是_____ 。装置改进后,可用于制备NaOH溶液,若测定NaOH溶液的浓度,常用的方法为_____ 。


您最近一年使用:0次
解题方法
5 . 写出下列反应的化学方程式,标出电子转移的方向和数目,并指出氯气在反应中表现出什么性质。
(1)氢气在氯气中燃烧_______ 。
(2)氯气与氢氧化钠反应_______ 。
(3)铁在氯气中燃烧_______ 。
(1)氢气在氯气中燃烧
(2)氯气与氢氧化钠反应
(3)铁在氯气中燃烧
您最近一年使用:0次
6 . 某漂粉精说明书如下:
(1)从主要成分看,可知生产漂粉精的原料是氯气和石灰乳,请写出制漂粉精的化学方程式:_______ ,漂粉精中有效成分为_______ 。
(2)生活中常有的漂白剂还有“84消毒液”,制备“84消毒液”的反应物是通过氯碱工业制得,请写出电解饱和食盐水的化学方程式:_______ ,并进一步写出制备“84消毒液”的化学方程式_______ 。
(3)为什么家庭中的漂白剂使用漂粉精,而不使用氯水?_______ 。
| 使用说明书 主要成分:次氯酸钙、氯化钙 用途用量:取漂粉精2-3克,水100克,配成溶液,将禽流感病人用具浸泡其中5-10分钟,如需要可延长时间,提高浓度。 注意事项:密封保存于阴凉处,随配随用,有腐蚀性,少与手接触。 |
(2)生活中常有的漂白剂还有“84消毒液”,制备“84消毒液”的反应物是通过氯碱工业制得,请写出电解饱和食盐水的化学方程式:
(3)为什么家庭中的漂白剂使用漂粉精,而不使用氯水?
您最近一年使用:0次
解题方法
7 . 氯气是一种非常重要的化工原料,可用于制造盐酸、漂白剂、农药等,但氯气有毒,使用或接触到有关物质时应注意安全。请回答下列问题:
(1)新制氯水中,含有氯元素的微粒有___________ (填微粒符号,下同,不考虑水中杂质与氯气的反应),其中使新制氯水显淡黄绿色的微粒是___________ 。
(2) 和
和 可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中
可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中 和
和 的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为
的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为___________ L。
(3)标准状况下,氯气的密度为___________ 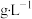 (结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是
(结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是___________ (填序号)。
a.逆风往高处跑 b.顺风往低处跑
c.用蘸有肥皂水的毛巾捂住口鼻 d.戴上用浓NaOH溶液处理过的口罩
(4)实验室制氯气时,要用NaOH溶液吸收尾气,反应的化学方程式为___________ ;通常不用澄清石灰水吸收氯气的原因是___________ 。
(1)新制氯水中,含有氯元素的微粒有
(2)
 和
和 可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中
可用于生产农药、催化剂等。31g红磷在一定量的氯气中燃烧,红磷和氯气均完全反应,生成白色烟雾,其中 和
和 的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为
的物质的量之比为3:2,则消耗的氯气在标准状况下的体积为(3)标准状况下,氯气的密度为
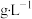 (结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是
(结果保留两位小数),比空气的密度大。某地施工时挖破了废弃自来水厂的储氯罐,导致氯气泄漏。当地居民逃生和自救的正确做法是a.逆风往高处跑 b.顺风往低处跑
c.用蘸有肥皂水的毛巾捂住口鼻 d.戴上用浓NaOH溶液处理过的口罩
(4)实验室制氯气时,要用NaOH溶液吸收尾气,反应的化学方程式为
您最近一年使用:0次
2022高一·全国·专题练习
8 . 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体上滴加一滴浓盐酸,再立即用表面皿盖好。
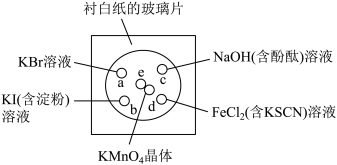
(1)e处反应的离子方程式为_______ 。该反应中发生反应的氧化剂和还原剂的物质的量之比为_______ 。
(2)b处的实验现象为_______ 。d处的实验现象为_______ 。
(3)c处反应的化学方程式为_______ 。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为_______ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?_______ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是_______ 。

(1)e处反应的离子方程式为
(2)b处的实验现象为
(3)c处反应的化学方程式为
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
您最近一年使用:0次
2022高三·全国·专题练习
9 . 实验室利用下图装置制备溴苯和硫酸锰。已知反应原理为MnO2 + 2NaBr + 2H2SO4 MnSO4+Na2SO4 +Br2↑+2H2O
MnSO4+Na2SO4 +Br2↑+2H2O
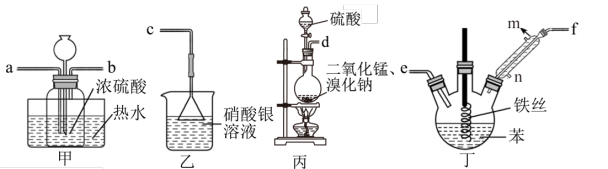
反应结束后,装置丁中液体因溶解了Br2而呈棕褐色,请用离子方程式表示洗去Br2的方法___________ ,干燥之后分离出产物溴苯的方法为___________ 。
 MnSO4+Na2SO4 +Br2↑+2H2O
MnSO4+Na2SO4 +Br2↑+2H2O
反应结束后,装置丁中液体因溶解了Br2而呈棕褐色,请用离子方程式表示洗去Br2的方法
您最近一年使用:0次
2022高三·全国·专题练习
10 . Cl2、SO2、NOx都是化工生产中的重要气体,均可用氨水或NaOH溶液处理,防止污染空气。请回答下列问题:
(1)化工厂可用浓氨水来检验Cl2是否泄漏(已知3Cl2+8NH3→6NH4Cl+N2),当有少量Cl2泄漏时,可以观察到的现象是_______ ,若反应中有0.08mol的氨气被氧化,则有_______ mol电子发生转移。
(2)①若用热烧碱溶液吸收Cl2气反应后的混合溶液中,含NaCl、NaClO和NaClO3物质的量比值为n:1:1,则n=_______ 。
②SO2是形成酸雨的主要原因,取某化工区空气样本用蒸馏水处理,检测所得溶液,所含离子及其浓度如下:
根据表中数据计算,检测的溶液pH=_______ 。
(3)NO2是燃油汽车尾气中的主要污染物之一、
①在催化剂和加热条件下,NO2与NH3可反应生成无害物质,请写出反应的化学方程式:_______ 。
②实验室可用烧碱溶液吸收NO2和NO,(已知2NO2+2NaOH→NaNO2+NaNO3+H2O,NO2+NO+2NaOH→2NaNO2+H2O),当消耗100mL0.5mol⋅L-1的烧碱溶液时,共吸收混合气体_______ L(标准状态)。
(1)化工厂可用浓氨水来检验Cl2是否泄漏(已知3Cl2+8NH3→6NH4Cl+N2),当有少量Cl2泄漏时,可以观察到的现象是
(2)①若用热烧碱溶液吸收Cl2气反应后的混合溶液中,含NaCl、NaClO和NaClO3物质的量比值为n:1:1,则n=
②SO2是形成酸雨的主要原因,取某化工区空气样本用蒸馏水处理,检测所得溶液,所含离子及其浓度如下:
| 离子 | Na+ | K+ | NH | H+ | SO | NO | Cl- |
| 浓度/(mol·L-1) | 6×10-6 | 4×10-6 | 2×10-5 | a | 4×10-5 | 2×10-5 | 3×10-5 |
(3)NO2是燃油汽车尾气中的主要污染物之一、
①在催化剂和加热条件下,NO2与NH3可反应生成无害物质,请写出反应的化学方程式:
②实验室可用烧碱溶液吸收NO2和NO,(已知2NO2+2NaOH→NaNO2+NaNO3+H2O,NO2+NO+2NaOH→2NaNO2+H2O),当消耗100mL0.5mol⋅L-1的烧碱溶液时,共吸收混合气体
您最近一年使用:0次



