解题方法
1 . 电子工业中,常用 溶液腐蚀铜(原理为:
溶液腐蚀铜(原理为: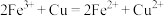 )制造印刷线路板。为了从腐蚀废液中回收铜并重新得到
)制造印刷线路板。为了从腐蚀废液中回收铜并重新得到 溶液,可以采用下列步骤:
溶液,可以采用下列步骤:
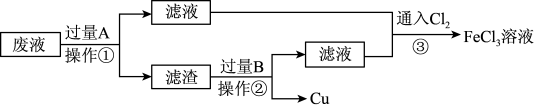
(1)上述过程中属于过滤操作的是_______ (填序号)。
(2)加入物质A生成单质 的离子方程式是
的离子方程式是_______ 。
(3)滤渣为混合物,物质B是_______ (用化学式表示),作用是_______ 。
(4)写出③中通入 反应的离子方程式为
反应的离子方程式为_______ 。
(5)检验 溶液中所含金属离子的实验操作和现象为:
溶液中所含金属离子的实验操作和现象为:_______ 。
(6)若加入A的物质的量为amol,整个操作过程中生成 的物质的量为bmol,若不考虑空气中氧气参与反应,请计算③至少消耗
的物质的量为bmol,若不考虑空气中氧气参与反应,请计算③至少消耗 的物质的量为
的物质的量为_______ mol。(用含a、b的代数式表示)
 溶液腐蚀铜(原理为:
溶液腐蚀铜(原理为: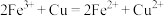 )制造印刷线路板。为了从腐蚀废液中回收铜并重新得到
)制造印刷线路板。为了从腐蚀废液中回收铜并重新得到 溶液,可以采用下列步骤:
溶液,可以采用下列步骤:
(1)上述过程中属于过滤操作的是
(2)加入物质A生成单质
 的离子方程式是
的离子方程式是(3)滤渣为混合物,物质B是
(4)写出③中通入
 反应的离子方程式为
反应的离子方程式为(5)检验
 溶液中所含金属离子的实验操作和现象为:
溶液中所含金属离子的实验操作和现象为:(6)若加入A的物质的量为amol,整个操作过程中生成
 的物质的量为bmol,若不考虑空气中氧气参与反应,请计算③至少消耗
的物质的量为bmol,若不考虑空气中氧气参与反应,请计算③至少消耗 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 化学小组探究 与
与 溶液的反应,实验如下:
溶液的反应,实验如下:
已知:经检验白色沉淀为
(1)实验ⅰ中发生的离子方程式为_______ 。
(2)实验ⅱ中检测到 ,依据的实验现象是
,依据的实验现象是_______ 。
(3)从平衡移动的原理解释实验ⅱ红色消失的原因_______ 。
(4)对实验ⅱ中 产生的原因作如下假设:
产生的原因作如下假设:
假设1:溶液中的 被_______氧化
被_______氧化
假设2: 与
与 的反应是一个可逆反应
的反应是一个可逆反应
假设3:在实验ⅱ的条件下, 被
被 氧化
氧化
请将假设1补充完整_______ 。
(5)设计实验验证假设。
实验ⅲ 取2mL溶液a,向其中滴加5滴0.1mol/L 溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
实验ⅳ 实验装置如下图所示,闭合开关K,电流计指针不动。向右侧 溶液中滴加0.1mol/L
溶液中滴加0.1mol/L ,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L
,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L ,溶液变红。
,溶液变红。_______ 。
②假设2不成立的实验证据是_______ 。
③实验证明假设3成立。
请结合电极反应式解释实验ⅱ中 产生的原因
产生的原因_______ 。
 与
与 溶液的反应,实验如下:
溶液的反应,实验如下:| 序号 | 实验方案 | 实验现象 |
| 实验ⅰ |
| 振荡试管,观察到溶液变为蓝色,待反应充分后,试管底部有 粉剩余。 粉剩余。 |
| 实验ⅱ | 取实验ⅰ中的上层清液,向其中滴加0.1mol/L 溶液 溶液 | 溶液局部变红,同时产生白色沉淀,振荡试管,红色消失。 |

(1)实验ⅰ中发生的离子方程式为
(2)实验ⅱ中检测到
 ,依据的实验现象是
,依据的实验现象是(3)从平衡移动的原理解释实验ⅱ红色消失的原因
(4)对实验ⅱ中
 产生的原因作如下假设:
产生的原因作如下假设:假设1:溶液中的
 被_______氧化
被_______氧化假设2:
 与
与 的反应是一个可逆反应
的反应是一个可逆反应假设3:在实验ⅱ的条件下,
 被
被 氧化
氧化请将假设1补充完整
(5)设计实验验证假设。
实验ⅲ 取2mL溶液a,向其中滴加5滴0.1mol/L
 溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。实验ⅳ 实验装置如下图所示,闭合开关K,电流计指针不动。向右侧
 溶液中滴加0.1mol/L
溶液中滴加0.1mol/L ,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L
,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1mol/L ,溶液变红。
,溶液变红。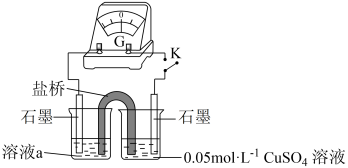
②假设2不成立的实验证据是
③实验证明假设3成立。
请结合电极反应式解释实验ⅱ中
 产生的原因
产生的原因
您最近一年使用:0次
2022-12-30更新
|
232次组卷
|
3卷引用:北京市延庆区2022-2023学年高二上学期期末考试化学试题
解题方法
3 . 纳米铜是一种性能优质的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图所示。

资料:肼(N2H4)无色油状液体,溶于水生成水合肼N2H4·H2O(水合肼有强还原性,生成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有______ 。
A.过滤和萃取 B.升高温度 C.增大压强 D.研磨矿石
②用FeCl3溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。浸取时,在有氧的环境下可维持Fe3+较高浓度,有关反应的离子方程式为_______ 。
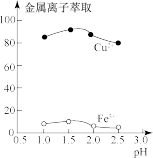
(2)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是______ 。
(3)“反萃取”得到的CuSO4溶液制备纳米铜粉时,Cu2+的还原率随pH和温度的变化如下表所示:
①该反应的离子方程式为_______ 。
②超过70℃时Cu2+的还原率降低的原因是______ 。
③以辉铜矿为原料制备纳米铜粉的工艺条件选择70℃、pH=10的理由是______ 。
(4)“水相1”中加入适量氨水,静置,再经过滤、_____ 、干燥、______ 等操作可得到Fe2O3。
(5)假设制得纳米铜的质量为akg,则最少投入肼的物质的量是______ 。

资料:肼(N2H4)无色油状液体,溶于水生成水合肼N2H4·H2O(水合肼有强还原性,生成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有
A.过滤和萃取 B.升高温度 C.增大压强 D.研磨矿石
②用FeCl3溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。浸取时,在有氧的环境下可维持Fe3+较高浓度,有关反应的离子方程式为
(2)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是

(3)“反萃取”得到的CuSO4溶液制备纳米铜粉时,Cu2+的还原率随pH和温度的变化如下表所示:
| pH | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Cu2+还原率(%) | 34 | 60 | 90 | 92 | 95 | 92 | 90 | |
| 产物形态 | 砖红色Cu2O | 铜粉 | 紫黑色纳米铜 | |||||
| 温度 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
| Cu2+还原率(%) | 25 | 45 | 70 | 80 | 95 | 90 | 85 | |
| 产物形态 | 砖红色Cu2O | 铜粉 | 紫黑色纳米铜 | |||||
①该反应的离子方程式为
②超过70℃时Cu2+的还原率降低的原因是
③以辉铜矿为原料制备纳米铜粉的工艺条件选择70℃、pH=10的理由是
(4)“水相1”中加入适量氨水,静置,再经过滤、
(5)假设制得纳米铜的质量为akg,则最少投入肼的物质的量是
您最近一年使用:0次
4 . 下列变化过程不涉及 氧化还原反应的是( )
| A | B | C | D |
| 氯化亚铁溶液中滴入氯水,溶液变黄 | 向FeCl2溶液中滴加KSCN溶液,不变色,滴加氯水后溶液显红色 | 向Na2SO3固体中加入硫酸,生成无色气体 | 向包有Na2O2粉末的脱脂棉上滴几滴蒸馏水,脱脂棉燃烧 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-10更新
|
100次组卷
|
3卷引用:北京市延庆区2021届高三上学期统测(9月)考试化学试题
5 . 为探究化学反应“2Fe3++2I-⇌2Fe2++I2”存在限度及平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如下:
回答下列问题:
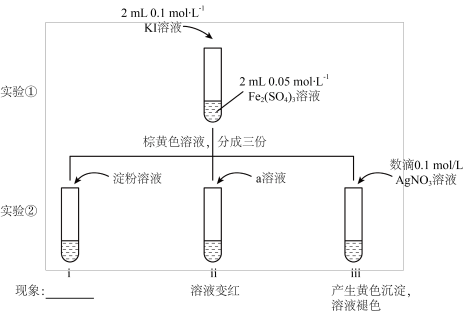
(1)甲同学利用实验②中i和ii证明Fe2(SO4)3溶液与KI溶液的反应存在限度,实验i中的现象是________ ,实验ii中a是________ (化学式)溶液。
(2)用离子方程式表示实验②iii中产生黄色沉淀的原因________ 。
Ⅱ.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究
【实验过程】
实验中溶液的透光率数据变化如图所示:

回答下列问题:
(3)乙同学实验③的目的是______ 。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是______ 。
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极),探究化学平衡移动与I-与Fe2+浓度及还原性强弱关系,操作过程如下:
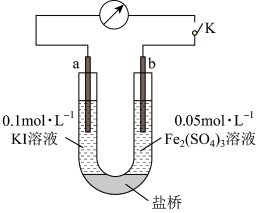
①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I—⇌2Fe2++I2向正反应方向进行,b作______ (填“正”或“负”)极,还原性I—>Fe2+。
②当指针归零(反应达到平衡)后,向U形管右管滴加0.1mol/LFeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+_____ I—(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,得出的结论有______ 。
已知:a.含I2的溶液呈黄色或棕黄色。b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如下:

回答下列问题:
(1)甲同学利用实验②中i和ii证明Fe2(SO4)3溶液与KI溶液的反应存在限度,实验i中的现象是
(2)用离子方程式表示实验②iii中产生黄色沉淀的原因
Ⅱ.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究
【实验过程】
| 序号 | 实验步骤1 | 实验步骤2 |
| 实验③ | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol·L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据 |
| 实验④ | 将盛有2mL0.1mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
| 实验⑤ | 将盛有2mL0.2mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |

回答下列问题:
(3)乙同学实验③的目的是
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极),探究化学平衡移动与I-与Fe2+浓度及还原性强弱关系,操作过程如下:

①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I—⇌2Fe2++I2向正反应方向进行,b作
②当指针归零(反应达到平衡)后,向U形管右管滴加0.1mol/LFeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+
(6)综合甲、乙两位同学的实验探究过程,得出的结论有
您最近一年使用:0次
6 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,不正确 的是
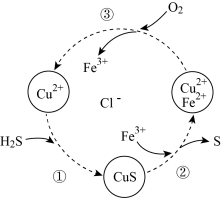

| A.过程①中,没有化合价的变化 |
| B.过程②中,发生反应为S2-+Fe3+=S+Fe2+ |
| C.过程③中,Fe2+作还原剂 |
| D.整个转化过程中Fe3+可以循环使用 |
您最近一年使用:0次
2020-07-09更新
|
551次组卷
|
5卷引用:北京市延庆区2019-2020学年高一下学期期末考试化学试题
北京市延庆区2019-2020学年高一下学期期末考试化学试题(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题甘肃省静宁县第一中学2020-2021学年高一下学期第一次月考化学(普)试题




