1 . 某学习小组进行了如图所示的实验,实验后组员之间的交流合理的是
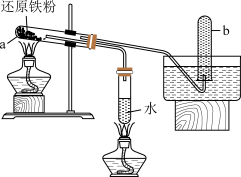

| A.甲同学认为将少量还原铁粉放入试管中,加适量的水,加热也可实现该反应 |
| B.乙同学认为反应结束后可用磁铁将剩余铁粉分离出来 |
| C.丙同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 |
| D.丁同学认为用盐酸溶解固体生成物后,滴加KSCN溶液,产生血红色沉淀 |
您最近一年使用:0次
名校
解题方法
2 . 某小组同学为探究 和
和 反应的程度,进行以下实验。已知:相关物质的
反应的程度,进行以下实验。已知:相关物质的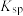 (25℃) AgCl:
(25℃) AgCl:
 :
:
(1)甲同学的实验如下:
注:经检验黑色固体为Ag。
①白色沉淀的化学式是___________ 。
②甲同学得出 氧化了
氧化了 的依据是
的依据是___________ 。
(2)乙同学为探究 和
和 反应的程度,进行实验Ⅱ。
反应的程度,进行实验Ⅱ。
a.按下图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
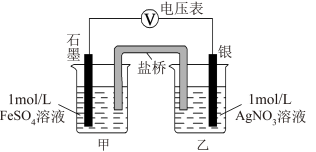
①a中甲烧杯里的电极反应式是___________ 。
②b中电压表指逆向偏移后,银为极___________ (填“正”或“负”)。
③由实验得出 和
和 反应的离子方程式是
反应的离子方程式是___________ 。
 和
和 反应的程度,进行以下实验。已知:相关物质的
反应的程度,进行以下实验。已知:相关物质的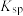 (25℃) AgCl:
(25℃) AgCl:
 :
:
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验1 | 将2mL | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是
②甲同学得出
 氧化了
氧化了 的依据是
的依据是(2)乙同学为探究
 和
和 反应的程度,进行实验Ⅱ。
反应的程度,进行实验Ⅱ。a.按下图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓
 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是
②b中电压表指逆向偏移后,银为极
③由实验得出
 和
和 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
2022-12-04更新
|
130次组卷
|
2卷引用:山西省大同市2022-2023学年高二上学期期末考试化学试题
解题方法
3 . A、B、C为中学化学常见的单质,其中只有一种为金属;通常情况下,A为固体,B、C为气体。D、E、F、G、H、X均为化合物,其中X是一种实验室常见的无氧酸且为强酸。E为黑色固体,F含有四种元素,H在常温下为液体,它们之间的转化关系如图所示(其中某些反应的条件已略去)。
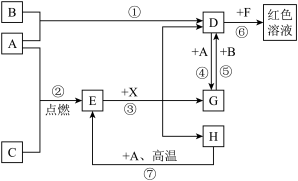
回答下列问题:
(1)B的化学式为____ ,F中的非金属元素的原子半径由大到小的顺序是____ (用元素符号表示)。
(2)在反应①~⑦中,不属于氧化还原反应的是____ (填编号)。
(3)反应⑦的化学方程式为____ ,该反应中每生成2.32g化合物E,转移电子的物质的量为____ mol。
(4)水溶液中,反应⑤的离子方程式为____ 。
(5)D的水溶液与金属铜反应的离子方程式为____ 。

回答下列问题:
(1)B的化学式为
(2)在反应①~⑦中,不属于氧化还原反应的是
(3)反应⑦的化学方程式为
(4)水溶液中,反应⑤的离子方程式为
(5)D的水溶液与金属铜反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 常温下,下列各组离子一定能在指定溶液中大量共存的是
A.在pH >7的溶液中:Fe3+、K+、Cl-、SO |
B.滴加KSCN溶液显红色的溶液中:NH 、K+、Cl-、I- 、K+、Cl-、I- |
C.c(OH-)/c(H+)=10-12的溶液中:NH 、Cu2+、NO 、Cu2+、NO 、SO 、SO |
D.水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO |
您最近一年使用:0次
2022-11-12更新
|
344次组卷
|
6卷引用:第三章 实验活动2 铁及其化合物的性质 期末备考复习 2023-2024学年高一上学期化学人教版(2019)必修第一册
名校
解题方法
5 . 下列除去杂质的操作中,所用试剂、方法能达到目的的是
| 选项 | 物质(括号内为杂质) | 除杂试剂、方法 |
| A |  粉 粉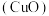 | 加入稀硝酸,溶解、过滤、洗涤、干燥 |
| B | 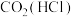 | 依次通入饱和 溶液、浓硫酸 溶液、浓硫酸 |
| C |  溶液 溶液 | 加入过量 粉,过滤 粉,过滤 |
| D | 乙醇蒸气 | 依次通入酸性高锰酸钾溶液、无水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 用KI溶液和FeCl3溶液进行如下实验(提示:1mL约为20滴),下列说法中错误的是


A.实验i发生的反应为:2Fe3++2I— 2Fe2++I2 2Fe2++I2 |
| B.黄色溶液中含有Fe2+、Fe3+、Cl—、K+、I—离子 |
| C.实验iii水溶液中c(Fe2+)大于i中c(Fe2+) |
| D.若向实验iii所得水溶液中滴加与实验ii等浓度等体积的KSCN溶液,水层红色比实验ii深 |
您最近一年使用:0次
2022-11-08更新
|
317次组卷
|
4卷引用:山西省晋城市第一中学校2023-2024学年高二上学期第五次调研考试化学试题
名校
7 . I、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+ NaOH + Cl2→ Na2FeO4+ NaNO3+ NaCl + H2O
(1)高铁酸钠中,铁元素的化合价是_______ ;上述制取铁酸钠的反应中,铁元素被_______ (填“还原”或“氧化”)。
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为_______ 。
②除去FeCl3溶液中混有的FeCl2可加入或通入_______ 。
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
②从分类来看,NaH2PO2属于_______ 。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式_______ 。
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为
②除去FeCl3溶液中混有的FeCl2可加入或通入
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
您最近一年使用:0次
2022-10-31更新
|
145次组卷
|
2卷引用:山西省晋城市第一中学校2022-2023学年高一下学期4月期中考试化学试题
名校
解题方法
8 . 柠檬酸亚铁(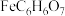 )是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为
)是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为 )为原料,制备柠檬酸亚铁,其流程如下:
)为原料,制备柠檬酸亚铁,其流程如下:

回答下列问题:
(1)在空气中焙烧时产生对环境有危害的气体是_______ (填化学式);培烧后得到的固体主要成分为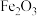 ,焙烧时反应的化学方程式是
,焙烧时反应的化学方程式是_______ 。
(2)滤渣1的成分为_______ (填化学式)。
(3)“还原”过程中与 有关的离子方程式为
有关的离子方程式为_______ ;加入Fe粉还原后,可用_______ (填试剂)检验还原反应是否已经完全反应。
(4)“沉铁”时,反应温度不宜太高的可能原因是_______ 。
(5)生成的 固体需充分洗涤,检验洗涤是否完全的方法是
固体需充分洗涤,检验洗涤是否完全的方法是_______ 。
(6)将制得的 加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是
加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是_______ 。
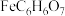 )是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为
)是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为 )为原料,制备柠檬酸亚铁,其流程如下:
)为原料,制备柠檬酸亚铁,其流程如下:
回答下列问题:
(1)在空气中焙烧时产生对环境有危害的气体是
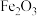 ,焙烧时反应的化学方程式是
,焙烧时反应的化学方程式是(2)滤渣1的成分为
(3)“还原”过程中与
 有关的离子方程式为
有关的离子方程式为(4)“沉铁”时,反应温度不宜太高的可能原因是
(5)生成的
 固体需充分洗涤,检验洗涤是否完全的方法是
固体需充分洗涤,检验洗涤是否完全的方法是(6)将制得的
 加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是
加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是
您最近一年使用:0次
2022-10-14更新
|
178次组卷
|
2卷引用:山西省长治市、忻州市2022-2023学年高二上学期10月月考化学试题
9 .  俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分:
俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分: 、
、 、FeO、
、FeO、 )制备绿矾流程如下:
)制备绿矾流程如下:

已知:① 难溶于水,能还原
难溶于水,能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。
②金属离子生成氢氧化物沉淀的pH范围见下表:
(1)提高“酸浸”速率的措施有___________ (任写一点即可):写出滤渣Ⅰ与某种酸反应的化学方程式___________ ;滤渣Ⅱ经灼烧后可用于___________ (写出一种用途即可)。
(2)写出“还原”步骤中涉及反应的离子方程式___________ 。
(3)“除铝”需控制的pH范围是___________ 。
(4)“酸化”步骤中加入稀硫酸的目的是___________ 。操作Ⅲ为___________ ;“洗涤”时的试剂最好选用下列中的___________ (填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有 :
:___________ 。
 俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分:
俗名绿矾,可用于制铁盐、氧化铁颜料、净水剂、消毒剂等。由硫铁矿烧渣(主要成分: 、
、 、FeO、
、FeO、 )制备绿矾流程如下:
)制备绿矾流程如下:
已知:①
 难溶于水,能还原
难溶于水,能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。②金属离子生成氢氧化物沉淀的pH范围见下表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 1.5 | 3.2 |
 | 3.0 | 5.0 |
 | 6.3 | 8.3 |
(1)提高“酸浸”速率的措施有
(2)写出“还原”步骤中涉及反应的离子方程式
(3)“除铝”需控制的pH范围是
(4)“酸化”步骤中加入稀硫酸的目的是
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有
 :
:
您最近一年使用:0次
名校
10 . 下列由实验操作、实验现象不能得出相应实验结论的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中可能含 |
| B | 将金属钠置于燃烧匙中,点燃后迅速伸入装满 的集气瓶中 的集气瓶中 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |  具有氧化性 具有氧化性 |
| C | 向 溶液中滴加少量KI溶液,继续加入少量苯,振荡,静置,分液,向下层溶液中滴入 溶液中滴加少量KI溶液,继续加入少量苯,振荡,静置,分液,向下层溶液中滴入 溶液 溶液 | 静置时,上层溶液显紫红色;向下层溶液中滴入 溶液后产生白色沉淀 溶液后产生白色沉淀 |  与KI的反应是有一定限度的 与KI的反应是有一定限度的 |
| D | 往新制氯水中滴加几滴紫色石蕊试液 | 溶液先变红后褪色 | 新制氯水显酸性且具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-29更新
|
178次组卷
|
3卷引用:山西省忻州市2022-2023学年高三上学期第二次联考化学试题

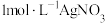 溶液加入到
溶液加入到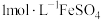 溶液中
溶液中

