解题方法
1 . 有三种金属单质A、B、C,其中A的焰色实验为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题:
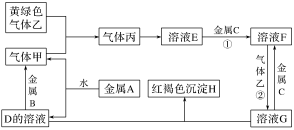
(1)写出下列物质的化学式:乙_______ 、H_______ ;
(2)写出反应②的离子方程式:_______
(3)写出气体甲与乙反应的化学方程式:_______
(4)F与D溶液反应后的产物在空气中转化为H的现象为_______ 。

(1)写出下列物质的化学式:乙
(2)写出反应②的离子方程式:
(3)写出气体甲与乙反应的化学方程式:
(4)F与D溶液反应后的产物在空气中转化为H的现象为
您最近一年使用:0次
2 . 下列有关金属及其化合物的说法错误的是
| A.铁丝在氯气中剧烈燃烧,生成FeCl2 | B.配制FeSO4溶液时加入少量的铁粉 |
| C.Fe(OH)2在空气中易被氧化成红褐色的Fe(OH)3 | D. 可用于制作红色油漆或涂料 可用于制作红色油漆或涂料 |
您最近一年使用:0次
2022-10-05更新
|
622次组卷
|
3卷引用:云南省保山市高(完)中C、D类学校2022-2023学年高二上学期10月份联考化学试题
3 . 下列物质之间有如下反应关系:

已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:A_______ ,B_______ ,D_______ ,乙_______ ,丙_______ 。
(2)写出E→C反应的化学方程式:_______ 。写出D→B反应的化学方程式:_______ 。

已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:A
(2)写出E→C反应的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 某工厂废液中含有氯化钠、氯化铜和氯化亚铁,已知:Fe(OH)2和Fe(OH)3难溶于水。某研究性学习小组的同学拟从该废液中回收铜,并获得副产品铁红(主要成分Fe2O3),要求实验过程中不引入其它金属元素,其实验方案的设计如图所示:
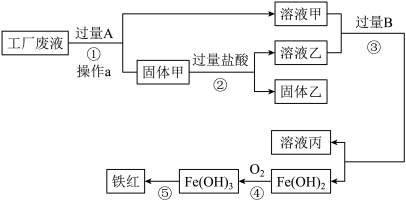
请回答下列问题:
(1)操作a的名称为____ ;试剂B是____ 。
(2)用化学式表示固体甲的成分____ 。
(3)溶液甲中的金属离子是____ (用离子符号表示)。
(4)完成步骤④的化学方程式____ 。

请回答下列问题:
(1)操作a的名称为
(2)用化学式表示固体甲的成分
(3)溶液甲中的金属离子是
(4)完成步骤④的化学方程式
您最近一年使用:0次
名校
解题方法
5 . 工业废水中含有重铬酸根离子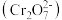 有毒,必须处理达标后才能排放。工业上常用绿矾
有毒,必须处理达标后才能排放。工业上常用绿矾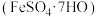 做处理剂,反应的离子方程式为:
做处理剂,反应的离子方程式为: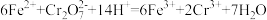 ,下列说法
,下列说法不正确 的是
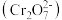 有毒,必须处理达标后才能排放。工业上常用绿矾
有毒,必须处理达标后才能排放。工业上常用绿矾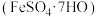 做处理剂,反应的离子方程式为:
做处理剂,反应的离子方程式为: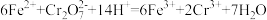 ,下列说法
,下列说法| A.将绿矾水溶液久置于空气中,滴加几滴KSCN溶液,溶液出现血红色 |
B.配制好的 溶液,为防止变质可向溶液中加入少量铁粉 溶液,为防止变质可向溶液中加入少量铁粉 |
C.每处理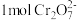 转移 转移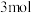 电子 电子 |
D.向 溶液中加入 溶液中加入 溶液一段时间后,沉淀会变成红褐色 溶液一段时间后,沉淀会变成红褐色 |
您最近一年使用:0次
2022-06-24更新
|
542次组卷
|
4卷引用:云南省昭通市等4地2023-2024学年高二上学期12月月考化学试题
云南省昭通市等4地2023-2024学年高二上学期12月月考化学试题浙江省湖州市2021-2022学年高一下学期期末考试化学试题浙江省舟山市普陀中学2023届高三返校考试化学试题(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题
名校
解题方法
6 . 化合物A、B组成元素相同,且B为白色,C是一种与B含有相同价态该金属元素的硫酸盐,向C中加入适量的氢氧化钠溶液,可观察到生成的沉淀迅速变为灰绿色,最后变为红褐色沉淀A,加热A可得红棕色粉末D。回答下列问题:
(1)写出各物质的化学式:A_______ 、B_______ 、C_______ 、D_______ 。
(2)写出B转化为A的化学方程式:_______ 。
(3)写出A受热分解的化学方程式:_______ 。
(1)写出各物质的化学式:A
(2)写出B转化为A的化学方程式:
(3)写出A受热分解的化学方程式:
您最近一年使用:0次
名校
7 . 某班同学分成A、B两组,并分别设计如下实验探究能较长时间观察到Fe(OH)2沉淀的制取方法。回答下列问题:
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)
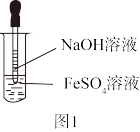
(1)检验FeSO4是否变质的方法是:____ ;若FeSO4已变质,可加入过量_____ 将其还原,发生反应的离子方程式为:____ 。
(2)配制NaOH溶液所用的蒸馏水应除去溶解的O2,采用的方法是______ 。
(3)该方法制备的Fe(OH)2沉淀不能长期稳定存在,易被空气中的O2氧化,发生反应的现象是:___ ;发生反应的化学方程式是_____ 。
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图2。
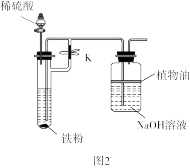
(4)实验时,先____ (填“打开”或“关闭”)止水夹K,然后打开____ 的玻璃塞和活塞,使稀硫酸与铁粉反应。
(5)当_____ 后,____ (填“打开”或“关闭”)止水夹K,制得Fe(OH)2沉淀,且沉淀能一段时间不变色。
(6)B组实验比A组实验制得的Fe(OH)2能更长时间稳定存在的原因是:____ 。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)

(1)检验FeSO4是否变质的方法是:
(2)配制NaOH溶液所用的蒸馏水应除去溶解的O2,采用的方法是
(3)该方法制备的Fe(OH)2沉淀不能长期稳定存在,易被空气中的O2氧化,发生反应的现象是:
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图2。

(4)实验时,先
(5)当
(6)B组实验比A组实验制得的Fe(OH)2能更长时间稳定存在的原因是:
您最近一年使用:0次
8 . 用下面几种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入少量铁屑,原因是_____ 。
(2)除去蒸馏水中溶解的O2常采用_____ 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____ 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(4)在试管I里加入的试剂是_____ 。
(5)在试管II里加入的试剂是_____ 。
(6)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____ 。
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____ 。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入少量铁屑,原因是
(2)除去蒸馏水中溶解的O2常采用
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(4)在试管I里加入的试剂是
(5)在试管II里加入的试剂是
(6)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
您最近一年使用:0次
2022-02-09更新
|
159次组卷
|
10卷引用:云南省巧家县四中2018-2019学年高一上学期12月份考试化学试题
云南省巧家县四中2018-2019学年高一上学期12月份考试化学试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试2贵州省钟山区水钢实验学校2017-2018学年高一下学期期末考试化学试题(已下线)2018年11月8日 ——《每日一题》人教必修1铁的氢氧化物的性质和制备【全国百强校】山西省太原市第五中学2018-2019学年高一上学期12月月考化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题河北省石家庄市行唐县三中2020届高三11月月考化学试题安徽省芜湖市严桥中学2019-2020学年高三第一学期第三次月考化学试题(已下线)5.2.2 重要的金属化合物(第2课时)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)山西太原五中2023-2024学年高一上学期12月阶段性检测化学试题
名校
解题方法
9 . 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
| A.②③①④ | B.③②①④ | C.③①②④ | D.①②③④ |
您最近一年使用:0次
2022-01-13更新
|
1247次组卷
|
83卷引用:云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题
云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题 云南省玉溪第一中学2022-2023学年高一下学期期中考试化学试题云南省大理白族自治州实验中学2020-2021学年高一上学期12月月考化学试题(已下线)2010年广东省湛江二中高二第二学期期中考试化学(文)试题(已下线)2010年湖南省浏阳一中高一上学期第三次阶段性测试化学卷(已下线)2010—2011学年湖北省沙市中学高一上学期期末考试化学试卷(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2012-2013学年山东省济宁市汶上一中高一3月质量检测化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年山西省晋中市昔阳中学高二下学期期末考试化学试卷(已下线)2012-2013学年辽宁省铁岭市六校第一次联合考试化学试卷(已下线)2013-2014学年江苏省宿迁市高一上学期第二次月考化学试卷(已下线)2015届甘肃省天水市秦安县二中高三上学期期中考试化学试卷2014-2015黑龙江省哈尔滨六中高一12月月考化学试卷2014-2015湖南省浏阳一中等三校高一12月联考化学试卷2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷14-15内蒙古北方重工业集团三中高一上学期期末化学试卷2014-2015广东省深圳市南山区上学期高一化学期末试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高一上期末化学卷2015-2016学年广东省肇庆市高一上学期期末考试化学试卷2015-2016学年黑龙江省绥棱一中高二6月月考化学试卷2015-2016学年甘肃省甘谷一中高一上期末化学试卷2017届辽宁省铁岭市高三上学期第一次联考化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷2016-2017学年江西省南昌市第二中学高一上学期期末考试化学试卷2016-2017学年黑龙江省鸡西市第十九中学高一上学期期末考试化学试卷辽宁省大石桥市第二高级中学2016-2017学年高二学业水平模拟测试化学试题青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1湖北省荆州中学2017-2018学年高一12月月考化学试题湖南省醴陵市第一中学2017-2018学年高一上学期第二次月考(12月)化学试题湖北省宜昌市葛洲坝中学2017-2018学年高一12月月考化学试题湖北省宜昌市长阳县第一高级中学2017-2018学年高一12月月考化学试题安徽省淮南市第二中学2017-2018学年高一上学期第二次月考化学试题新疆昌吉市2017-2018学年高一上学期期末考试化学试题天津市红桥区2017-2018学年高一上学期期末考试化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题【全国百强校】青海省平安县第一高级中学2017-2018学年高一下学期期中考试(A卷)化学试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试2【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(文)上学期10月月考化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题河南省信阳市第六高级中学2018-2019学年高一上学期第三次(1月)月考化学试题山西省晋中市平遥县第二中学2018-2019学年高一上学期12月月考化学试题陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题新疆石河子第二中学2018-2019学年高一上学期期末考试化学试题内蒙古开来中学2018-2019学年高二下学期期末考试化学试题辽宁省实验中学东戴河分校2020届高三上学期期初摸底考试化学试题黑龙江省佳木斯市汤原高级中学2018-2019学年高二下学期期末考试化学试题江西省赣州市会昌中学2019-2020学年高一上学期第二次月考化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高一12月月考化学试题北京市昌平区新学道临川学校2019-2020学年高一上学期期末考试化学试题福建省泉州第五中学苏教版高中化学必修1专题3 单元综合练习安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(15)江西省上饶市2019-2020学年高一上学期期末考试 化学(自招班)试题天津市西青区2019-2020学年高一上学期期末考试化学试题(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》陕西省咸阳市实验中学2019-2020学年高一上学期第三次月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第六次综合测试化学试题人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题黑龙江省鸡东县第二中学2020-2021学年高一上学期中考试化学试卷宁夏石嘴山市平罗中学2020-2021学年高一上学期第三次月考化学试题天津市东丽区2020-2021学年高一上学期期末考试化学试题吉林省长春市第二十中学2020-2021学年高一上学期第三次考试化学试题广西南宁市英华学校2020-2021学年高一上学期期末考试化学试题(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)吉林省长春市农安县2021-2022学年高一上学期期末考试化学试题新疆哈密市第八中学2021-2022学年高一上学期期末考试化学试题陕西省西安市阎良区关山中学2021-2022学年高一上学期第三次质量检测化学(理科)试题安徽省宿州市北方中学2021-2022学年高一上学期期末测试化学试题2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(四)2023年广东省普通高中学业水平合格性考试化学科模拟仿真卷(一)天津市新华中学2022-2023学年高一上学期期末考试化学试题(已下线)专题九 铁及其化合物(已下线)合格考真题汇编8金属元素及其化合物二天津北京师范大学静海附属学校2023-2024学年高一上学期第三次月考化学试题
解题方法
10 . Na、Fe、Al是中学化学常见的金属元素。回答下列问题:
(1)焰色反应的实验中,Na元素燃烧时的焰色为_______ 色 ,观察K元素燃烧时的焰色需要透过_______ 。
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是_______ ;反应化学方程式为_______ 。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打 (NaHCO3)能治疗胃酸过多,请写出其反应的离子方程式_______ ;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是_______ ;此时最好用含氢氧化铝的胃药(如胃舒平),反应的离子方程式为_______ 。
(1)焰色反应的实验中,Na元素燃烧时的焰色为
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打 (NaHCO3)能治疗胃酸过多,请写出其反应的离子方程式
您最近一年使用:0次
2021-09-03更新
|
190次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题



