名校
1 . 金属及非金属在高中化学中占有重要地位。
(1)某研究小组通过实验探究Cu及其化合物的性质,操作正确且实验结论正确的是___ 。
A.常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液变为蓝色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不能损伤铜器
(2)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5mol·L-1Na2SO3、0.5mol·L-1NaOH溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用NaOH溶液洗涤至无Cl-。
①检测洗涤液中Cl-的方法是___ 。
②脱氯反应:FeOCl+OH-=FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl与FeO(OH)溶解度的大小:__ 。
③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是__SO +__FeO(OH)=__SO
+__FeO(OH)=__SO +___Fe3O4+__H2O(将反应补充完全)。
+___Fe3O4+__H2O(将反应补充完全)。___
(3)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如图。
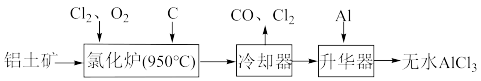
①氯化炉中,Al2O3、Cl2和C反应中的氧化产物是___ (填化学式)。
②流程中需要向升华器内加入少量Al,其作用是___ 。
(1)某研究小组通过实验探究Cu及其化合物的性质,操作正确且实验结论正确的是
A.常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液变为蓝色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不能损伤铜器
(2)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5mol·L-1Na2SO3、0.5mol·L-1NaOH溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用NaOH溶液洗涤至无Cl-。
①检测洗涤液中Cl-的方法是
②脱氯反应:FeOCl+OH-=FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl与FeO(OH)溶解度的大小:
③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是__SO
 +__FeO(OH)=__SO
+__FeO(OH)=__SO +___Fe3O4+__H2O(将反应补充完全)。
+___Fe3O4+__H2O(将反应补充完全)。(3)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如图。
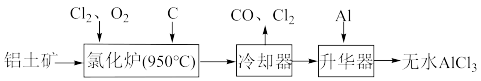
①氯化炉中,Al2O3、Cl2和C反应中的氧化产物是
②流程中需要向升华器内加入少量Al,其作用是
您最近半年使用:0次
名校
解题方法
2 . 氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究。下列说法不正确的是
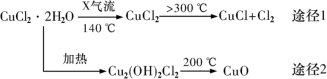
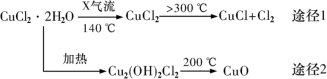
| A.途径1中产生的Cl2可以回收循环利用 |
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
C.CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++SO =2Cu2++2Cl-+SO2↑+2H2O =2Cu2++2Cl-+SO2↑+2H2O |
| D.X气体是HCl,目的是抑制CuCl2•2H2O加热过程可能的水解 |
您最近半年使用:0次
2021-03-17更新
|
478次组卷
|
14卷引用:江西省南昌市第二中学2020届高三第四次月考化学试题
江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题江西省南昌市进贤一中2019-2020学年高一上学期第二次月考化学试题江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题浙江省宁波市效实中学2020届高三上学期第一次模拟考试化学试题山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题2020届高三《新题速递·化学》12月第02期(考点01-06)黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题浙江省宁波市慈溪市2021届高三适应性测试化学试题北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题浙江省淳安县汾口中学2020-2021学年高二3月月考化学试题
3 . 久置空气中会发生颜色变化,但颜色变化是由于跟氧气反应引起的物质是
| A.硫酸亚铁晶体 | B.硫酸铜晶体 | C.过氧化钠固体 | D.氯水 |
您最近半年使用:0次
2021-02-24更新
|
133次组卷
|
2卷引用:江西省上饶市2020-2021学年高一上学期期末教学质量测试化学试题
名校
解题方法
4 . 某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+=Cu+Cu2++H2O)。
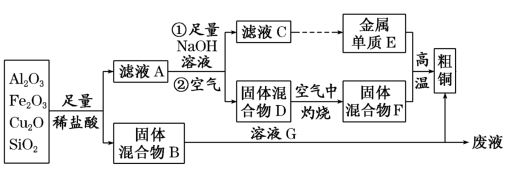
(提示:粗铜为不纯的铜)
(1)滤液A中铁元素的存在形式为_______ (填离子符号),生成该离子的离子方程式为_______ ,检验滤液A中存在该离子的试剂为_______ (填试剂名称) 。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______ 。
(3)高温时,SiO2与焦炭反应制得单质Si,写出其化学方程式_______ 。
(4)溶液G常用于刻蚀玻璃,则溶液G与混合物B发生反应的离子方程式是_______ 。

(提示:粗铜为不纯的铜)
(1)滤液A中铁元素的存在形式为
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为
(3)高温时,SiO2与焦炭反应制得单质Si,写出其化学方程式
(4)溶液G常用于刻蚀玻璃,则溶液G与混合物B发生反应的离子方程式是
您最近半年使用:0次
名校
5 . 工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,在空气中煅烧冰铜时,产生一种有刺激性气味的气体A,该气体排放到空气中,会对空气形成严重污染。

完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的__ (填序号)吸收。
a.浓硫酸 b.浓硝酸 c.氢氧化钠溶液 d.石灰乳
(2)已知Al能将某些金属从其氧化物中置换出来,将铝与泡铜高温反应可制得粗铜,制取该粗铜的化学方程式是________________________________ 。当转移电子数为6NA时,理论上消耗Al的质量为_______ g。
(3)SO2气体和H2S气体反应可生成单质硫,现有SO2和H2S混合气体2.0 mol,当所得到的氧化产物比还原产物多16克时,则混合气体中H2S的物质的量可能为:__________________ 。
(4)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 g Al2O3固体。加热过程中,固体质量随时间的变化如图2所示。
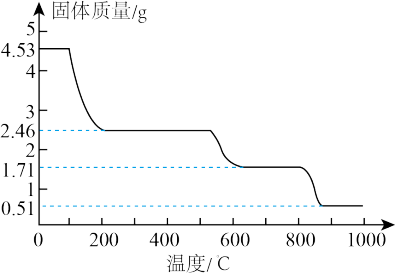
试通过计算确定400℃剩余固体成分的化学式________________ 。(写出计算过程)

完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的
a.浓硫酸 b.浓硝酸 c.氢氧化钠溶液 d.石灰乳
(2)已知Al能将某些金属从其氧化物中置换出来,将铝与泡铜高温反应可制得粗铜,制取该粗铜的化学方程式是
(3)SO2气体和H2S气体反应可生成单质硫,现有SO2和H2S混合气体2.0 mol,当所得到的氧化产物比还原产物多16克时,则混合气体中H2S的物质的量可能为:
(4)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 g Al2O3固体。加热过程中,固体质量随时间的变化如图2所示。

试通过计算确定400℃剩余固体成分的化学式
您最近半年使用:0次
2021-02-02更新
|
268次组卷
|
3卷引用:江西省吉安市遂川中学2023届高三一模考试化学试题
解题方法
6 . 下列物质转化在给定条件下能实现的是
A.饱和 |
B.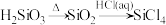 |
C.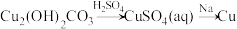 |
D.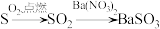 |
您最近半年使用:0次
名校
解题方法
7 . 中华优秀传统文化涉及很多化学知识,下列有关说法错误的是
| A.《本草纲目》记载的“金刚石”与“石墨”都属于碳元素的同素异形体 |
| B.古剑“以剂钢为刃,柔铁为茎干,不尔则多断折”中“剂钢”是铁合金 |
| C.古代湿法炼铜“曾青得铁则化为铜”中矿石“曾青”的主要成分为CuO |
| D.“灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是K2CO3 |
您最近半年使用:0次
2021-02-02更新
|
1057次组卷
|
5卷引用:江西省赣州市瑞金第一中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
8 . 生活是化学的源泉。下列叙述错误的是
| A.75%浓度的酒精、含氯消毒剂均可以有效灭活新型冠状病毒 |
| B.许多食品包装盒里用小袋包装的铁粉来防止食品氧化变质 |
| C.生产宇航服所用的碳化硅陶瓷和碳纤维材料,是一种新型无机非金属材料 |
| D.可溶性铜盐有毒,故人体内不存在铜元素 |
您最近半年使用:0次
2021-01-29更新
|
83次组卷
|
2卷引用:江西省贵溪市实验中学2020-2021学年高一上学期期末考试化学(A)试题
名校
9 . 人工泳池水质须符合CJ/T244-2016标准,为此在泳池里需要加入某些化学品。下列做法错误的是
| A.用明矾作净水剂 | B.用硫酸铜作杀藻剂 |
| C.用氯化钠作pH 调节剂 | D.用次氯酸钠作消毒剂 |
您最近半年使用:0次
2021-01-25更新
|
894次组卷
|
10卷引用:江西省丰城市第九中学2021-2022学年高三上学期第一次月考(日新部)化学试题
江西省丰城市第九中学2021-2022学年高三上学期第一次月考(日新部)化学试题江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷重庆市2021年普通高中学业水平选择考适应性测试化学试题福建省泉州一中2020-2021学年高三上学期期末化学试题江苏省盐城市东台创新高级中学2020-2021学年高二4月份月检测化学试题浙江省舟山市2020-2021学年高二下学期期末检测化学试题(已下线)第三章能力提升检测卷-2022年高考化学一轮复习讲练测宁夏固原市第一中学2023届高三上学期第二次月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高三上学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2023-2024学年高三上学期12月份考试化学试题
名校
解题方法
10 . 查阅资料得知:海绵铜主要成分是Cu,CuCl是一种微溶于乙醇,难溶于水的白色固体,在潮湿的空气中易转化为Cu2(OH)3Cl。
(1)下图是某化工厂制备氯化亚铜的流程:
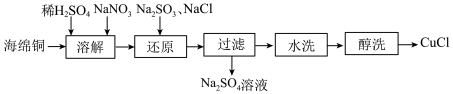
①“溶解”步骤主要反应的离子方程式为_____ ;
②醇洗的目的是______ ;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20,要使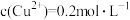 的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的
的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的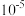 )则应调节溶液pH为
)则应调节溶液pH为______ 以上。
(2)已知次磷酸(H3PO2)是一元中强酸。
①次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:______ ;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银______ g;
(1)下图是某化工厂制备氯化亚铜的流程:

①“溶解”步骤主要反应的离子方程式为
②醇洗的目的是
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20,要使
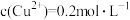 的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的
的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的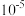 )则应调节溶液pH为
)则应调节溶液pH为(2)已知次磷酸(H3PO2)是一元中强酸。
①次磷酸钡是一种溶于水的强电解质,向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的离子方程式:
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。0.1molH3PO2能还原出金属银
您最近半年使用:0次
2021-01-21更新
|
181次组卷
|
2卷引用:江西省吉安市第一中学2022-2023学年高一上学期期末考试化学试题



