名校
1 . 下列常见物质的俗名与化学式相对应的是
| A.纯碱-NaOH | B.漂白粉-NaClO |
| C.胆矾-CuSO4·5H2O | D.大理石-Ca(OH)2 |
您最近半年使用:0次
2021-01-14更新
|
76次组卷
|
2卷引用:江西省峡江中学2022-2023学年高一上学期1月期末考试化学试题
名校
解题方法
2 . 氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜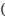 主要成分是Cu,含有少量CuO为原料生产CuCl,其工艺流程如图:
主要成分是Cu,含有少量CuO为原料生产CuCl,其工艺流程如图:
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
__ Cu+___ NO +
+___ =___ Cu2++___ NO↑+___ H2O
(2)“还原”过程中,作还原剂的是SO ,氧化产物SO
,氧化产物SO ;写出“还原”过程中发生反应的离子方程式:
;写出“还原”过程中发生反应的离子方程式:___ 。
(3)写出CuCl在潮湿的空气中被氧化的化学方程式:__ 。
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是___ 。
 主要成分是Cu,含有少量CuO为原料生产CuCl,其工艺流程如图:
主要成分是Cu,含有少量CuO为原料生产CuCl,其工艺流程如图:
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
 +
+(2)“还原”过程中,作还原剂的是SO
 ,氧化产物SO
,氧化产物SO ;写出“还原”过程中发生反应的离子方程式:
;写出“还原”过程中发生反应的离子方程式:(3)写出CuCl在潮湿的空气中被氧化的化学方程式:
(4)析出的CuCl晶体水洗后要立即用无水酒精洗涤,并在真空干燥机内于70℃下干燥2h,冷却密封包装。密封包装的原因是
您最近半年使用:0次
3 . 硫酸铜是一种常见的化工产品,它在纺织、印染、 医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
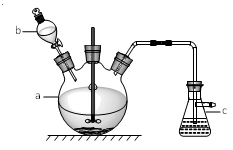
①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为_______ ;
(2)写出仪器a中反应的离子方程式:____________________ 。
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是_______________ 。
(4)为提高尾气吸收,防止空气污染,下列装置___________ (填字母)适合吸收逸出的气体(反应中产生的气体因来不及被石灰乳吸收而逸出)。

(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:___________ 。除去硫酸铜晶体中的少量硝酸铜可采用重结晶方法,检验硝酸铜是否被除净的方法:__________________ 。
(6)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成 100 mL 溶液,每次取 20. 00 mL,用 c mol • L-1 EDTA (H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。 滴定反应为Cu2++ H2Y2-→CuY2-+2H+。计算蓝色晶体中Cu2+质量分数w=____ 。

①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为
(2)写出仪器a中反应的离子方程式:
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是
(4)为提高尾气吸收,防止空气污染,下列装置

(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:
T/K | 273 | 293 | 313 | 333 | 353 | 373 | |
溶解度/ (g/100 g) | 五水硫酸铜 | 23.1 | 32.0 | 44.6 | 61.8 | 83.8 | 114.0 |
硝酸铜 | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 | |
您最近半年使用:0次
名校
解题方法
4 . 氢气是一种绿色能源,大力开发氢能有利于环境保护。借助Cu/CuCl热化学循环制氢:2H2O=2H2↑+O2↑,其工艺流程如图。下列有关说法正确的是
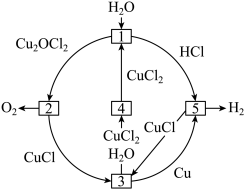

| A.步骤①中发生的反应属于放热反应 |
B.步骤②的温度为500℃,则反应的化学方程式为2Cu2OCl2 4CuCl+O2↑ 4CuCl+O2↑ |
| C.步骤③可在电解池中进行,Cu是氧化产物 |
| D.反应⑤一定是依据原电池原理实现的 |
您最近半年使用:0次
5 . 某废催化剂含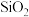 、ZnS、CuS及少量的
、ZnS、CuS及少量的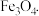 某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )
某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )
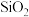 、ZnS、CuS及少量的
、ZnS、CuS及少量的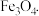 某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )
某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )
A.滤液1中是否含有 ,可以选用KSCN和新制的氯水检验 ,可以选用KSCN和新制的氯水检验 |
B.步骤②操作中,先加  ,在不断搅拌下,再加入 ,在不断搅拌下,再加入 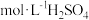 |
C.滤渣1成分是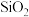 和CuS,滤渣2成分一定是 和CuS,滤渣2成分一定是 |
D.步骤①操作中,生成的气体需用NaOH溶液或 溶液吸收 溶液吸收 |
您最近半年使用:0次
2020-12-01更新
|
288次组卷
|
11卷引用:江西省赣州市部分重点中学2021届高三上学期期中考试化学试题
江西省赣州市部分重点中学2021届高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——仪器的连接和实验的操作顺序浙江省宁波市效实中学2020届高三上学期复习阶段性测试化学试题湖北省荆州市荆州中学2019-2020学年高一下学期3月月考化学试题安徽省合肥市第八中学2019-2020学年高一下学期网络学习段考四化学试题模拟卷03——2020年秋高二化学开学摸底考试卷(全国通用)黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期开学考试化学试题山东省济南市历城第二中学2021届高三10月份学情检测化学试题山东省枣庄市第八中学2021-2022学年高三9月月考化学试题浙江省磐安县第二中学2019-2020学年高二10月竞赛化学试题(已下线)【2023】【高一下】【期中考】【杭师大附中】【高中化学】【张明涛收集】
6 . 下列图示箭头方向表示与某种常见试剂在一定条件下(不含电解)发生转化,其中6步转化均能一步实现的一组物质是( )
| 选项 | W | X | Y | Z | 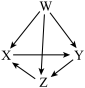 |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| C | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-11-14更新
|
433次组卷
|
11卷引用:江西省景德镇市浮梁县第一中学2020-2021学年高二下学期5月月考化学试题(争优部1、2班)
江西省景德镇市浮梁县第一中学2020-2021学年高二下学期5月月考化学试题(争优部1、2班)江西省南昌市第二中学2018届高三上学期第四次考试化学试题2016届江苏省盐城市高三上学期期中测试化学试卷12016届江苏省盐城市高三上学期期中测试化学试卷2山东省淄博实验中学2018届高三上学期第一次教学诊断考试化学试题黑龙江省大兴安岭漠河县第一中学2018-2019学年高一上学期期中考试化学试题(已下线)【新东方】 2020-10湖南省衡阳市第一中学2021届高三上学期期中考试化学试题黑龙江绥化市第七中学校2020-2021学年高一下学期第二次月考化学试题湖北省武汉市部分重点中学2021-2022学年高三上学期8月联考化学试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高二9月份月考(7-13班)化学试题
7 . 某矿样中含有大量的CuS及少量其他不含铜不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
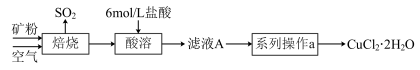
(1)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是____________ (填字母)。
②CuCl2溶液中存在平衡:Cu(H2O)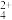 (蓝色)+4Cl-
(蓝色)+4Cl- CuCl
CuCl (黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是
(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是_____ (填字母)。
a.FeCl3固体b.CuCl2固体c.蒸馏水
(2)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气中焙烧CuS时,固体质量变化曲线及SO2生成曲线如图。
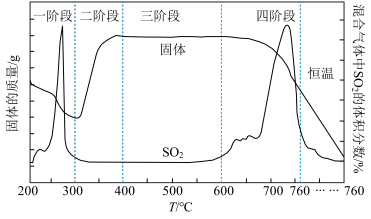
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为CuS Cu2S
Cu2S CuO·CuSO4
CuO·CuSO4 CuSO4
CuSO4 CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式
CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式__________________ 。
②300~400℃内,固体质量明显增加的原因是_________________ .
③实验证明第四阶段所得混合气体所需试剂为________ 、________ 。
④若原CuS矿样的质量为10.0g,实验过程中,保持在760℃左右持续加热,待矿样充分反应后,所得固体的质量为8.4g,则原矿样中CuS的质量分数为_____ 。

(1)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是

②CuCl2溶液中存在平衡:Cu(H2O)
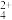 (蓝色)+4Cl-
(蓝色)+4Cl- CuCl
CuCl (黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是
(黄色)+4H2O。欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中还需要的是a.FeCl3固体b.CuCl2固体c.蒸馏水
(2)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气中焙烧CuS时,固体质量变化曲线及SO2生成曲线如图。

①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为CuS
 Cu2S
Cu2S CuO·CuSO4
CuO·CuSO4 CuSO4
CuSO4 CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式
CuO第①步转化主要在200~300℃内进行,该步转化的化学方程式②300~400℃内,固体质量明显增加的原因是
③实验证明第四阶段所得混合气体所需试剂为
④若原CuS矿样的质量为10.0g,实验过程中,保持在760℃左右持续加热,待矿样充分反应后,所得固体的质量为8.4g,则原矿样中CuS的质量分数为
您最近半年使用:0次
2020-11-10更新
|
429次组卷
|
2卷引用:江西省南昌市第二中学2021届高三上学期第四次考试化学试题
名校
8 . 钴是一种中等活泼金属,化合价为+2价和+3价。某校同学利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdCl2溶液能被CO还原为Pd。
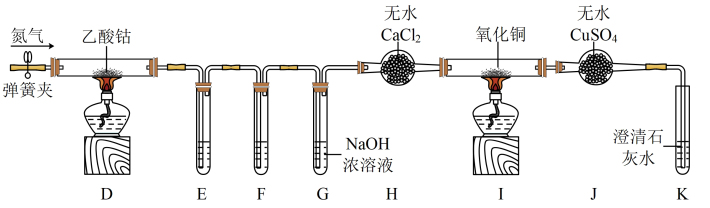
(1)装置E、F是用于检验CO和CO2的,其中盛放PdCl2溶液的是装置______ (填“E”或“F”)。
(2)装置G的作用是______ ;E、F、G中的试剂均足量且充分反应,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______ 。
(3)实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______ 。
(4)若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______ 。

(1)装置E、F是用于检验CO和CO2的,其中盛放PdCl2溶液的是装置
(2)装置G的作用是
(3)实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是
(4)若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为
您最近半年使用:0次
9 . 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是
| A.“烹胆矾则成铜”是物理变化 |
| B.胆矾可用于配制波尔多液 |
| C.“熬之则成胆矾”是蒸发结晶过程 |
| D.“熬胆矾铁釜,久之亦化为铜“发生反应Fe+CuSO4=Cu+FeSO4 |
您最近半年使用:0次
2020-10-25更新
|
164次组卷
|
2卷引用:江西省石城中学2020-2021学年高一上学期第二次月考化学试题
名校
解题方法
10 . 氯化亚铜(CuC1)广泛应用于化工、印染、电镀等行业。CuC1难溶于水,可溶于氯离子浓度较大的体系,易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,生产CuC1的工艺如下:
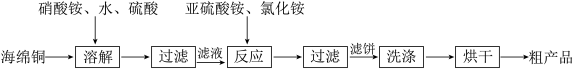
下列说法错误的是

下列说法错误的是
A.“溶解”过程发生氧化还原反应的离子方程式是3Cu+8H++2 =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
B.“反应”过程发生反应的离子方程式是2Cu2++ +2C1-+H2O=2CuC1↓+ +2C1-+H2O=2CuC1↓+ +2H+ +2H+ |
| C.“溶解”过程中硫酸可用浓盐酸代替 |
| D.“烘干”需在隔绝空气的环境中进行 |
您最近半年使用:0次
2020-10-17更新
|
451次组卷
|
3卷引用:江西省丰城市第九中学2021-2022学年高三复读班上学期10月月考化学试题



