名校
解题方法
1 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。回答下列问题。
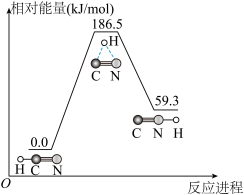
(1)理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示:计算可得HCN(g)
HNC(g)异构化反应过程的能量变化如图所示:计算可得HCN(g) HNC(g) ΔH=
HNC(g) ΔH=_______ kJ/mol。HCN与HNC稳定性较强的是_______ 。
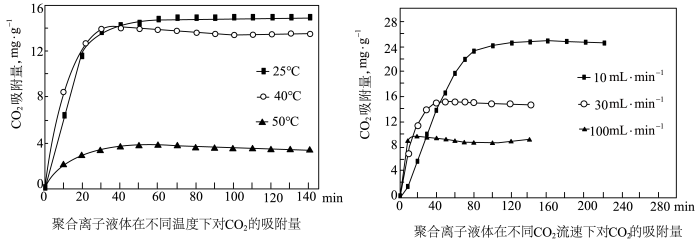
(2)聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是_______ 。
(3)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)⇌ H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s)⇌CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
①写出上述合成尿素的热化学方程式_______ 。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如下图所示:
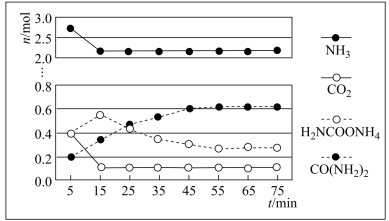
已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第_______ 步反应决定,总反应进行到_______ min时到达平衡。
(4)合成乙酸:
中国科学家首次以CH3OH、CO2和H2为原料高效合 成乙酸,其反应路径如下图所示:
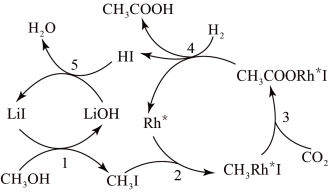
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式_______ 。
②根据图示 ,写出总反应的化学方程式_______ 。
(1)理论研究表明,在101 kPa和298 K下,HCN(g)
 HNC(g)异构化反应过程的能量变化如图所示:计算可得HCN(g)
HNC(g)异构化反应过程的能量变化如图所示:计算可得HCN(g) HNC(g) ΔH=
HNC(g) ΔH=
(2)聚合离子液体是目前广泛研究的CO2吸附剂。

(3)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)⇌ H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s)⇌CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
①写出上述合成尿素的热化学方程式
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第
(4)合成乙酸:
中国科学家首次以CH3OH、CO2和H2为原料高效合 成乙酸,其反应路径如下图所示:

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式
②
您最近一年使用:0次
2023-02-23更新
|
187次组卷
|
2卷引用:福建省福州市八县(市、区)一中2022-2023学年高二上学期期末联考化学试题
名校
2 . 合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g) 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;
2H2(g)+O2(g) 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ (可用分数表示),平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
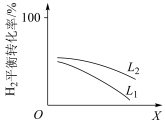
i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
已知:N2(g)+3H2(g)
 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;2H2(g)+O2(g)
 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
物质 | N2 | H2 | NH3 |
平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
物质 | N2 | H2 | NH3 |
起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
您最近一年使用:0次
3 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得: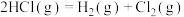 ∆H=
∆H=___________ kJ/mol
②通过盖斯定律可计算。已知在25℃、101kPa时:
I.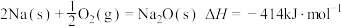
II.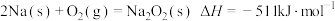
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
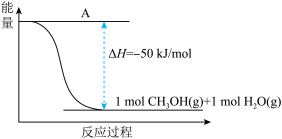
该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的∆H___________ (填“变大”“变小”或“不变”)。
(4)有机物M经过太阳光光照可转化成N,转化过程如下:
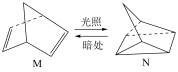
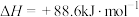
则M、N相比,较稳定的是___________ 。
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.NaOH与盐酸反应 | B.甲烷的燃烧反应 |
| C.Ba(OH)2∙8H2O与氯化铵反应 | D.锌与盐酸反应 |
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 |  |  |  |
| 键能(kJ/mol) | 436 | 247 | 434 |
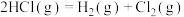 ∆H=
∆H=②通过盖斯定律可计算。已知在25℃、101kPa时:
I.
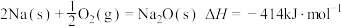
II.
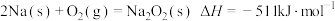
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的∆H
(4)有机物M经过太阳光光照可转化成N,转化过程如下:

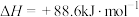
则M、N相比,较稳定的是
您最近一年使用:0次
4 . 甲醇是重要的化工原料,广泛应用于有机合成、医药生产等领域。在一定条件下,用 和
和 可以合成甲醇,这对于减少
可以合成甲醇,这对于减少 排放,实现“碳中和”具有重要意义。以
排放,实现“碳中和”具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
Ⅰ.
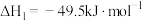
Ⅱ.

(1)已知:
 ,则反应Ⅱ的
,则反应Ⅱ的
___________ 。
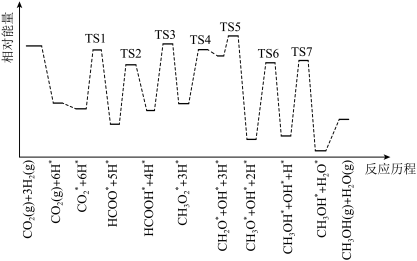
(2) 和
和 在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是___________ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为___________ 。
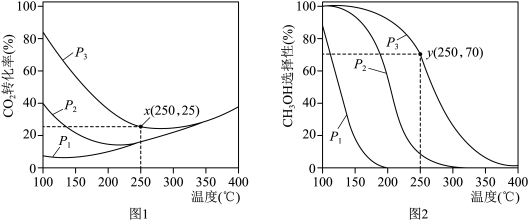
(3)往恒容密闭容器中按 充入
充入 和
和 ,在催化剂作用下合成甲醇,
,在催化剂作用下合成甲醇, 平衡转化率和
平衡转化率和 选择性随温度和压强的变化情况如图1、图2所示。
选择性随温度和压强的变化情况如图1、图2所示。
已知: 的选择性
的选择性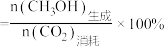
①据图可知,压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是___________ 。
②图2中 选择性随温度变化的原因是
选择性随温度变化的原因是___________ 。
③当温度为250℃、压强为 时,
时, 平衡转化率和
平衡转化率和 选择性如图中
选择性如图中 和
和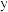 点所示。若平衡时容器内
点所示。若平衡时容器内 ,则反应I的平衡常数
,则反应I的平衡常数
___________ (列计算式)。
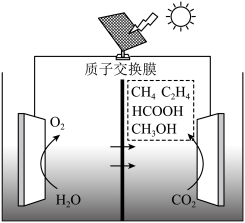
(4)目前,科研人员在研究 光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为___________ 。
 和
和 可以合成甲醇,这对于减少
可以合成甲醇,这对于减少 排放,实现“碳中和”具有重要意义。以
排放,实现“碳中和”具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):Ⅰ.

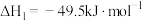
Ⅱ.


(1)已知:

 ,则反应Ⅱ的
,则反应Ⅱ的
(2)
 和
和 在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为

(3)往恒容密闭容器中按
 充入
充入 和
和 ,在催化剂作用下合成甲醇,
,在催化剂作用下合成甲醇, 平衡转化率和
平衡转化率和 选择性随温度和压强的变化情况如图1、图2所示。
选择性随温度和压强的变化情况如图1、图2所示。
已知:
 的选择性
的选择性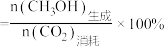
①据图可知,压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②图2中
 选择性随温度变化的原因是
选择性随温度变化的原因是③当温度为250℃、压强为
 时,
时, 平衡转化率和
平衡转化率和 选择性如图中
选择性如图中 和
和 点所示。若平衡时容器内
点所示。若平衡时容器内 ,则反应I的平衡常数
,则反应I的平衡常数
(4)目前,科研人员在研究
 光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
您最近一年使用:0次
2022-03-09更新
|
453次组卷
|
2卷引用:福建省福州外国语学校2023-2024学年高三上学期10月月考化学试题
名校
解题方法
5 . 近年来CO2变废为宝,改善环境是科学研究的重要课题,对于实现废气资源的再利用及碳循环经济技术的发展都具有重要意义。
I.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g) CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
②C2H4(g)+H2(g) C2H6(g) △H2=-136 kJ·mol-1
C2H6(g) △H2=-136 kJ·mol-1
③H2(g)+CO2(g) H2O(g)+CO(g) △H3=+41 kJ·mol-1
H2O(g)+CO(g) △H3=+41 kJ·mol-1
④CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) △H4
C2H4(g)+H2O(g)+CO(g) △H4
(1)△H4=_____ ,0.1MPa 时向密闭容器中充入CO2和C2H6,发生反应④,温度对催化剂K- Fe-Mn/Si 性能的影响如图:
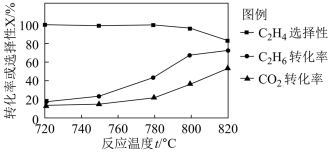
工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是______ °C。
(2)在800°C时,n(CO2):n(C2H6)=1: 3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0,一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用最简分式表示)。
II.CO2和H2制备CH3OH,可实现CO2的资源化利用,涉及的反应如下:
主反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H <0
CH3OH(g)+H2O(g) △H <0
副反应: CO2(g)+H2(g) CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
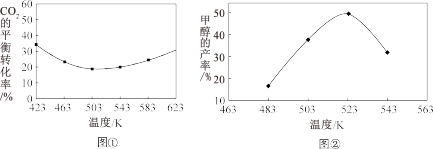
(3)不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是___________ 。 实际生产中,保持压强不变,相同反应时间内不同温度下CH3OH的产率如图②所示,由图可知,523K时CH3OH的产率最大,可能的原因是___________ 。
III.捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。
(4)已知: NH3·H2O的Kb=1.7 ×10-5, H2CO3的Ka1=4.3 ×10-7, Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20°C后用氨水吸收过量的CO2。吸收反应的化学反应方程式为___________ ,所得溶液离子浓度由大到小的顺序是___________ (不考虑二氧化碳的溶解)。
I.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g)
 CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1②C2H4(g)+H2(g)
 C2H6(g) △H2=-136 kJ·mol-1
C2H6(g) △H2=-136 kJ·mol-1③H2(g)+CO2(g)
 H2O(g)+CO(g) △H3=+41 kJ·mol-1
H2O(g)+CO(g) △H3=+41 kJ·mol-1④CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) △H4
C2H4(g)+H2O(g)+CO(g) △H4(1)△H4=

工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是
(2)在800°C时,n(CO2):n(C2H6)=1: 3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0,一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=
II.CO2和H2制备CH3OH,可实现CO2的资源化利用,涉及的反应如下:
主反应: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H <0
CH3OH(g)+H2O(g) △H <0副反应: CO2(g)+H2(g)
 CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
(3)不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是

III.捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。
(4)已知: NH3·H2O的Kb=1.7 ×10-5, H2CO3的Ka1=4.3 ×10-7, Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20°C后用氨水吸收过量的CO2。吸收反应的化学反应方程式为
您最近一年使用:0次
2022-03-16更新
|
321次组卷
|
2卷引用:福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题
名校
6 . 利用CO2可合成烷烃、醇等系列重要化工原料。回答下列有关问题:
I.制备甲烷:CO2(g)+4H2(g)=CH4(g)+2H2O (g) △H
已知:CH4、H2的燃烧热分别为 △H1 =—893kJ·mol-1、△H2=—285.8 kJ· mol-1,1mol液态H2O变成水蒸气需吸收44kJ的热量。
(1)△H=___________ kJ· mol-1。
II.制备甲醇:
主反应: CO2(g) + 3H2 CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1
CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1
副反应: CO2(g) + H2(g) CO(g) + H2O (g) △H2= +41 kJ·mol-1
CO(g) + H2O (g) △H2= +41 kJ·mol-1
某一刚性容器中充入1molCO2和3molH2,在催化剂存在的条件下进行反应,测得温度与平衡转化率、产物选择性的关系如下图所示。
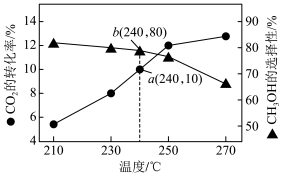
已知: CH3OH选择性=
(2)240°C该反应达到平衡时,产生的CH3OH的物质的量为___________ mol,240°C时副反应的化学平衡常数为___________ 。
(3)有研究表明,在原料气中掺入适量的CO有利于提高CH3OH选择性,说明其可能的原因是___________ , 有利于提高CH3OH选择性反应条件还可以是_____ (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
I.制备甲烷:CO2(g)+4H2(g)=CH4(g)+2H2O (g) △H
已知:CH4、H2的燃烧热分别为 △H1 =—893kJ·mol-1、△H2=—285.8 kJ· mol-1,1mol液态H2O变成水蒸气需吸收44kJ的热量。
(1)△H=
II.制备甲醇:
主反应: CO2(g) + 3H2
 CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1
CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1副反应: CO2(g) + H2(g)
 CO(g) + H2O (g) △H2= +41 kJ·mol-1
CO(g) + H2O (g) △H2= +41 kJ·mol-1某一刚性容器中充入1molCO2和3molH2,在催化剂存在的条件下进行反应,测得温度与平衡转化率、产物选择性的关系如下图所示。

已知: CH3OH选择性=

(2)240°C该反应达到平衡时,产生的CH3OH的物质的量为
(3)有研究表明,在原料气中掺入适量的CO有利于提高CH3OH选择性,说明其可能的原因是
A.高温高压 B.高温低压 C.低温高压 D.低温低压
您最近一年使用:0次
名校
7 . CO2是主要的温室气体,以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上常用CO2和H2为原料合成甲醇( ),过程中发生如下两个反应:
),过程中发生如下两个反应:
反应I: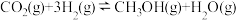
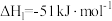
反应II: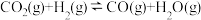
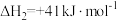
①则

_______  ;
;
②若反应II逆反应活化能Ea(逆)为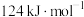 ,则该反应的Ea (正)活化能为
,则该反应的Ea (正)活化能为_______  。
。
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行反应: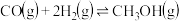 ,下列事实能说明此反应已达到平衡状态的是_______。
,下列事实能说明此反应已达到平衡状态的是_______。
(3)向2L容器中充入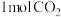 和
和 ,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中
,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图1所示,测得反应时逆反应速率与容器中
体积分数如图1所示,测得反应时逆反应速率与容器中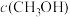 关系如图II所示:
关系如图II所示:
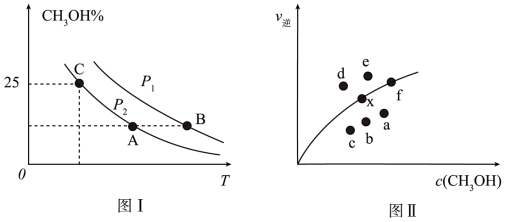
①图I中P1_______ P2(填“>”、“<”或“=”)。
②图II中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是_______ 。
③利用图I中C点对应的数据,计算求出对应温度下反应Ⅰ的平衡常数K=_______ 。
(1)工业上常用CO2和H2为原料合成甲醇(
 ),过程中发生如下两个反应:
),过程中发生如下两个反应:反应I:
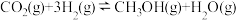
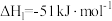
反应II:
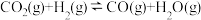
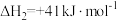
①则


 ;
;②若反应II逆反应活化能Ea(逆)为
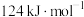 ,则该反应的Ea (正)活化能为
,则该反应的Ea (正)活化能为 。
。(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行反应:
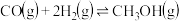 ,下列事实能说明此反应已达到平衡状态的是_______。
,下列事实能说明此反应已达到平衡状态的是_______。| A.容器内气体密度保持不变 |
| B.混合气体的平均相对分子质量不变 |
C.生成 的速率与生成H2的速率相等 的速率与生成H2的速率相等 |
| D.CO的体积分数保持不变 |
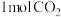 和
和 ,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中
,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图1所示,测得反应时逆反应速率与容器中
体积分数如图1所示,测得反应时逆反应速率与容器中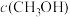 关系如图II所示:
关系如图II所示:
①图I中P1
②图II中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是
③利用图I中C点对应的数据,计算求出对应温度下反应Ⅰ的平衡常数K=
您最近一年使用:0次
解题方法
8 . 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________ (填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
由表中数据判断△H1________ 0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________ ,此时的温度为________ (从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________ ;
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
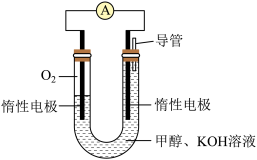
①该电池正极的电极反应为___________ ;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________ 。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为
您最近一年使用:0次
解题方法
9 . I. 氢气是一种常用的化工原料,应用十分广泛。
(1)以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+1/2CO2(g)===1/2NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________ 。
II.某同学设计了一组电化学装置如下图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。
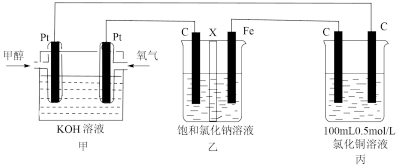
根据要求回答相关问题:
(2)写出装置甲中负极的电极反应式:_______________________________________ 。
(3)装置乙中石墨电极(C)的电极反应式为:_________________________________ 。
(4)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积___________ L(标况下);装置乙中溶液的pH为___________ (溶液体积为200mL不变),要使乙烧杯中的溶液恢复到原来的状态,需要加入的物质是___________ 。
(1)以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+1/2CO2(g)===1/2NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为
II.某同学设计了一组电化学装置如下图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。

根据要求回答相关问题:
(2)写出装置甲中负极的电极反应式:
(3)装置乙中石墨电极(C)的电极反应式为:
(4)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积
您最近一年使用:0次



