解题方法
1 . 丁二烯、异丁烯均是重要的有机化工原料,广泛用于有机合成和精细化工。
I.正丁烷催化氧化制1.3-丁二烯的一种反应途径如图所示。
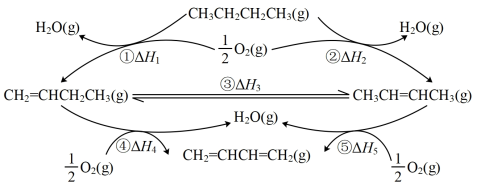
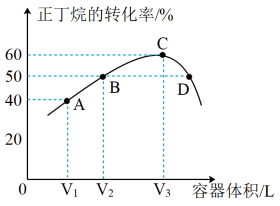
(1)已知: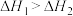 ,则
,则
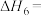
______ ,相同条件下,稳定性:1-丁烯______ (填“>”、“<”或“=”)2-丁烯。
(2)在某恒温恒容密闭容器中通入等物质的量的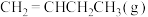 和
和 ,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
II.正丁烷脱氢异构制异丁烯。
温度为T℃,向体积不等的恒容密闭容器中均充入1 mol正丁烷,发生反应:

 ,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
(3)A点时
______ (填“>”、“=”或“<”,同) ;正反应速率:
;正反应速率:
______ 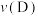 。
。
(4)若C点为平衡点且容器总压强为0.4 MPa,则该条件下,反应的平衡常数
______ MPa(以分压表示的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率______ (填“增大”、“减小”或“不变”)。
(6)
______ 。
I.正丁烷催化氧化制1.3-丁二烯的一种反应途径如图所示。

(1)已知:
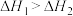 ,则
,则
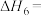
(2)在某恒温恒容密闭容器中通入等物质的量的
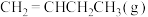 和
和 ,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。
,仅发生反应④(该反应为可逆反应),下列描述能说明反应已经达到平衡状态的是______(填标号)。| A.混合气体的密度不再改变 |
| B.混合气体平均摩尔质量不再改变 |
C.丁二烯和 的物质的量之比不再改变 的物质的量之比不再改变 |
D.1-丁烯和 的物质的量之比不再改变 的物质的量之比不再改变 |
II.正丁烷脱氢异构制异丁烯。
温度为T℃,向体积不等的恒容密闭容器中均充入1 mol正丁烷,发生反应:

 ,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。
,反应均进行10 min,测得各容器中正丁烷的转化率与容器体积的关系如图所示。(3)A点时

 ;正反应速率:
;正反应速率:
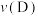 。
。(4)若C点为平衡点且容器总压强为0.4 MPa,则该条件下,反应的平衡常数

 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
(5)向A点对应的反应体系中再充入一定量的正丁烷,达到平衡时,正丁烷的转化率
(6)

您最近一年使用:0次
2 . 甲烷及其衍生物在国民经济中有着重要的作用。
(1)工业上甲烷可用于制造合成气,该反应的热化学方程式为
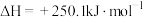 。
。
①25℃、101 kPa,CO(g)、H2(g)的燃烧热依次为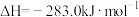 、
、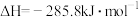 。写出该条件下,表示甲烷燃烧热的热化学方程式:
。写出该条件下,表示甲烷燃烧热的热化学方程式:___________ 。
②在催化剂作用下将物质的量均为1 mol的CH4(g)和CO2(g)加入恒温恒压的密闭容器中(25℃、100 kPa),发生反应,正反应速率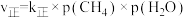 ,其中p为分压。若该条件下
,其中p为分压。若该条件下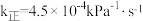 ,当
,当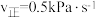 时,CH4的转化率为
时,CH4的转化率为___________ 。
(2)用CH4与CO2反应制取H2,其反应为 ,分别在一定体积的恒压密闭容器中充入1.0 mol CH4和1.0 mol CO2,发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图所示。
,分别在一定体积的恒压密闭容器中充入1.0 mol CH4和1.0 mol CO2,发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图所示。
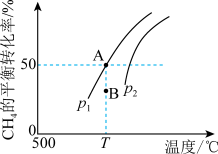
①压强p1___________ (填“>”、“=”或“<”) p2。
②当压强为p1时,B点v正___________ (填“>”、“=”或“<”)v逆。
③若p1=2.0 MPa,则A点的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
(3)CO2甲烷化加快了能源结构由化石燃料向可再生碳资源的转变,反应为
 。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示。
。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示。
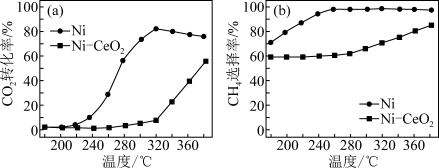
对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(1)工业上甲烷可用于制造合成气,该反应的热化学方程式为

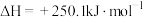 。
。①25℃、101 kPa,CO(g)、H2(g)的燃烧热依次为
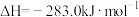 、
、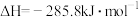 。写出该条件下,表示甲烷燃烧热的热化学方程式:
。写出该条件下,表示甲烷燃烧热的热化学方程式:②在催化剂作用下将物质的量均为1 mol的CH4(g)和CO2(g)加入恒温恒压的密闭容器中(25℃、100 kPa),发生反应,正反应速率
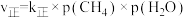 ,其中p为分压。若该条件下
,其中p为分压。若该条件下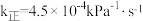 ,当
,当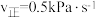 时,CH4的转化率为
时,CH4的转化率为(2)用CH4与CO2反应制取H2,其反应为
 ,分别在一定体积的恒压密闭容器中充入1.0 mol CH4和1.0 mol CO2,发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图所示。
,分别在一定体积的恒压密闭容器中充入1.0 mol CH4和1.0 mol CO2,发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图所示。
①压强p1
②当压强为p1时,B点v正
③若p1=2.0 MPa,则A点的平衡常数Kp=
(3)CO2甲烷化加快了能源结构由化石燃料向可再生碳资源的转变,反应为

 。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示。
。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示。
对比上述两种催化剂的催化性能,工业上应选择的催化剂是
您最近一年使用:0次
名校
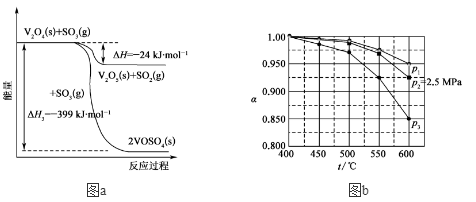
3 . 硫酸是一种重要的基本化工产品。接触法制硫酸生产中的氧化工序为: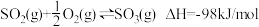 ,回答下列问题:
,回答下列问题:
(1)若将物质的量之比为2:1的SO2(g)和O2(g)通入恒温恒容反应器,下列能判断反应达到平衡的是___________。
(2)据图(a),请写出VOSO4(s)和V2O4(s)反应生成V2O5(s)与SO2(g)的热化学方程式为___________ 。
(3)若当SO2、O2、N2(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图(b)所示。反应在0.5MPa、550℃时的α=______ ,判断的依据是______ 。下列因素中能影响α的因素有_______ 。
A.压强B.反应物的组成 C.催化剂D.温度
(4)若将物质的量之比为2:1的SO2(g)和O2(g)通入反应器,在恒温t、恒压p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________ ,平衡常数Kp=___________ (以分压表示,分压=总压 物质的量分数)。
物质的量分数)。
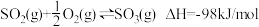 ,回答下列问题:
,回答下列问题:(1)若将物质的量之比为2:1的SO2(g)和O2(g)通入恒温恒容反应器,下列能判断反应达到平衡的是___________。
| A.SO2(g)和O2(g)的转化率为2:1时 |
| B.容器内混合气体的压强不再改变 |
| C.容器内混合气体的平均相对分子质量不再改变 |
| D.生成2mol SO3(g)的同时消耗1mol O2(g) |

(3)若当SO2、O2、N2(不参与反应)起始的物质的量分数分别为10%、15%和75%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图(b)所示。反应在0.5MPa、550℃时的α=
A.压强B.反应物的组成 C.催化剂D.温度
(4)若将物质的量之比为2:1的SO2(g)和O2(g)通入反应器,在恒温t、恒压p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2021-10-17更新
|
407次组卷
|
3卷引用:湖北省巴东县第三高级中学2022-2023学年高二上学期第一次月考化学试题
解题方法
4 . 乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)→C2H4ΔH1=—174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=—311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=____________ kJ•mol-1,K(300K)=____________ (保留三位有效数字)
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为____________ (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____________ kJ•mol-1,该步骤的化学方程式为____________ 。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g) C2H2(g)+H2(g)。
C2H2(g)+H2(g)。
①乙烯的离解率为α,平衡时容器内气体总压强为p总,则分压p(C2H4)=____________ (用p总和α表示)。
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为____________ (精确到0.001,已知 ≈1.4)。
≈1.4)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为____________ (填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为____________ 。
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)→C2H4ΔH1=—174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=—311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)
 C2H2(g)+H2(g)。
C2H2(g)+H2(g)。①乙烯的离解率为α,平衡时容器内气体总压强为p总,则分压p(C2H4)=
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为
 ≈1.4)。
≈1.4)。(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为
您最近一年使用:0次
解题方法
5 . 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(1)汽车发动机工作时会引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=
2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=____ mol/(L·min),N2的平衡转化率为___ ,2000 K时该反应的平衡常数K=___ 。
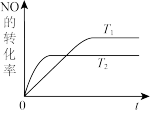
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示。
①反应2NO(g) N2(g)+O2(g)为
N2(g)+O2(g)为____ 反应(填“吸热”或“放热”)。
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是
N2(g)+O2(g)已达到平衡的是____ (填序号)。
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:________ ;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NO)转化为无毒气体,该反应的化学方程式为______ 。
(1)汽车发动机工作时会引起反应:N2(g)+O2(g)
 2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=
2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如图所示。
①反应2NO(g)
 N2(g)+O2(g)为
N2(g)+O2(g)为②一定温度下,能够说明反应2NO(g)
 N2(g)+O2(g)已达到平衡的是
N2(g)+O2(g)已达到平衡的是a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变
d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NO)转化为无毒气体,该反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。回答下列问题:
(1)催化转化器可使汽车尾气反应而转化:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:2C(s)+O2(g)=2CO(g) ΔH1=akJ·mol-1;
C(s)+O2(g)=CO2(g) ΔH2=bkJ·mol-1;
N2(g)+O2(g)=2NO(g) ΔH3=ckJ·mol-1
ΔH=__ kJ·mol-1(用含a、b、c的代数式表示);
(2)T℃时,将等物质的量的NO和CO充入容积为1L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=___ 。
②下列事实能判断汽车尾气转化反应达到到化学平衡状态的是___ ;
A.体系中NO的转化率和CO的转化率相等 B.气体的密度不再变化
C.NO消耗速率等于N2消耗速率的2倍 D.混合气体平均相对分子质量不再变化
③已知汽车尾气转化反应的ΔH<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系不正确的是___ 。(填序号)
a. b.
b.  c.
c.  d.
d. 
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述不正确的是___ (填标号)。
A.IO为反应的中间产物
B.第二步活化能比第三步小
C.第二步对总反应速率起决定作用
D.N2O分解反应中,k值与是否含碘蒸气无关
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___ mol·L-1(用精确值表示);
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO2和N2,且物质的量之比为4:3,写出该方法的化学方程式___ 。
(1)催化转化器可使汽车尾气反应而转化:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH已知:2C(s)+O2(g)=2CO(g) ΔH1=akJ·mol-1;
C(s)+O2(g)=CO2(g) ΔH2=bkJ·mol-1;
N2(g)+O2(g)=2NO(g) ΔH3=ckJ·mol-1
ΔH=
(2)T℃时,将等物质的量的NO和CO充入容积为1L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=
②下列事实能判断汽车尾气转化反应达到到化学平衡状态的是
A.体系中NO的转化率和CO的转化率相等 B.气体的密度不再变化
C.NO消耗速率等于N2消耗速率的2倍 D.混合气体平均相对分子质量不再变化
③已知汽车尾气转化反应的ΔH<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系不正确的是
a.
 b.
b.  c.
c.  d.
d. 
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)
 2I(g)(快反应)
2I(g)(快反应)第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述不正确的是
A.IO为反应的中间产物
B.第二步活化能比第三步小
C.第二步对总反应速率起决定作用
D.N2O分解反应中,k值与是否含碘蒸气无关
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO2和N2,且物质的量之比为4:3,写出该方法的化学方程式
您最近一年使用:0次
7 . 反应①Fe(s)+CO2(g)  FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g) CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
测得在不同温度下,反应①的平衡常数 K 值随温度的变化如下:
(1)若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,CO2的平衡浓度为____________ 。
(2)反应①中的 a_____________ 0(填“大于”“小于”或“等于”)。
(3)700℃反应已经①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有_____________ (填序号)
A.缩小反应器体积 B.通入 CO2
C.升高温度到 900℃ D.使用合适的催化剂
(4)下列图象符合反应①的是_____ (填序号)(图中 v是速率、Φ为混合物中 CO2含量, T 为温度且 T1> T2)

(5) 2Fe(s)+O2(g) 2FeO(s) △H3,该反应的△H3=
2FeO(s) △H3,该反应的△H3= ________ kJ/mol。(用含 a、b的代数式表示)
 FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;②CO(g)+1/2O2(g)
 CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol测得在不同温度下,反应①的平衡常数 K 值随温度的变化如下:
| 温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,CO2的平衡浓度为
(2)反应①中的 a
(3)700℃反应已经①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有
A.缩小反应器体积 B.通入 CO2
C.升高温度到 900℃ D.使用合适的催化剂
(4)下列图象符合反应①的是

(5) 2Fe(s)+O2(g)
 2FeO(s) △H3,该反应的△H3=
2FeO(s) △H3,该反应的△H3=
您最近一年使用:0次
名校
8 . 研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3•H2O(aq) =NH4HSO3(aq) △H1 = a kJ•mol-1;② NH3•H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJ•mol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJ•mol-1,则反应 2SO2(g) + 4NH3•H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H =______ 。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)⇌N2(g) + CO2(g) △H=-34.0 kJ•mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
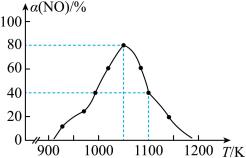
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________ ; 在1100K 时,CO2的体积分数为______ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________ (已知:气体分压=气体总压×体积分数)。
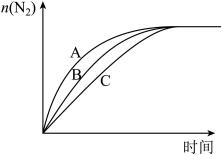
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________ (填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____ (填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则 =
=_____ (保留2位有效数字)。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3•H2O(aq) =NH4HSO3(aq) △H1 = a kJ•mol-1;② NH3•H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJ•mol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJ•mol-1,则反应 2SO2(g) + 4NH3•H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H =
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)⇌N2(g) + CO2(g) △H=-34.0 kJ•mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是

(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)⇌N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
 =
=
您最近一年使用:0次
2019-05-28更新
|
868次组卷
|
9卷引用:湖北省恩施州高中教育联盟2021-2022学年高二上学期期末考试化学试题
名校
9 . Ⅰ.(1)298K时,0.5molC2H4(g)完全燃烧生成二氧化碳和液态水,放出705.5kJ的热量。请写出该反应的热化学方程式________ 。
(2)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应: Na2SO3(aq)+Cl2(g)+H2O(l)=Na2SO4(aq)+2HCl(aq) ΔH1=akJ·mol−1
Cl2(g)+H2O(l)=HCl(aq)+HClO(aq) ΔH2=bkJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:________ 。
Ⅱ.红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=_________ 。
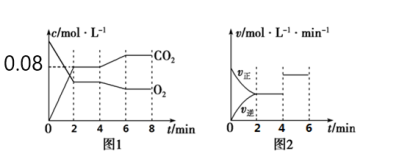
(2)如图1所示,在0~2min内CO2的平均反应速率为_______ 。
(3)图1、图2表示上述反应在2min时达到平衡、在4min时因改变某个条件而发生变化的曲线。由图1判断,反应进行至4min时,曲线发生变化的原因是______ (用文字表达);由图2判断,4min到6min的曲线变化的原因可能是____ (填写序号)。
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积
(4)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。已知该反应能自发进行,则下列图象正确的是
CH3OH(g)+H2O(g)。已知该反应能自发进行,则下列图象正确的是______ 。
A. B.
B. C.
C. D.
D.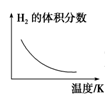
(2)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应: Na2SO3(aq)+Cl2(g)+H2O(l)=Na2SO4(aq)+2HCl(aq) ΔH1=akJ·mol−1
Cl2(g)+H2O(l)=HCl(aq)+HClO(aq) ΔH2=bkJ·mol−1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:
Ⅱ.红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g)
 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=
(2)如图1所示,在0~2min内CO2的平均反应速率为
(3)图1、图2表示上述反应在2min时达到平衡、在4min时因改变某个条件而发生变化的曲线。由图1判断,反应进行至4min时,曲线发生变化的原因是
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积
(4)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。已知该反应能自发进行,则下列图象正确的是
CH3OH(g)+H2O(g)。已知该反应能自发进行,则下列图象正确的是A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2018-01-13更新
|
236次组卷
|
5卷引用:湖北省利川市第五中学2020-2021学年高二上学期期中考试化学试题
10 . 按要求对下图中两极进行必要的联接 并填空:
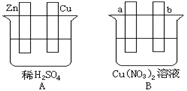
(1)在A图中,使铜片上冒H2气泡。请加以必要联接__________ (在答题卡的图中画线),则联接后的装置叫_________ 。电极反应式:锌板:____________________ ;铜板:___________ 。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出____________ 。加以必要的联接后,该装置叫___________ 。电极反应式:a极:___________________________ b极:____________________________ 。经过一段时间后,停止反应并搅均溶液,溶液的pH值________________ (升高、降低、不变),加入一定量的____________ 后,溶液能恢复至与电解前完全一致。
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+ O2(g) = CH3OH(g) △H=-128.5kJ/mol
O2(g) = CH3OH(g) △H=-128.5kJ/mol
副反应有:CH4(g)+ O2(g) = CO(g)+2H2O(g) △H=a kJ/mol
O2(g) = CO(g)+2H2O(g) △H=a kJ/mol
CH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) = HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸气的热化学方程式为_____________________ 。

(1)在A图中,使铜片上冒H2气泡。请加以必要联接
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+
 O2(g) = CH3OH(g) △H=-128.5kJ/mol
O2(g) = CH3OH(g) △H=-128.5kJ/mol副反应有:CH4(g)+
 O2(g) = CO(g)+2H2O(g) △H=a kJ/mol
O2(g) = CO(g)+2H2O(g) △H=a kJ/molCH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) = HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸气的热化学方程式为
您最近一年使用:0次



