1 . 一定条件下,水气变换反应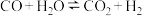 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
Ⅰ.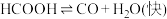
Ⅱ.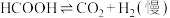
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
_____ (用含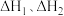 的代数式表示)。
的代数式表示)。
(2)反应Ⅰ正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为_____  ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
_____  (用含
(用含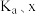 和k的代数式表示)。
和k的代数式表示)。
(3) 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满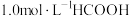 水溶液,使
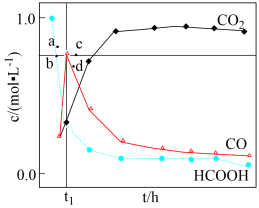
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为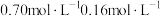 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为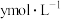 。体系达平衡后
。体系达平衡后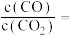
_____ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为_____ 。
相同条件下,若反应起始时溶液中同时还含有 盐酸,则图示点
盐酸,则图示点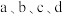 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是_____ (填标号)。与不含盐酸相比, 达浓度峰值时,
达浓度峰值时, 浓度
浓度_____ (填“增大”“减小”或“不变”), 的值
的值_____ (填“增大”“减小”或“不变”)。
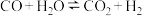 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:Ⅰ.
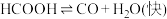
Ⅱ.
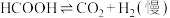
研究发现,在反应Ⅰ、Ⅱ中,
 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为
 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
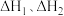 的代数式表示)。
的代数式表示)。(2)反应Ⅰ正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为 ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
 (用含
(用含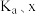 和k的代数式表示)。
和k的代数式表示)。(3)
 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满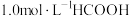 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为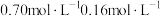 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为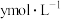 。体系达平衡后
。体系达平衡后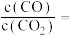

相同条件下,若反应起始时溶液中同时还含有
 盐酸,则图示点
盐酸,则图示点 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是 达浓度峰值时,
达浓度峰值时, 浓度
浓度 的值
的值
您最近一年使用:0次
2023-06-19更新
|
10707次组卷
|
10卷引用:湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题
湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市第二中学2023-2024学年高三上学期10月月考化学试题2023年高考山东卷化学真题四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题(已下线)2023年高考山东卷化学真题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)(已下线)专题04 电离平衡 水的电离和溶液的pH-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
2 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①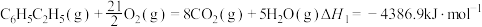
②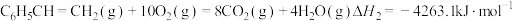
③
计算反应④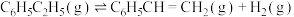 的
的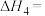
_______  ;
;
(2)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______  水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);
(3)在 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤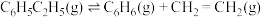
⑥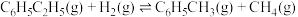
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______ ,理由是_______ ; 的描述错误的是_______;
的描述错误的是_______;
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是
中活性最高的是_______ ;
(6)室温下,① 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为_______ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
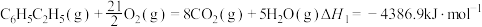
②
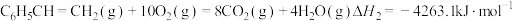
③

计算反应④
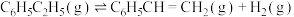 的
的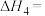
 ;
;(2)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);(3)在
 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
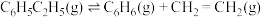
⑥
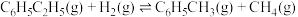
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是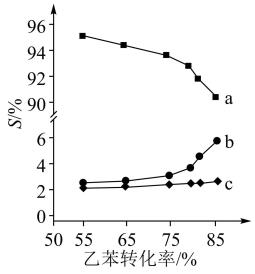
 的描述错误的是_______;
的描述错误的是_______;A.X射线衍射技术可测定 晶体结构 晶体结构 |
B. 可改变乙苯平衡转化率 可改变乙苯平衡转化率 |
C. 降低了乙苯脱氢反应的活化能 降低了乙苯脱氢反应的活化能 |
D.改变 颗粒大小不影响反应速率 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某
 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。(5)引发剂
 中活性最高的是
中活性最高的是(6)室温下,①
 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为
您最近一年使用:0次
2023-06-16更新
|
7673次组卷
|
9卷引用:湖北省沙市中学2023-2024学年高三下学期3月月考化学试题
湖北省沙市中学2023-2024学年高三下学期3月月考化学试题湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题2023年高考湖南卷化学真题(已下线)专题17 原理综合题(已下线)2023年湖南卷高考真题变式题(原理综合题)(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用) 浙江省义乌中学2024届高三上学期首考适应性考试化学试题(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
解题方法
3 . 硫及其化合物之间的转化具有重要意义。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,其转化过程为
分子可形成单斜硫和斜方硫,其转化过程为 ,这是一个正反应放热的可逆反应。则
,这是一个正反应放热的可逆反应。则 、
、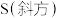 相比,较稳定的是
相比,较稳定的是___________ [填“ ”或“
”或“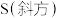 ”]。
”]。
(2)硫酸工业的一步重要反应是 的催化氧化
的催化氧化 。向一恒压密闭容器中充入一定量的
。向一恒压密闭容器中充入一定量的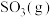 发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
(3)某实验小组通过铁块与稀硫酸反应的实验,研究化学反应速率的影响因素,并绘制出如下图示:
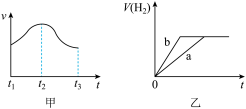
①图甲中, 到
到 速率明显加快的主要原因是
速率明显加快的主要原因是___________ 。
②图乙中,曲线a为铁块与足量稀硫酸反应生成 的体积随时间变化关系。能将曲线a转化为b的实验措施有
的体积随时间变化关系。能将曲线a转化为b的实验措施有___________ (填标号)。
A.将铁块换成铁粉
B.加 固体
固体
C.加 固体
固体
D.将稀硫酸换成98%的硫酸溶液
E.滴入几滴硫酸铜溶液
(4)硫氧化菌电池在废水处理和新能源开发域有广阔的应用前景,其工作原理如图所示。
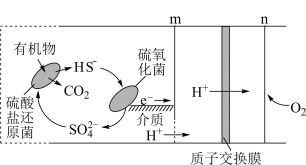
① 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式为
的电极反应式为___________ 。
②处理0.05mol 时,从质子交换膜左侧迁移至右侧的
时,从质子交换膜左侧迁移至右侧的
___________ mol。
(5)将 与空气的混合气体通入到
与空气的混合气体通入到 、
、 和
和 的混合溶液中,转化过程如图所示:
的混合溶液中,转化过程如图所示:
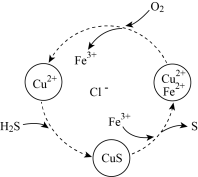
总过程的化学方程式为___________ 。
(1)
 分子可形成单斜硫和斜方硫,其转化过程为
分子可形成单斜硫和斜方硫,其转化过程为 ,这是一个正反应放热的可逆反应。则
,这是一个正反应放热的可逆反应。则 、
、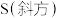 相比,较稳定的是
相比,较稳定的是 ”或“
”或“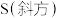 ”]。
”]。(2)硫酸工业的一步重要反应是
 的催化氧化
的催化氧化 。向一恒压密闭容器中充入一定量的
。向一恒压密闭容器中充入一定量的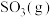 发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。| A.混合气体的密度不再改变 |
B.混合气体中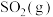 和 和 的分压之比不再改变 的分压之比不再改变 |
C. |
| D.混合气体的平均相对分子质量不再改变 |

①图甲中,
 到
到 速率明显加快的主要原因是
速率明显加快的主要原因是②图乙中,曲线a为铁块与足量稀硫酸反应生成
 的体积随时间变化关系。能将曲线a转化为b的实验措施有
的体积随时间变化关系。能将曲线a转化为b的实验措施有A.将铁块换成铁粉
B.加
 固体
固体C.加
 固体
固体D.将稀硫酸换成98%的硫酸溶液
E.滴入几滴硫酸铜溶液
(4)硫氧化菌电池在废水处理和新能源开发域有广阔的应用前景,其工作原理如图所示。

①
 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式为
的电极反应式为②处理0.05mol
 时,从质子交换膜左侧迁移至右侧的
时,从质子交换膜左侧迁移至右侧的
(5)将
 与空气的混合气体通入到
与空气的混合气体通入到 、
、 和
和 的混合溶液中,转化过程如图所示:
的混合溶液中,转化过程如图所示:
总过程的化学方程式为
您最近一年使用:0次
4 . 石油化工、煤气化等行业废气普遍含有 ,需要回收处理并加以利用。回答下列问题:
,需要回收处理并加以利用。回答下列问题:
已知:反应Ⅰ: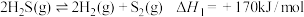
反应II: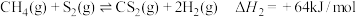
反应Ⅲ: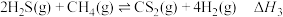
(1)
___________ 。
(2)在总压强为 条件下,
条件下,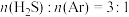 的混合气在不同温度下发生反应I,反应相同时间后测得
的混合气在不同温度下发生反应I,反应相同时间后测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:

①从平衡移动的角度判断,通入Ar稀释的目的是___________ 。
②图中表示平衡状态的曲线为___________ (填“a”或“b”)。某温度下,平衡时 的体积分数为20%,则该反应的平衡常数
的体积分数为20%,则该反应的平衡常数
___________  。
。
(3)按体积比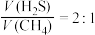 投料,压强恒定,在不同温度下反应相同时间后测得
投料,压强恒定,在不同温度下反应相同时间后测得 和
和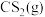 的体积分数如下表:
的体积分数如下表:
试解释在950~1150℃内(其他条件不变),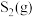 的体积分数随温度升高先增大后减小的原因是
的体积分数随温度升高先增大后减小的原因是___________ 。
(4) 可用于处理工业废水中的重金属离子(如:
可用于处理工业废水中的重金属离子(如: 、
、 、
、 等)
等)
已知反应IV: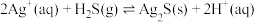
①温度为T时,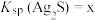 ,则
,则 饱和溶液中
饱和溶液中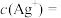
___________ 。
②下列关于反应IV及相关物质的说法正确的是___________ 。
A.纯银器表面生成 属于电化学腐蚀
属于电化学腐蚀
B.将 从反应IV体系中及时分离出去有利于该反应平衡右移
从反应IV体系中及时分离出去有利于该反应平衡右移
C.适当增大压强有利于反应IV平衡右移
D.反应IV能够自发进行说明该反应
 ,需要回收处理并加以利用。回答下列问题:
,需要回收处理并加以利用。回答下列问题:已知:反应Ⅰ:
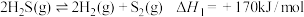
反应II:
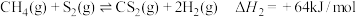
反应Ⅲ:
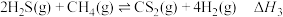
(1)

(2)在总压强为
 条件下,
条件下,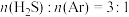 的混合气在不同温度下发生反应I,反应相同时间后测得
的混合气在不同温度下发生反应I,反应相同时间后测得 的体积分数及
的体积分数及 在不同温度下的平衡体积分数如下图所示:
在不同温度下的平衡体积分数如下图所示:
①从平衡移动的角度判断,通入Ar稀释的目的是
②图中表示平衡状态的曲线为
 的体积分数为20%,则该反应的平衡常数
的体积分数为20%,则该反应的平衡常数
 。
。(3)按体积比
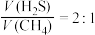 投料,压强恒定,在不同温度下反应相同时间后测得
投料,压强恒定,在不同温度下反应相同时间后测得 和
和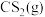 的体积分数如下表:
的体积分数如下表:| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
 的体积分数/% 的体积分数/% | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
 的体积分数/% 的体积分数/% | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
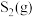 的体积分数随温度升高先增大后减小的原因是
的体积分数随温度升高先增大后减小的原因是(4)
 可用于处理工业废水中的重金属离子(如:
可用于处理工业废水中的重金属离子(如: 、
、 、
、 等)
等)已知反应IV:
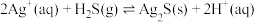
①温度为T时,
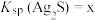 ,则
,则 饱和溶液中
饱和溶液中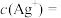
②下列关于反应IV及相关物质的说法正确的是
A.纯银器表面生成
 属于电化学腐蚀
属于电化学腐蚀B.将
 从反应IV体系中及时分离出去有利于该反应平衡右移
从反应IV体系中及时分离出去有利于该反应平衡右移C.适当增大压强有利于反应IV平衡右移
D.反应IV能够自发进行说明该反应

您最近一年使用:0次
5 . 据国际能源署预测,2050年氢燃料电池汽车的比重将提高至15%。
Ⅰ.天然气(CH4)和H2O重整制氢
反应①: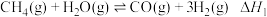
反应②:
(1)已知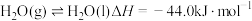 ,相关物质的燃烧热如下表,则
,相关物质的燃烧热如下表,则
___________ 。
(2)700℃时,向一恒容容器中投入1MPaCH4和3MPaH2O,达到平衡时CO、CO2的分压分别为aMPa和bMPa,则反应①的平衡常数
___________ 。
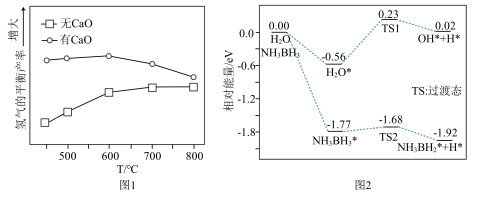
(3)H2的平衡产率随反应温度的变化关系如图1所示。请从平衡移动的角度解释T>600℃时,H2的平衡产率几乎不变的原因___________ 。
(4)已知反应③: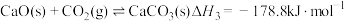 。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。
。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。
Ⅱ.氨硼烷(NH3BH3,熔点104℃)水解制氢
(5)1molNH3BH3完全水解可以生成3molH2和一种可溶性的含氧酸盐(N、B均未变价),请写出NH3BH3完全水解的离子反应方程式___________ 。
(6)吉林大学于吉红院士团队研究发现Pt催化剂上NH3BH3的水解速度主要受H2O和NH3BH3脱氢反应的影响,如图2所示。请写出决速步的化学反应方程式___________ 。
Ⅰ.天然气(CH4)和H2O重整制氢
反应①:
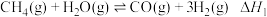
反应②:

(1)已知
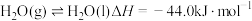 ,相关物质的燃烧热如下表,则
,相关物质的燃烧热如下表,则
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热( ) ) | 890.3 | 282.8 | 285.8 |

(3)H2的平衡产率随反应温度的变化关系如图1所示。请从平衡移动的角度解释T>600℃时,H2的平衡产率几乎不变的原因
(4)已知反应③:
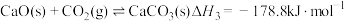 。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。
。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。| A.促进反应②平衡正向移动,提高H2的平衡产率 | B.消耗CO2,提高H2的纯度 |
| C.反应③放热,为重整体系提供能量 | D.减少CO2排放,有利于碳中和 |

Ⅱ.氨硼烷(NH3BH3,熔点104℃)水解制氢
(5)1molNH3BH3完全水解可以生成3molH2和一种可溶性的含氧酸盐(N、B均未变价),请写出NH3BH3完全水解的离子反应方程式
(6)吉林大学于吉红院士团队研究发现Pt催化剂上NH3BH3的水解速度主要受H2O和NH3BH3脱氢反应的影响,如图2所示。请写出决速步的化学反应方程式
您最近一年使用:0次
解题方法
6 . I.研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1) 下,将
下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液
混合,若所得溶液 ,则
,则
_______ 。
(2)已知 时,
时, 的溶度积常数
的溶度积常数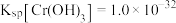 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中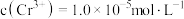 时,应调节
时,应调节 为
为_______ 。
(3)已知: 下
下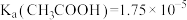 。
。
 下将
下将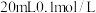 的
的 溶液与
溶液与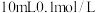 的
的 溶液混合后,所得混合溶液中离子浓度由大到小的顺序为
溶液混合后,所得混合溶液中离子浓度由大到小的顺序为_______ 。
II.2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(4)火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:
和水蒸气。已知:
①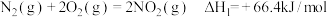
②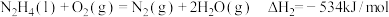
请写出 与
与 反应的热化学方程式:
反应的热化学方程式:_______ 。
(5)二甲醚 是一种新型能源,被誉为“21世纪的清洁燃料”。
是一种新型能源,被誉为“21世纪的清洁燃料”。
用 和
和 合成二甲醚的主反应为:
合成二甲醚的主反应为: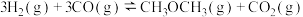
制备过程中还会发生副反应:
①在恒温恒容体系中,下列能判断主反应达到平衡状态的是_______ (填字母)。
A.气体的平均相对分子质量不变
B.气体的密度不再发生变化
C.每断裂 键的同时断裂
键的同时断裂 的
的 键
键
D.二甲醚的体积分数不再变化
②在实验室模拟进行二甲醚制备实验,在 刚性容器中,起始加入
刚性容器中,起始加入 和
和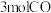 ,体系起始总压为
,体系起始总压为 ,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时
,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时 且
且 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为_______ (写成百分数形式,保留一位小数),该温度下主反应的
_______ 。
(1)
 下,将
下,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液
混合,若所得溶液 ,则
,则
(2)已知
 时,
时, 的溶度积常数
的溶度积常数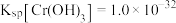 。则使
。则使 恰好完全沉淀,即溶液中
恰好完全沉淀,即溶液中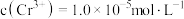 时,应调节
时,应调节 为
为(3)已知:
 下
下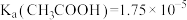 。
。 下将
下将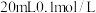 的
的 溶液与
溶液与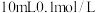 的
的 溶液混合后,所得混合溶液中离子浓度由大到小的顺序为
溶液混合后,所得混合溶液中离子浓度由大到小的顺序为II.2022年11月29日23时08分,我国在酒泉卫星发射中心使用长征二号F遥十五火箭,成功将神舟十五号载人飞船发射升空,是空间站建造阶段最后一次载人飞行任务。
(4)火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。已知:
和水蒸气。已知:①
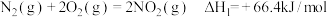
②
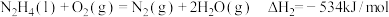
请写出
 与
与 反应的热化学方程式:
反应的热化学方程式:(5)二甲醚
 是一种新型能源,被誉为“21世纪的清洁燃料”。
是一种新型能源,被誉为“21世纪的清洁燃料”。用
 和
和 合成二甲醚的主反应为:
合成二甲醚的主反应为: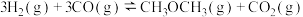
制备过程中还会发生副反应:

①在恒温恒容体系中,下列能判断主反应达到平衡状态的是
A.气体的平均相对分子质量不变
B.气体的密度不再发生变化
C.每断裂
 键的同时断裂
键的同时断裂 的
的 键
键D.二甲醚的体积分数不再变化
②在实验室模拟进行二甲醚制备实验,在
 刚性容器中,起始加入
刚性容器中,起始加入 和
和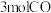 ,体系起始总压为
,体系起始总压为 ,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时
,体系温度保持恒温(在该温度下甲醇为气态)。经实验测定,平衡时 且
且 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解题方法
7 . 党的二十大报告中指出:积极稳妥推进碳达峰碳中和,立足我国能源资源禀赋,坚持先立后破,有计划分步骤实施碳达峰行动。因此CO2的捕集和利用成了研究的重点。
(1)一种从空气中捕获CO2的转化原理如图所示。
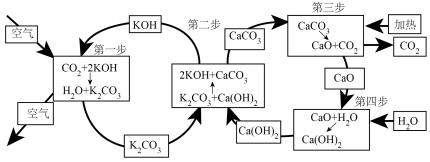
已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=_____ kJ•mol-1。(四步反应中相同物质的状态相同)
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
II.CO(g)+3H2(g) CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。
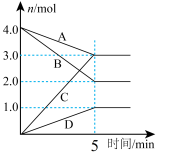
①图中表示两种组分的是曲线_____ (填标号),曲线B表示的物质为_____ (填化学式)。
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是_____ (填标号)。
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=_____ mol•L-1•min-1。反应I的平衡常数K=_____ 。
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为_____ (填“阴极”或“阳极”),写出b极上参加反应的CO2和H2O(物质的量比1:1)发生的电极反应:_____ 。

(1)一种从空气中捕获CO2的转化原理如图所示。

已知图中涉及的四步反应中,△H1=-193.7kJ•mol-1、△H3=+179.2kJ•mol-1、△H4=-64.5kJ•mol-1,则△H2=
(2)CH4-CO2催化重整对温室气体的减排具有重要意义。T1℃时,在体积为10L的恒温恒容的密闭容器中充入等物质的量的CH4(g)和CO2(g),同时进行反应:
I.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+246.9kJ•mol-1;
2CO(g)+2H2(g) △H=+246.9kJ•mol-1;II.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H=-205.7kJ•mol-1。
CH4(g)+H2O(g) △H=-205.7kJ•mol-1。体系中各组分的物质的量随时间的变化如图所示,H2O(g)的物质的量变化情况如曲线D所示。

①图中表示两种组分的是曲线
②CH4-CO2催化重整的目的主要是获得更多的合成气(CO和H2),则反应I更适宜的条件是
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
③T1℃时,用CH4表示从开始到5min时的平均反应速率v(CH4)=
(3)利用固体氧化物电解池可将CO2和H2O转化为合成气并生产高纯度O2,原理如图3所示。a极为

您最近一年使用:0次
2023-05-25更新
|
52次组卷
|
2卷引用:湖北省孝感市部分学校2022-2023学年高二下学期5月联考化学试题
8 . 含氨污染物的有效去除和含碳资源的充分利用是重要研究课题。回答下列问题:
(1)利用尾气 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中见下表,其中x、y、z为常数。
,过程中见下表,其中x、y、z为常数。
①反应Ⅲ的活化能 (正)
(正)______  (逆)(填“>”或“<”).
(逆)(填“>”或“<”).
② 的数值范围是
的数值范围是_____ 。 (填标号)
A.<-2 B. -2~0 C.0~2 D. >2
(2) 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系有以下反应:
利用的研究热点之一。该重整反应体系有以下反应:
Ⅰ.
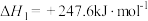
Ⅱ.
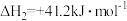
Ⅲ.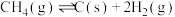
 (只在高温下自发进行)
(只在高温下自发进行)
①在一定压强和催化剂的条件下,将等物质的㫫的 和
和 通入重整反应器中,平衡时,
通入重整反应器中,平衡时, 、
、 的物质的量分数及转化率随温度变化的关系如图所示。平衡时
的物质的量分数及转化率随温度变化的关系如图所示。平衡时 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是______ (填标号)。温度高于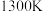 后,曲线
后,曲线 超过曲线
超过曲线 的可能原因为
的可能原因为________________ 。
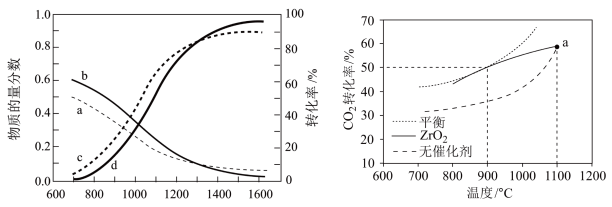
②在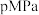 时,将
时,将 和
和 按物质的量之比为
按物质的量之比为 充入密闭容器中,分别在无催化剂和
充入密闭容器中,分别在无催化剂和 催化下反应相同时间,所得
催化下反应相同时间,所得 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。 点
点 转化率相等的原因是
转化率相等的原因是___________ 。
③设 为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为
为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为 )除以标准压强
)除以标准压强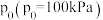 ]。现向恒容密闭容1器中按
]。现向恒容密闭容1器中按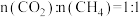 充入原料气,初始总压为
充入原料气,初始总压为 ,发生反应Ⅰ、Ⅱ、Ⅲ,体系达到平衡时
,发生反应Ⅰ、Ⅱ、Ⅲ,体系达到平衡时 的分压为
的分压为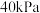 ,此温度下反应Ⅲ
,此温度下反应Ⅲ ,则
,则 的平衡转化率为
的平衡转化率为______ 。
(1)利用尾气
 与
与 反应制备新型硝化剂
反应制备新型硝化剂 ,过程中见下表,其中x、y、z为常数。
,过程中见下表,其中x、y、z为常数。| 过程 | 反应 | 焓变 | 平衡常数K与温度T关系 |
| Ⅰ |  |  | 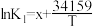 |
| Ⅱ |  |  |  |
| Ⅲ | 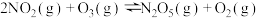 |  | 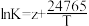 |
 (正)
(正) (逆)(填“>”或“<”).
(逆)(填“>”或“<”).②
 的数值范围是
的数值范围是A.<-2 B. -2~0 C.0~2 D. >2
(2)
 与
与 重整是
重整是 利用的研究热点之一。该重整反应体系有以下反应:
利用的研究热点之一。该重整反应体系有以下反应:Ⅰ.

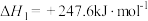
Ⅱ.

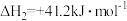
Ⅲ.
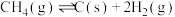
 (只在高温下自发进行)
(只在高温下自发进行)①在一定压强和催化剂的条件下,将等物质的㫫的
 和
和 通入重整反应器中,平衡时,
通入重整反应器中,平衡时, 、
、 的物质的量分数及转化率随温度变化的关系如图所示。平衡时
的物质的量分数及转化率随温度变化的关系如图所示。平衡时 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是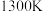 后,曲线
后,曲线 超过曲线
超过曲线 的可能原因为
的可能原因为
②在
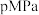 时,将
时,将 和
和 按物质的量之比为
按物质的量之比为 充入密闭容器中,分别在无催化剂和
充入密闭容器中,分别在无催化剂和 催化下反应相同时间,所得
催化下反应相同时间,所得 的转化率与温度的关系如图所示。
的转化率与温度的关系如图所示。 点
点 转化率相等的原因是
转化率相等的原因是③设
 为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为
为相对压力平衡常数,用相对分压代替浓度即可得相对压力平衡常数的表达式[气体的相对分压等于其分压(单位为 )除以标准压强
)除以标准压强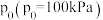 ]。现向恒容密闭容1器中按
]。现向恒容密闭容1器中按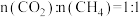 充入原料气,初始总压为
充入原料气,初始总压为 ,发生反应Ⅰ、Ⅱ、Ⅲ,体系达到平衡时
,发生反应Ⅰ、Ⅱ、Ⅲ,体系达到平衡时 的分压为
的分压为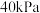 ,此温度下反应Ⅲ
,此温度下反应Ⅲ ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
名校
9 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和。CO2催化加氢合成二甲醚是一种实现“碳中和”理想的CO2转化方法。该过程中涉及的反应如下:
主反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)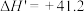
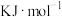
回答下列问题:
(1)主反应通过以下步骤来实现:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)

Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)

则主反应的 =
=_______  。
。
(2)在恒压、CO2和H2的起始量一定时,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如下图所示,CH3OCH3的选择性=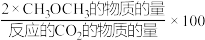 %。
%。
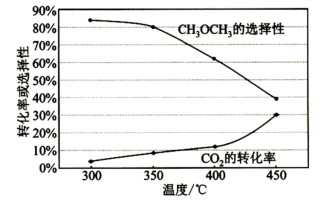
①CO2平衡转化率随温度升高而增大的原因是_______ 。
②420℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性约为50%。不改变反应时间,一定能提高CH3OCH3选择性的措施有_______ (填标号)。
A.升高温度B.增大压强C.增大c(CO2)D.更换适宜的催化剂
(3)在温度为543K、原料组成为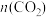 :
: =1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
=1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率 =
=_______ ;副反应的压强平衡常数 =
=_______ (保留两位有效数字)。
(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为_______ ,该电池的理论输出电压为1.20V,能量密度E=_______ 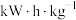 (精确到小数点后1位。能量密度=电池输出电能/燃料质量,
(精确到小数点后1位。能量密度=电池输出电能/燃料质量,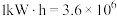 J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
主反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)

副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)
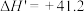
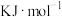
回答下列问题:
(1)主反应通过以下步骤来实现:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)


Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)


则主反应的
 =
= 。
。(2)在恒压、CO2和H2的起始量一定时,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如下图所示,CH3OCH3的选择性=
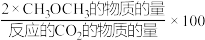 %。
%。
①CO2平衡转化率随温度升高而增大的原因是
②420℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性约为50%。不改变反应时间,一定能提高CH3OCH3选择性的措施有
A.升高温度B.增大压强C.增大c(CO2)D.更换适宜的催化剂
(3)在温度为543K、原料组成为
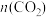 :
: =1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
=1:3、初始总压为4MPa的恒容密闭容器中进行反应,体系达到平衡时CO2的转化率为30%,二甲醚的选择性为50%,则氢气的转化率 =
= =
=(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为
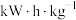 (精确到小数点后1位。能量密度=电池输出电能/燃料质量,
(精确到小数点后1位。能量密度=电池输出电能/燃料质量,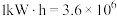 J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
J,电子电量为1.6×10-19库伦,阿伏伽德罗常数为6.02×1023)。
您最近一年使用:0次
名校
10 . 甲烷在化学工业中应用广泛。回答下列问题:
(1) 捕集
捕集 合成
合成 涉及下列反应:
涉及下列反应:
Ⅰ.
 平衡常数
平衡常数
Ⅱ.
 平衡常数
平衡常数
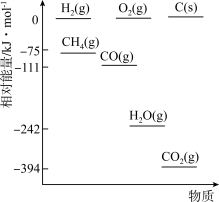
①相关物质相对能量大小如图所示,则
_______  ,升高温度,
,升高温度,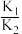
_______ (填“增大”或“减小”)。
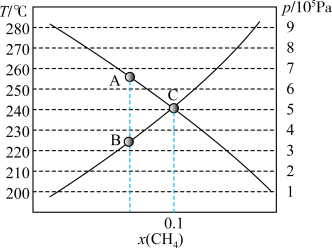
②起始物 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数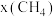 与压强p的变化关系、
与压强p的变化关系、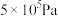 时
时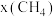 与温度T的变化关系如图所示,图中对应
与温度T的变化关系如图所示,图中对应 、
、 两点的速率:
两点的速率: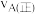
_______ 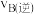 (填“大于”、“小于”或“等于”);若
(填“大于”、“小于”或“等于”);若 点
点 与
与 的分压相同,则
的分压相同,则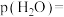
_______  ,反应Ⅰ以物质的量分数表示的平衡常数
,反应Ⅰ以物质的量分数表示的平衡常数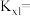
_______ 。
(2) 还原
还原 是实现“双碳”经济的有效途径之一。恒压、750℃时,
是实现“双碳”经济的有效途径之一。恒压、750℃时, 和
和 反应经如图流程(主要产物已标出)可实现
反应经如图流程(主要产物已标出)可实现 高效转化。
高效转化。
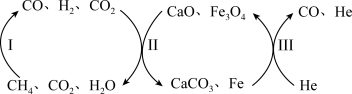
其中过程Ⅱ主要发生如下反应:
ⅰ.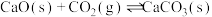
ⅱ.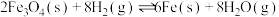
ⅲ.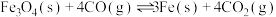
过程Ⅱ平衡后通入 ,反应ⅲ的化学平衡将
,反应ⅲ的化学平衡将_______ (填“正向移动”“逆向移动”或“不移动”),重新平衡时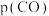
_______ (填“增大”、“减小”或“不变”)。
(1)
 捕集
捕集 合成
合成 涉及下列反应:
涉及下列反应:Ⅰ.

 平衡常数
平衡常数
Ⅱ.

 平衡常数
平衡常数
①相关物质相对能量大小如图所示,则

 ,升高温度,
,升高温度,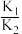

②起始物
 时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数
时,反应在不同条件下达到平衡,240℃时甲烷的物质的量分数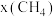 与压强p的变化关系、
与压强p的变化关系、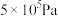 时
时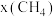 与温度T的变化关系如图所示,图中对应
与温度T的变化关系如图所示,图中对应 、
、 两点的速率:
两点的速率: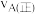
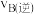 (填“大于”、“小于”或“等于”);若
(填“大于”、“小于”或“等于”);若 点
点 与
与 的分压相同,则
的分压相同,则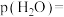
 ,反应Ⅰ以物质的量分数表示的平衡常数
,反应Ⅰ以物质的量分数表示的平衡常数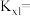

(2)
 还原
还原 是实现“双碳”经济的有效途径之一。恒压、750℃时,
是实现“双碳”经济的有效途径之一。恒压、750℃时, 和
和 反应经如图流程(主要产物已标出)可实现
反应经如图流程(主要产物已标出)可实现 高效转化。
高效转化。
其中过程Ⅱ主要发生如下反应:
ⅰ.
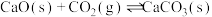
ⅱ.
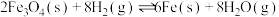
ⅲ.
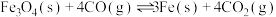
过程Ⅱ平衡后通入
 ,反应ⅲ的化学平衡将
,反应ⅲ的化学平衡将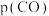
您最近一年使用:0次
2023-04-30更新
|
432次组卷
|
2卷引用:湖北省襄阳市第五中学2023-2024学年高二上学期9月月考化学试题



