解题方法
1 .  为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生。
气体生。 脱硫技术是当前的重点研究方向。回答下列问题:
脱硫技术是当前的重点研究方向。回答下列问题:
(1)1883年英国化学家Claus开发了 氧化制硫的方法,即:
氧化制硫的方法,即:
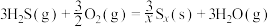
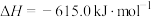
20世纪30年代,德国法本公司将 的氧化分两阶段完成。
的氧化分两阶段完成。
第一阶段反应为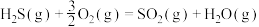
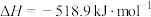
则第二阶段反应

___________  。
。
(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:
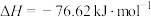
 。据此判断,该反应的△G
。据此判断,该反应的△G___________ 0(填“>”“<”或“=”)。文献资料显示,氧化锌法反应温度控制在300~400℃,工业上这么做的理由为___________ 。
(3)栲胶法是我国本土自主研发和发展起来的湿法氧化脱硫方法,其原理如下(其中,TQ为醌态栲胶;THQ为酚态栲胶):
脱硫过程:



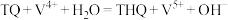
再生过程:
①基态钒原子的价电子排布式为___________ 。
②根据栲胶法原理,脱硫过程中起到催化作用的物质为___________ 。
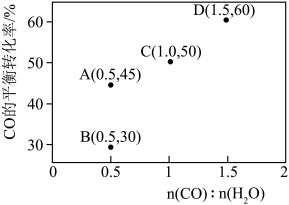
(4)在密闭容器中, 气体分解生成
气体分解生成 和
和 (g)的平衡转化率与温度、压强的关系如下图所示:
(g)的平衡转化率与温度、压强的关系如下图所示:
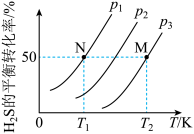
①图中压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②初始量相同的 分别在
分别在 和
和 、温度
、温度 和
和 下各自达到平衡,则N点和M点的压强平衡常数
下各自达到平衡,则N点和M点的压强平衡常数 之比
之比
___________ 。
 为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有
为无色、有臭鸡蛋气味的剧毒气体,能源的开发和利用过程常伴有 气体生。
气体生。 脱硫技术是当前的重点研究方向。回答下列问题:
脱硫技术是当前的重点研究方向。回答下列问题:(1)1883年英国化学家Claus开发了
 氧化制硫的方法,即:
氧化制硫的方法,即: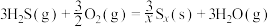
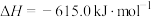
20世纪30年代,德国法本公司将
 的氧化分两阶段完成。
的氧化分两阶段完成。第一阶段反应为
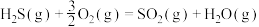
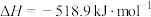
则第二阶段反应


 。
。(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:

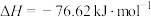
 。据此判断,该反应的△G
。据此判断,该反应的△G(3)栲胶法是我国本土自主研发和发展起来的湿法氧化脱硫方法,其原理如下(其中,TQ为醌态栲胶;THQ为酚态栲胶):
脱硫过程:



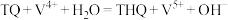
再生过程:

①基态钒原子的价电子排布式为
②根据栲胶法原理,脱硫过程中起到催化作用的物质为
(4)在密闭容器中,
 气体分解生成
气体分解生成 和
和 (g)的平衡转化率与温度、压强的关系如下图所示:
(g)的平衡转化率与温度、压强的关系如下图所示:
①图中压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②初始量相同的
 分别在
分别在 和
和 、温度
、温度 和
和 下各自达到平衡,则N点和M点的压强平衡常数
下各自达到平衡,则N点和M点的压强平衡常数 之比
之比
您最近一年使用:0次
2023-10-25更新
|
158次组卷
|
2卷引用:湖北省腾云联盟2023-2024学年高三上学期10月联考化学试题
2 . 宇宙中随时伴随能量变化,研究化学反应能量变化意义重大。
(1)杭州亚运会首次使用废碳( )绿色循环再生技术合成的零碳甲醇(
)绿色循环再生技术合成的零碳甲醇( )燃料作为主火炬燃料,是对绿色亚运的美好诠释。
)燃料作为主火炬燃料,是对绿色亚运的美好诠释。
①下列有关零碳甲醇作主火炬燃料的优势说法正确的是___________ ;
A.环保,燃烧高效,可实现循环内零排放
B.安全,不易爆炸,储存运输安全便捷
C.可靠,持续燃烧,极端天气不易熄灭
D.经济,废碳再生,燃料成本低
E.可视,火焰亮丽稳定
②已知:反应Ⅰ:
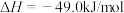
反应Ⅱ: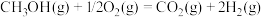
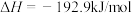
过程Ⅲ:
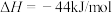
表示甲醇蒸汽燃烧热的热化学方程式为___________ 。
(2)取 的
的 溶液
溶液 与
与 硫酸溶液
硫酸溶液 置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
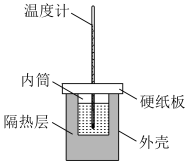
①从图中实验装置看,其中缺少的一种玻璃仪器是___________ ;
②四次实验数据如下,表中温差平均值为___________ ℃
若
 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是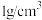 ,反应后生成的溶液比热容
,反应后生成的溶液比热容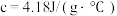 ,则中和反应反应热
,则中和反应反应热
___________ (结果保留小数点后1位)。
③实验中若分几次加入

 溶液,所测中和热
溶液,所测中和热
___________ (填“偏大”、“偏小”或“不变”)。
(3)在催化剂存在下,反应 可表示为如图所示:
可表示为如图所示:
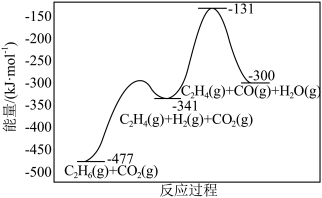
该反应的
___________  ,包含
,包含___________ 个基元反应。
(1)杭州亚运会首次使用废碳(
 )绿色循环再生技术合成的零碳甲醇(
)绿色循环再生技术合成的零碳甲醇( )燃料作为主火炬燃料,是对绿色亚运的美好诠释。
)燃料作为主火炬燃料,是对绿色亚运的美好诠释。①下列有关零碳甲醇作主火炬燃料的优势说法正确的是
A.环保,燃烧高效,可实现循环内零排放
B.安全,不易爆炸,储存运输安全便捷
C.可靠,持续燃烧,极端天气不易熄灭
D.经济,废碳再生,燃料成本低
E.可视,火焰亮丽稳定
②已知:反应Ⅰ:

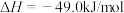
反应Ⅱ:
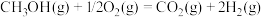
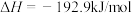
过程Ⅲ:

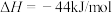
表示甲醇蒸汽燃烧热的热化学方程式为
(2)取
 的
的 溶液
溶液 与
与 硫酸溶液
硫酸溶液 置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
①从图中实验装置看,其中缺少的一种玻璃仪器是
②四次实验数据如下,表中温差平均值为
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温差平均值/℃ | ||
| 硫酸溶液 |  溶液 溶液 | 反应前温度 | |||
| 1 | 26.2 | 26.6 | 26.4 | 29.9 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.3 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.6 | |

 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是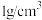 ,反应后生成的溶液比热容
,反应后生成的溶液比热容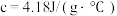 ,则中和反应反应热
,则中和反应反应热
③实验中若分几次加入


 溶液,所测中和热
溶液,所测中和热
(3)在催化剂存在下,反应
 可表示为如图所示:
可表示为如图所示:
该反应的

 ,包含
,包含
您最近一年使用:0次
解题方法
3 .  转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。
Ⅰ.早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成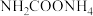 ;②
;②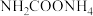 分解生成尿素。
分解生成尿素。
(1)活化能:反应①___________ 反应②(填“>”、“<” 或“二”);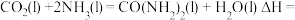
___________ (用含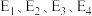 的式子表示)。
的式子表示)。
Ⅱ.我国科学家研究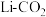 电池,取得了重大科研成果。
电池,取得了重大科研成果。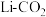 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行,
按以下4个步骤进行,
①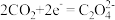 ;
;
②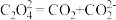 ;
;
③___________;
④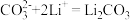
(2)写出步骤③中 与
与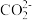 反应的离子方程式
反应的离子方程式___________ 。
Ⅲ.利用 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 ,
, ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:
反应i:

反应ii: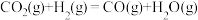
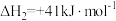
不同配比随温度变化对出口合成气中 的影响如下图所示
的影响如下图所示
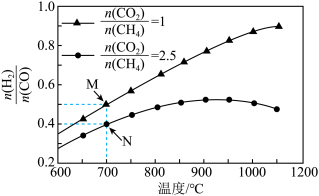
(3)对于反应i,试比较 点和
点和 点
点 的转化率:
的转化率:
___________  (填“>"、“<"或“=”下同);平衡常数
(填“>"、“<"或“=”下同);平衡常数
___________  ,当
,当 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是___________ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当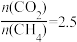 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是___________ 。
(5)在930℃、101kPa时, 按投料比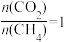 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数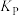 =
=___________ (计算结果保留3位有效数字,用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。Ⅰ.早在二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成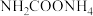 ;②
;②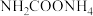 分解生成尿素。
分解生成尿素。
(1)活化能:反应①
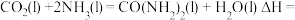
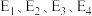 的式子表示)。
的式子表示)。Ⅱ.我国科学家研究
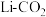 电池,取得了重大科研成果。
电池,取得了重大科研成果。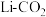 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行,
按以下4个步骤进行,①
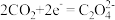 ;
;②
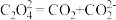 ;
;③___________;
④
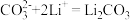
(2)写出步骤③中
 与
与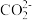 反应的离子方程式
反应的离子方程式Ⅲ.利用
 和
和 重整技术可获得合成气(主要成分为
重整技术可获得合成气(主要成分为 ,
, ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:反应i:


反应ii:
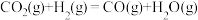
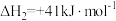
不同配比随温度变化对出口合成气中
 的影响如下图所示
的影响如下图所示
(3)对于反应i,试比较
 点和
点和 点
点 的转化率:
的转化率:
 (填“>"、“<"或“=”下同);平衡常数
(填“>"、“<"或“=”下同);平衡常数
 ,当
,当 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当
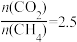 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是(5)在930℃、101kPa时, 按投料比
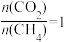 加入刚性密闭容器中,达平衡时,测得
加入刚性密闭容器中,达平衡时,测得 的转化率为90%,
的转化率为90%, 的转化率为95%,试计算反应ii的压强平衡常数
的转化率为95%,试计算反应ii的压强平衡常数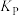 =
=
您最近一年使用:0次
解题方法
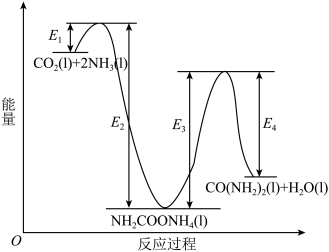
4 . 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:Ⅰ.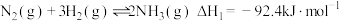
Ⅱ.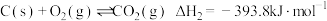
Ⅲ.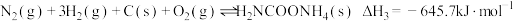
回答下列问题:
(1) 分子中含有键
分子中含有键___________ (填“极性”或“非极性”),写出二氧化碳的电子式___________ 。
(2)写出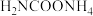 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:___________ 。
(3)在一定温度下,向 密闭容器中,加入
密闭容器中,加入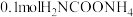 ,实验测得
,实验测得 物质的量变化如下表所示:
物质的量变化如下表所示:
从反应开始到2min,用 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为___________ ;平衡后,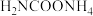 的转化率为
的转化率为___________ 。
(4)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
(5)对该反应,改变某一条件,对化学反应速率的影响及解释不正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加,反应速率加快
B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快
C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快
已知:Ⅰ.
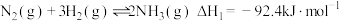
Ⅱ.
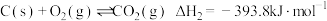
Ⅲ.
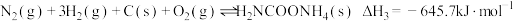
回答下列问题:
(1)
 分子中含有键
分子中含有键(2)写出
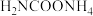 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:(3)在一定温度下,向
 密闭容器中,加入
密闭容器中,加入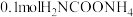 ,实验测得
,实验测得 物质的量变化如下表所示:
物质的量变化如下表所示: | 0 | 1 | 2 | 3 | 4 |
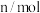 | 0 | a | b | c | c |
 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为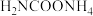 的转化率为
的转化率为(4)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
A. 的浓度不再改变 的浓度不再改变 | B.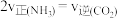 |
| C.容器体积不再改变 | D.容器内密度不再改变 |
A.升高温度,使单位体积内活化分子百分数增加,反应速率加快
B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快
C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快
您最近一年使用:0次
名校
解题方法
5 . 已知存在下列热化学方程式:
①氢气燃烧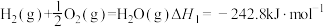
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6kJ·mol−1
③液态水转化为水蒸气H2O(l)=H2O(g) ΔH3=_____kJ·mol−1
回答下列问题:
(1)从能量转化角度分析,反应①为_____ 反应(填“吸热”或“放热”)。
(2)若在反应②中使用催化剂,ΔH2_____ (填“增大”“减小”或“不变”)。
(3)写出反应③的热化学方程式_____ 。
(4)有机物M经过太阳光光照可转化成N,转化过程如下。
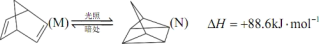
则M的化学式为_____ ,M、N相比,较稳定的是_____ (填“M”或“N”)。
(5)已知CH3OH(l)的燃烧热为238.6kJmol1,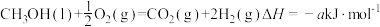 ,则a
,则a_____ 238.6(填“>”“<”或“=”)。
(6)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:_____ 。
(7)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,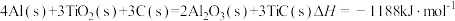 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为_____ 。
(8)已知:
①
②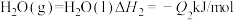
③ (
(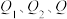 均大于0)
均大于0)
若要使32g液态甲醇完全燃烧,则最后恢复到室温,放出的热量为_____ kJ。
①氢气燃烧
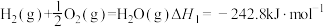
②太阳光分解水制氢气2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6kJ·mol−1
③液态水转化为水蒸气H2O(l)=H2O(g) ΔH3=_____kJ·mol−1
回答下列问题:
(1)从能量转化角度分析,反应①为
(2)若在反应②中使用催化剂,ΔH2
(3)写出反应③的热化学方程式
(4)有机物M经过太阳光光照可转化成N,转化过程如下。

则M的化学式为
(5)已知CH3OH(l)的燃烧热为238.6kJmol1,
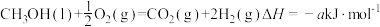 ,则a
,则a(6)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(7)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
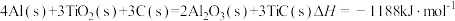 ,则反应过程中,每转移1mol电子时放出的热量为
,则反应过程中,每转移1mol电子时放出的热量为(8)已知:
①

②
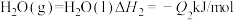
③
 (
(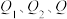 均大于0)
均大于0)若要使32g液态甲醇完全燃烧,则最后恢复到室温,放出的热量为
您最近一年使用:0次
名校
6 . 2021年以来,全国十六个省市将氢能源写入“十四五”规划中,氢能是助力“碳达峰、碳中和”战略目标实现的重要新能源,以CH4为原料制H2具有广阔的应用前景。在一定条件下CH4与CO2催化重整制 涉及以下反应:
涉及以下反应:
主反应:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1=+248 kJ·mol-1
2CO(g)+2H2(g) △H1=+248 kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41 kJ·mol-1
CO(g)+H2O(g) △H2=+41 kJ·mol-1
(1)写出CH4与H2O反应生成CO和H2的热化学方程式___________ 。
(2)我国学者模拟主反应重整制H2,研究在Pt-Ni合金和Sn-Ni合金催化下。甲烷逐级脱氢的反应。不同催化剂的甲烷脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质,吸附过程产生的能量称为吸附能)。
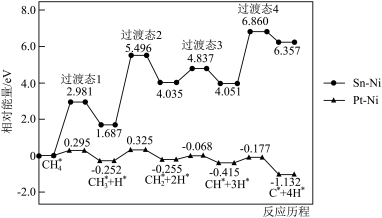
使用Sn-Ni合金作为催化剂的历程中最大能垒
___________ eV;脱氢反应阶段选择Pt-Ni合金作为催化剂效果更好,理由是___________ 。
(3)恒压P0条件下,CO2与CH4以等物质的量投料进行催化重整实验,CO2和CH4的平衡转化率随温度的变化曲线如图所示。

①曲线___________ (填“A”或“B”)表示CO2的平衡转化率。
②X点的速率:v(正)___________ v(逆)(填“>”“<”或“=”)。
③800 K时,主反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
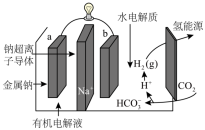
(4)科学家研发出一种新系统,通过“溶解”水中的CO2触发电化学反应,该装置可有效减少碳的排放,并得到氢能源,其工作原理如图所示。则生成H2的电极反应式为___________ 。
 涉及以下反应:
涉及以下反应:主反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1=+248 kJ·mol-1
2CO(g)+2H2(g) △H1=+248 kJ·mol-1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41 kJ·mol-1
CO(g)+H2O(g) △H2=+41 kJ·mol-1(1)写出CH4与H2O反应生成CO和H2的热化学方程式
(2)我国学者模拟主反应重整制H2,研究在Pt-Ni合金和Sn-Ni合金催化下。甲烷逐级脱氢的反应。不同催化剂的甲烷脱氢反应历程与相对能量关系如图所示(*表示吸附在催化剂表面的物质,吸附过程产生的能量称为吸附能)。

使用Sn-Ni合金作为催化剂的历程中最大能垒
(3)恒压P0条件下,CO2与CH4以等物质的量投料进行催化重整实验,CO2和CH4的平衡转化率随温度的变化曲线如图所示。

①曲线
②X点的速率:v(正)
③800 K时,主反应的平衡常数Kp=
(4)科学家研发出一种新系统,通过“溶解”水中的CO2触发电化学反应,该装置可有效减少碳的排放,并得到氢能源,其工作原理如图所示。则生成H2的电极反应式为

您最近一年使用:0次
7 . 深入研究含碳、氮元素的物质转化有着重要的实际意义。
I.
(1)NH3是重要的配体,其中H—N—H的键角为107°。
①NH3分子的VSEPR模型为_______________________ 。
②[Cu(NH3)4]2+中H—N—H的键角__________ (填“大于”、“小于”或“等于”)107°。
③甲基胺离子(CH3NH3+)的电子式为______________________________ 。
Ⅱ.一定条件下,用CH4催化还原可消除NO污染。
已知:①CH4(g) + 2NO2(g) N2(g) +CO2(g)+2H2O(g)△H=-865.0 kJ·mol-1
N2(g) +CO2(g)+2H2O(g)△H=-865.0 kJ·mol-1
②2NO(g) +O2(g) 2NO2(g) △H= - 112.5 kJ·mol-1
2NO2(g) △H= - 112.5 kJ·mol-1
(2)N2和O2完全反应,每生成2.24 L(标准状况)NO时,吸收8.9 kJ的热量;则CH4(g)+ 4NO(g) 2N2(g)+CO2(g) +2H2O(g) △H=
2N2(g)+CO2(g) +2H2O(g) △H=_________ kJ·mol-1。
(3)汽车尾气中的氮氧化物亦可用如下反应处理:2NO(g) +2CO(g) N2(g) +2CO2(g)
N2(g) +2CO2(g)
△H= -746.8kJ·mol-1.实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数_______ (填“>”、“<”或“=”)逆增大的倍数。
Ⅲ.CO2转化为高附加值化学品成为科学家研究的重要课题。
(4)CH4—CO)重整技术是一种理想的CO2利用技术,反应为CO2(g) +CH4(g) 2CO(g)+2H2(g)。在p MPa时,将CO2和CH4按物质的量之比1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在p MPa时,将CO2和CH4按物质的量之比1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:

①a点CO2转化率相等的原因是________ 。
②在p MPa、T°C、ZrO2催化条件下(保持温度和压强不变) ,将CO2、CH4、H2O按物质的量之比1:1:n充入密闭容器中,CO2的平衡转化率为 ,此时平衡常数Kp=
,此时平衡常数Kp=____________________ MPa2 (以分压表示,分压=总压X物质的量分数;写出含 、n、p的计算表达式)。
、n、p的计算表达式)。
I.
(1)NH3是重要的配体,其中H—N—H的键角为107°。
①NH3分子的VSEPR模型为
②[Cu(NH3)4]2+中H—N—H的键角
③甲基胺离子(CH3NH3+)的电子式为
Ⅱ.一定条件下,用CH4催化还原可消除NO污染。
已知:①CH4(g) + 2NO2(g)
 N2(g) +CO2(g)+2H2O(g)△H=-865.0 kJ·mol-1
N2(g) +CO2(g)+2H2O(g)△H=-865.0 kJ·mol-1②2NO(g) +O2(g)
 2NO2(g) △H= - 112.5 kJ·mol-1
2NO2(g) △H= - 112.5 kJ·mol-1(2)N2和O2完全反应,每生成2.24 L(标准状况)NO时,吸收8.9 kJ的热量;则CH4(g)+ 4NO(g)
 2N2(g)+CO2(g) +2H2O(g) △H=
2N2(g)+CO2(g) +2H2O(g) △H=(3)汽车尾气中的氮氧化物亦可用如下反应处理:2NO(g) +2CO(g)
 N2(g) +2CO2(g)
N2(g) +2CO2(g)△H= -746.8kJ·mol-1.实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。达到平衡后,仅升高温度,k正增大的倍数
Ⅲ.CO2转化为高附加值化学品成为科学家研究的重要课题。
(4)CH4—CO)重整技术是一种理想的CO2利用技术,反应为CO2(g) +CH4(g)
 2CO(g)+2H2(g)。在p MPa时,将CO2和CH4按物质的量之比1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在p MPa时,将CO2和CH4按物质的量之比1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是
②在p MPa、T°C、ZrO2催化条件下(保持温度和压强不变) ,将CO2、CH4、H2O按物质的量之比1:1:n充入密闭容器中,CO2的平衡转化率为
 ,此时平衡常数Kp=
,此时平衡常数Kp= 、n、p的计算表达式)。
、n、p的计算表达式)。
您最近一年使用:0次
名校
8 . 氮氧化物是形成酸雨和光化学烟雾的主要物质之一。研究消除氮氧化物的反应机理,对建设生态文明、美丽中国具有重要意义。回答下列问题:
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g) △H。
CO2(g)+2H2O(g)+N2(g) △H。
①已知:CH4的燃烧热△H1=-890.3kJ•mol-1
N2(g)+2O2(g)=2NO2(g) △H2=+133kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则△H=________ kJ•mol-1。
②在3.0L恒温密闭容器中通入1molCH4和2molNO2,进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
则0~4min用NO2表示该反应的平均速率v(NO2)=________ mol/(L•min),该温度下的平衡常数Kp=_________ kPa。
(2)N2O曾用作麻醉剂,其分解的方程式为2N2O(g) 2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
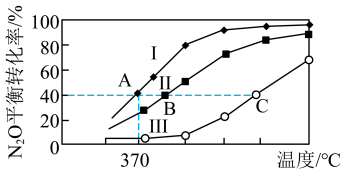
①若容器IV保持370℃,则起始反应速率v正(N2O)_______ 2v逆(O2)(填“>”“<”或“=”)。
②A、B、C三点中压强最大的是_______ 。
③碘蒸气的存在能大幅度提高N2O的分解速率,反应历程如下:
第一步I2(g) 2I(g)(快速平衡,平衡常数为K)
2I(g)(快速平衡,平衡常数为K)
第二步I(g)+N2O(g) N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步2IO(g)+2N2O(g) 2N2(g)+2O2(g)+I2(g)(快反应)
2N2(g)+2O2(g)+I2(g)(快反应)
则第二步的活化能________ (填“>”“<”或“=”)第三步的活化能。
实验表明,碘蒸气存在时N2O分解速率方程v=k•c(N2O)•c0.5(I2)(k为速率常数),已知第二步反应不影响第一步的平衡,其反应速率方程v=k1•c(N2O)•c(I)(k1为速率常数)。则第一步反应的平衡常数K=________ (用k和k1表示)。
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g) △H。
CO2(g)+2H2O(g)+N2(g) △H。①已知:CH4的燃烧热△H1=-890.3kJ•mol-1
N2(g)+2O2(g)=2NO2(g) △H2=+133kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则△H=
②在3.0L恒温密闭容器中通入1molCH4和2molNO2,进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(2)N2O曾用作麻醉剂,其分解的方程式为2N2O(g)
 2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
| 容器 | 物质的量/mol | |||
| 编号 | 体积/L | N2O | N2 | O2 |
| I | V1=1.0 | 0.1 | 0 | 0 |
| II | V2 | 0.1 | 0 | 0 |
| III | V3 | 0.1 | 0 | 0 |
| IV | V4=1.0 | 0.06 | 0.04 | 0.04 |
②A、B、C三点中压强最大的是
③碘蒸气的存在能大幅度提高N2O的分解速率,反应历程如下:
第一步I2(g)
 2I(g)(快速平衡,平衡常数为K)
2I(g)(快速平衡,平衡常数为K)第二步I(g)+N2O(g)
 N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)第三步2IO(g)+2N2O(g)
 2N2(g)+2O2(g)+I2(g)(快反应)
2N2(g)+2O2(g)+I2(g)(快反应)则第二步的活化能
实验表明,碘蒸气存在时N2O分解速率方程v=k•c(N2O)•c0.5(I2)(k为速率常数),已知第二步反应不影响第一步的平衡,其反应速率方程v=k1•c(N2O)•c(I)(k1为速率常数)。则第一步反应的平衡常数K=
您最近一年使用:0次
2023-09-14更新
|
348次组卷
|
4卷引用:湖北省高中名校联盟2024届高三第一次联合测评化学试题
9 . Fe、Co、Cu等金属在回收利用 和污水处理等多个领域都具有应用价值。回答下列问题:
和污水处理等多个领域都具有应用价值。回答下列问题:
(1) 在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
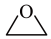 (g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g)
(g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g) 
获取乙二醇的反应历程可分为如下2步:
I.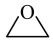
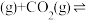
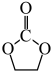 (g)
(g) 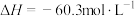
II.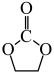 加氢生成乙二醇与甲醇。
加氢生成乙二醇与甲醇。
①步骤II的热化学方程式是:_______ 。
②研究反应温度对EC加氢的影响(反应时间均为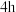 ),实验数据见下表:
),实验数据见下表:
由上表可知,温度越高,EC的转化率越高,原因是_______ 。温度升高到220℃时,乙二醇的产率反而降低,原因是_______ 。
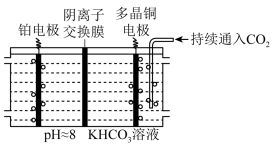
(2)多晶 是目前唯一被实验证实能高效催化
是目前唯一被实验证实能高效催化 还原为烃类(如
还原为烃类(如 )的金属。如图所示,电解装置中分别以多晶
)的金属。如图所示,电解装置中分别以多晶 和
和 为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后
为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后 浓度基本保持不变,温度控制在10℃左右,生成
浓度基本保持不变,温度控制在10℃左右,生成 的电极反应式为
的电极反应式为_______ 。
(3) 与
与 反应如果用
反应如果用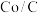 作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将
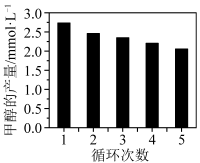
作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将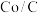 催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因:
催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因:_______ 。(Co的性质与 相似)
相似)
(4)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。
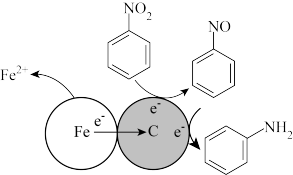
该物质转化示意图可以描述为_______ 。
 和污水处理等多个领域都具有应用价值。回答下列问题:
和污水处理等多个领域都具有应用价值。回答下列问题:(1)
 在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。 (g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g)
(g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g) 
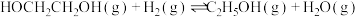
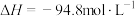
获取乙二醇的反应历程可分为如下2步:
I.

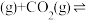
 (g)
(g) 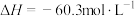
II.
 加氢生成乙二醇与甲醇。
加氢生成乙二醇与甲醇。①步骤II的热化学方程式是:
②研究反应温度对EC加氢的影响(反应时间均为
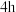 ),实验数据见下表:
),实验数据见下表:| 反应温度/℃ |  的转化率/% 的转化率/% | 乙二醇的产率/% |
| 160 | 23.8 | 23.2 |
| 180 | 62.1 | 60.9 |
| 200 | 99.9 | 94.7 |
| 220 | 99.9 | 92.4 |
(2)多晶
 是目前唯一被实验证实能高效催化
是目前唯一被实验证实能高效催化 还原为烃类(如
还原为烃类(如 )的金属。如图所示,电解装置中分别以多晶
)的金属。如图所示,电解装置中分别以多晶 和
和 为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后
为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后 浓度基本保持不变,温度控制在10℃左右,生成
浓度基本保持不变,温度控制在10℃左右,生成 的电极反应式为
的电极反应式为
(3)
 与
与 反应如果用
反应如果用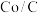 作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将
作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将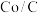 催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因:
催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因: 相似)
相似)
(4)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。

该物质转化示意图可以描述为
您最近一年使用:0次
2023-08-14更新
|
204次组卷
|
2卷引用:湖北省武汉市武钢三中2023-2024学年高三上学期8月月考化学试题
10 . 2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇涉及的反应可表示为:
①

②
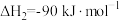
③
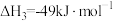
(1)根据上述反应求:④ 的
的
___________  。
。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
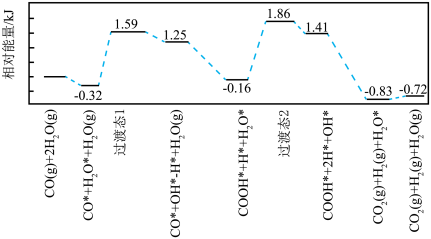
写出该历程中决速步骤的化学方程式:________ 。
(3)一体积可变的密闭容器中,在保持a MPa下,按照 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
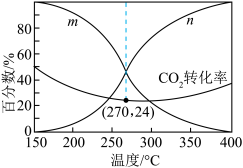
①图中m曲线代表的物质为________ 。
②下列说法正确的是________ (填标号)。
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为________ (保留2位有效数字)。
(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应 ,其速率方程为
,其速率方程为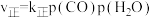 ,
,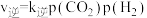 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是________ ,在C点所示投料比下,当CO转化率达到40%时,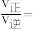
________ 。
二氧化碳加氢制甲醇涉及的反应可表示为:
①


②

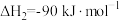
③

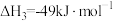
(1)根据上述反应求:④
 的
的
 。
。(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

写出该历程中决速步骤的化学方程式:
(3)一体积可变的密闭容器中,在保持a MPa下,按照
 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
①图中m曲线代表的物质为
②下列说法正确的是
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应
 ,其速率方程为
,其速率方程为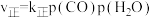 ,
,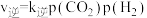 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是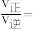

您最近一年使用:0次
2023-06-29更新
|
389次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2023-2024学年高二上学期10月月考化学试题



