1 . Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =___________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为____________________________ 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
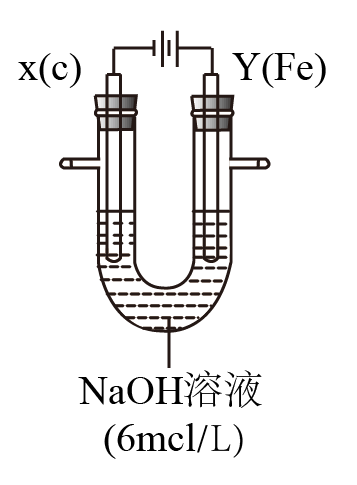
(4)电解过程中,X极区溶液的pH____________ (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和___________________ 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___________ g。
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。

(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
您最近一年使用:0次
2016-12-09更新
|
122次组卷
|
3卷引用:2016届甘肃省嘉峪关一中高三上第三次模拟考试化学试卷
2 . 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________ kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
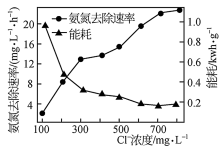
①写出电解时阳极的电极反应式:________________ 。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________ 。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________ 。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________ 。
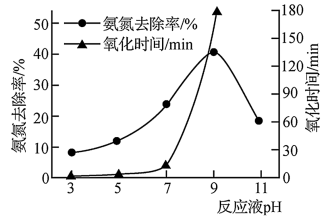
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________ 。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。

①写出电解时阳极的电极反应式:
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是

您最近一年使用:0次
2020-04-14更新
|
458次组卷
|
2卷引用:江苏省苏锡常镇四市2020届高三教学情况调查(一) 化学试题
3 . 金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
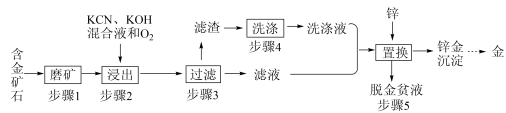
资料:
① Zn + O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =_______ 。
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________ 。

(3)步骤4的目的是_________________ 。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________ (填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________ 。

资料:
① Zn +
 O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2② Zn2+(aq)
 Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是

(3)步骤4的目的是
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 已知反应 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:

①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中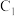 棒上发生的反应为
棒上发生的反应为_________ ;
②过程中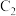 棒上发生的反应为
棒上发生的反应为___________ 。
(2)操作②过程中,盐桥中的 移向
移向_________ 烧杯溶液(填“A”或“B”)。
资料: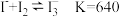 。向
。向 一定浓度的
一定浓度的 溶液中加入
溶液中加入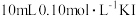 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
(3)a=________________ 。该平衡体系中除了含有 和
和 外,判断溶液是否一定还含有其他含碘微粒
外,判断溶液是否一定还含有其他含碘微粒______________ (填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:
反应: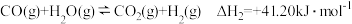
则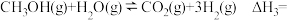
______________ 
(5)已知:25℃时,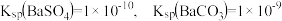 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用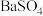 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量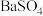 仍然是安全的,
仍然是安全的,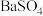 不溶于酸的原因是(用溶解平衡原理解释):
不溶于酸的原因是(用溶解平衡原理解释):_________ 。误服少量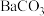 ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的 浓度为
浓度为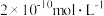 ,应服用的
,应服用的 溶液的最低浓度为
溶液的最低浓度为_______  。
。
 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入
 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。(1)①过程中
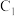 棒上发生的反应为
棒上发生的反应为②过程中
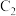 棒上发生的反应为
棒上发生的反应为(2)操作②过程中,盐桥中的
 移向
移向资料:
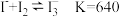 。向
。向 一定浓度的
一定浓度的 溶液中加入
溶液中加入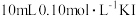 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:| 微粒 |  |  |  |
浓度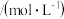 |  |  | a |
(3)a=
 和
和 外,判断溶液是否一定还含有其他含碘微粒
外,判断溶液是否一定还含有其他含碘微粒(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:

反应:
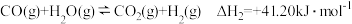
则
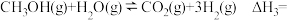

(5)已知:25℃时,
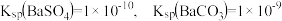 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用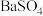 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量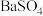 仍然是安全的,
仍然是安全的,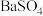 不溶于酸的原因是(用溶解平衡原理解释):
不溶于酸的原因是(用溶解平衡原理解释): ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的 浓度为
浓度为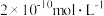 ,应服用的
,应服用的 溶液的最低浓度为
溶液的最低浓度为 。
。
您最近一年使用:0次
名校
解题方法
5 . (1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___ ;
②a、b、c三点CO的转化率从大到小的顺序为___ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____ (填化学式);A电极的电极反应式为____ ;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___ 。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___ (填“酸性”“碱性”或“中性”)。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019-10-31更新
|
229次组卷
|
2卷引用:吉林省吉林市2020届高三第三次调研测试(4月) 理综化学试题
名校
解题方法
6 . 甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)⇌CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)⇌CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为_______ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为_______ 。
(3)过量氯气用Na2S2O3除去,反应中 被氧化为
被氧化为 。若过量的氯气为1×10-3mol,则理论上生成的
。若过量的氯气为1×10-3mol,则理论上生成的 为
为_______ mol。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(4)写出甲中通入甲醇这一极的电极反应式_______ 。
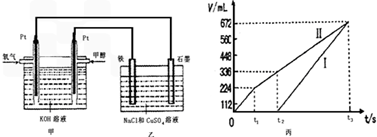
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式_______ ,原混合溶液中 NaCl的物质的量浓度为_______ mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_______ g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_______ 克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)⇌CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)⇌CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为
(3)过量氯气用Na2S2O3除去,反应中
 被氧化为
被氧化为 。若过量的氯气为1×10-3mol,则理论上生成的
。若过量的氯气为1×10-3mol,则理论上生成的 为
为某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:

(4)写出甲中通入甲醇这一极的电极反应式
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为
您最近一年使用:0次
2019-01-30更新
|
643次组卷
|
6卷引用:2016届山东省济南外国语学校高三上学期1月模拟测试理综化学试卷
2010·宁夏银川·一模
7 . 运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是___________ (填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式___________ 。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为___________ ;若CO能够与Na2O2发生反应,则预测反应产物为___________ 。实验后用球形干燥管中的固体进行验证可选择的试剂是___________ 。
(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+ O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式___________ 。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为___________ 。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)___________ L。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4
 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+
 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
您最近一年使用:0次
8 . 砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔHl
H2(g)+2O2(g)=H3AsO4(s) ΔHl
H2(g)+ O2(g)=H2O(1) ΔH2
O2(g)=H2O(1) ΔH2
As(s)+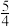 O2(g)=
O2(g)= As2O5(s)ΔH3
As2O5(s)ΔH3
则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=_________ 。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________ 。
(3)NaH2AsO4溶液呈______ (填“酸性”、“中性”或“碱性”),试通过计算说明________________________ 。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。

以酚酞为指示剂(变色范围pH:8.2~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________ 。
(5)某化学兴趣小组同学欲探究可逆反应AsO +I2+2OH-
+I2+2OH- AsO
AsO +2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
+2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
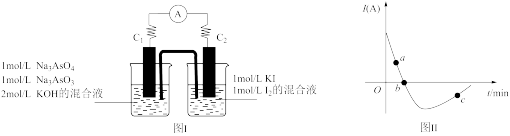
①图Ⅱ中AsO 的逆反应速率:a
的逆反应速率:a____ b( 填“ >”、” <”或“ =” )。
②写出图Ⅱ中c点对应图Ⅰ装置的正极反应式__________________________ 。
③能判断该反应达到平衡状态的是________________ 。
a.2v(I-)正=v(AsO )逆 b.溶液的pH不再变化
)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
(1)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔHl
H2(g)+2O2(g)=H3AsO4(s) ΔHlH2(g)+
 O2(g)=H2O(1) ΔH2
O2(g)=H2O(1) ΔH2As(s)+
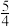 O2(g)=
O2(g)= As2O5(s)ΔH3
As2O5(s)ΔH3则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=
(2)写出砷酸(H3AsO4)的第二步电离方程式
(3)NaH2AsO4溶液呈
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。

以酚酞为指示剂(变色范围pH:8.2~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
(5)某化学兴趣小组同学欲探究可逆反应AsO
 +I2+2OH-
+I2+2OH- AsO
AsO +2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
+2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
①图Ⅱ中AsO
 的逆反应速率:a
的逆反应速率:a②写出图Ⅱ中c点对应图Ⅰ装置的正极反应式
③能判断该反应达到平衡状态的是
a.2v(I-)正=v(AsO
 )逆 b.溶液的pH不再变化
)逆 b.溶液的pH不再变化c.电流表示数变为零 d.溶液颜色不再变化
您最近一年使用:0次
解题方法
9 . 脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol
②N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
③H2O(g) H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol
写出常温下,NH3还原NO反应的热化学方程式:____________ 。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为____________ 。
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为____________ ;60~80℃ NO脱除率下降可能的原因为____________ 。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH- NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:

①a、b、c、d四点平衡常数K由大到小的顺序为____________ ,原因是____________ 。
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=____________ 。(用含a的代数式表示)
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为_______ 。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol ②N2(g)+O2(g)
 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol ③H2O(g)
 H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol写出常温下,NH3还原NO反应的热化学方程式:
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH-
 NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
①a、b、c、d四点平衡常数K由大到小的顺序为
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为
您最近一年使用:0次
10 . 氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____ (填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________ 。
②若V是水,为还原产物,反应的化学方程式为_____________ 。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g) S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______ (填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.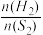 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________ 。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________ 。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____ ;阳极产生的气体是_____ (填化学式)。
(1)下列性质的递变顺序不正确的是
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为
②若V是水,为还原产物,反应的化学方程式为
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)
 S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.
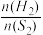 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为
您最近一年使用:0次
2017-12-25更新
|
456次组卷
|
2卷引用:江西名校学术联盟(临川一中、景德镇一中、雁潭一中等)2018届高三教学质量检测考试(二)理综-化学试题



