1 . 烟气(含 、
、 、
、 等)脱硝的研究热点是
等)脱硝的研究热点是 还原
还原 的机理与效果。
的机理与效果。
(1) 还原
还原 的主反应为
的主反应为 。
。
已知:
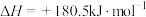


上述主反应的
___________ 。
(2)在某钒催化剂中添加一定量 可加快
可加快 的脱除效率,其可能机理如图-1所示(*表示物种吸附在催化剂表面,部分物种未画出)。
的脱除效率,其可能机理如图-1所示(*表示物种吸附在催化剂表面,部分物种未画出)。

①X、Y处V元素化合价为+4或+5价。X处V元素化合价为___________ 。
② 转化为
转化为 的机理可描述为
的机理可描述为___________ 。
③烟气中若含有 ,会生成
,会生成 ,化学方程式为
,化学方程式为___________ 。此时脱硝效果变差,原因是___________ 。
(3)将模拟烟气(一定比例 、
、 、
、 和
和 )以一定流速通过装有
)以一定流速通过装有 催化剂的反应管,测得
催化剂的反应管,测得 转化率随温度变化的曲线如图-2所示。
转化率随温度变化的曲线如图-2所示。

则温度在高于350℃时, 转化率随温度升高而下降,其可能原因是
转化率随温度升高而下降,其可能原因是___________ 。
 、
、 、
、 等)脱硝的研究热点是
等)脱硝的研究热点是 还原
还原 的机理与效果。
的机理与效果。(1)
 还原
还原 的主反应为
的主反应为 。
。已知:

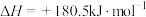


上述主反应的

(2)在某钒催化剂中添加一定量
 可加快
可加快 的脱除效率,其可能机理如图-1所示(*表示物种吸附在催化剂表面,部分物种未画出)。
的脱除效率,其可能机理如图-1所示(*表示物种吸附在催化剂表面,部分物种未画出)。
①X、Y处V元素化合价为+4或+5价。X处V元素化合价为
②
 转化为
转化为 的机理可描述为
的机理可描述为③烟气中若含有
 ,会生成
,会生成 ,化学方程式为
,化学方程式为(3)将模拟烟气(一定比例
 、
、 、
、 和
和 )以一定流速通过装有
)以一定流速通过装有 催化剂的反应管,测得
催化剂的反应管,测得 转化率随温度变化的曲线如图-2所示。
转化率随温度变化的曲线如图-2所示。
则温度在高于350℃时,
 转化率随温度升高而下降,其可能原因是
转化率随温度升高而下降,其可能原因是
您最近一年使用:0次
2 . 丙烯腈(C3H3N)是制备腈纶的单体。一种制备丙烯腈反应的热化学方程式为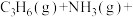
 ,
,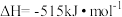 ,下列说法正确的是
,下列说法正确的是
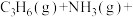
 ,
,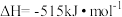 ,下列说法正确的是
,下列说法正确的是A.该反应的 |
B.该反应的平衡常数 |
| C.使用催化剂能改变反应路径,不能改变反应的活化能 |
| D.该反应每消耗1molNH3,转移电子的物质的量为3mol |
您最近一年使用:0次
名校
解题方法
3 . 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
反应1:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1
反应2:CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1
(1)1mol CH4还原NO2至N2,写出该过程的热化学方程式___________ 。
(2)用CH4催化还原NO,能提高N2的平衡产率的措施是___________(填字母)。
(3)一定温度下,在初始体积为2L恒容密闭容器中通入1mol CH4和4mol NO(假设只发生反应2)。
①下列能说明该反应已经达到平衡状态的是___________ (填字母)。
A.c(CH4)和c(CO2)的浓度比保持不变 B.混合气体的密度保持不变
C.CH4的消耗速率等于CO2的消耗速率 D.容器内气体压强保持不变
② 后该反应达到平衡,测得容器中N2的物质的量为
后该反应达到平衡,测得容器中N2的物质的量为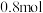 。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=___________ 。
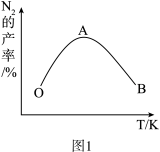
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,反应相同时间,测得N2的产率与温度的关系如图1所示,OA段N2产率随温度升高而增大的原因是___________ 。
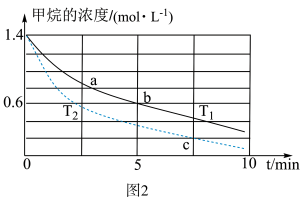
(5)对于反应2而言,不同温度下,CH4的浓度变化如图2所示,下列说法正确的是___________(填字母)。
反应1:CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ∆H1=-574kJ·mol-1反应2:CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ∆H2=-1160kJ·mol-1(1)1mol CH4还原NO2至N2,写出该过程的热化学方程式
(2)用CH4催化还原NO,能提高N2的平衡产率的措施是___________(填字母)。
| A.升高温度 | B.增大压强 | C.降低温度 | D.降低压强 |
①下列能说明该反应已经达到平衡状态的是
A.c(CH4)和c(CO2)的浓度比保持不变 B.混合气体的密度保持不变
C.CH4的消耗速率等于CO2的消耗速率 D.容器内气体压强保持不变
②
 后该反应达到平衡,测得容器中N2的物质的量为
后该反应达到平衡,测得容器中N2的物质的量为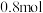 。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,反应相同时间,测得N2的产率与温度的关系如图1所示,OA段N2产率随温度升高而增大的原因是

(5)对于反应2而言,不同温度下,CH4的浓度变化如图2所示,下列说法正确的是___________(填字母)。

| A.T1大于T2 |
| B.c点二氧化碳的浓度为0.2 mol·L-1 |
| C.a点正反应速率大于b点的正反应速率 |
| D.a点的反应速率一定比c点的反应速率小 |
您最近一年使用:0次
2023-04-30更新
|
166次组卷
|
2卷引用:江苏省连云港市东海县2022-2023学年高二上学期期中考试化学试题
22-23高二上·湖北恩施·期末
4 . 甲醇与水蒸气重整制氢气的反应原理为CH3OH(g)+H2O CO2(g)+3H2(g)ΔH,科学家通过计算机模拟得出甲醇在催化剂Pd(Ⅲ)表面发生解离时所经过的反应历程,如图所示,其中吸附在Pd(Ⅲ)表面的物质用*标注。
CO2(g)+3H2(g)ΔH,科学家通过计算机模拟得出甲醇在催化剂Pd(Ⅲ)表面发生解离时所经过的反应历程,如图所示,其中吸附在Pd(Ⅲ)表面的物质用*标注。

已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41.20kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.20kJ·mol-1
②CH3OH(g) CO(g)+2H2(g)ΔH2=+90.64kJ·mol-1
CO(g)+2H2(g)ΔH2=+90.64kJ·mol-1
下列说法正确的是
 CO2(g)+3H2(g)ΔH,科学家通过计算机模拟得出甲醇在催化剂Pd(Ⅲ)表面发生解离时所经过的反应历程,如图所示,其中吸附在Pd(Ⅲ)表面的物质用*标注。
CO2(g)+3H2(g)ΔH,科学家通过计算机模拟得出甲醇在催化剂Pd(Ⅲ)表面发生解离时所经过的反应历程,如图所示,其中吸附在Pd(Ⅲ)表面的物质用*标注。
已知①CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH1=-41.20kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.20kJ·mol-1②CH3OH(g)
 CO(g)+2H2(g)ΔH2=+90.64kJ·mol-1
CO(g)+2H2(g)ΔH2=+90.64kJ·mol-1 下列说法正确的是
| A.ΔH<0 |
| B.甲醇解离过程中仅有C-H键断裂 |
| C.CH3OH(g)解离历程中活化能最小的反应为CH2O*=CHO*+H* |
| D.适当增大压强能提高CH3OH(g)的平衡转化率 |
您最近一年使用:0次
22-23高二上·江苏南通·期末
名校
解题方法
5 .  催化加氢合成甲醇是重要的碳捕获利用与封存技术。
催化加氢合成甲醇是重要的碳捕获利用与封存技术。 催化加氢主要反应有:
催化加氢主要反应有:
反应I.
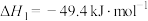
反应II.

压强分别为 、
、 时,将
时,将 的混合气体置于密闭容器中反应,不同温度下体系中
的混合气体置于密闭容器中反应,不同温度下体系中 的平衡转化率和
的平衡转化率和 、CO的选择性如图所示。
、CO的选择性如图所示。
 (或CO)的选择性
(或CO)的选择性
 催化加氢合成甲醇是重要的碳捕获利用与封存技术。
催化加氢合成甲醇是重要的碳捕获利用与封存技术。 催化加氢主要反应有:
催化加氢主要反应有:反应I.

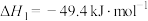
反应II.


压强分别为
 、
、 时,将
时,将 的混合气体置于密闭容器中反应,不同温度下体系中
的混合气体置于密闭容器中反应,不同温度下体系中 的平衡转化率和
的平衡转化率和 、CO的选择性如图所示。
、CO的选择性如图所示。 (或CO)的选择性
(或CO)的选择性

A.反应 为吸热反应 为吸热反应 |
B.曲线③、④表示CO的选择性,且 |
C.相同温度下,反应I、II的平衡常数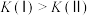 |
D.一定温度下,调整 ,可提高 ,可提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
2023-01-16更新
|
789次组卷
|
7卷引用:江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题11-14)
(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题11-14)江苏省南通市2022-2023学年高二上学期1月期末考试化学试题江苏省海安高级中学2022-2023学年高三下学期3月月考化学试题江苏省盐城市五校2022-2023学年高二下学期5月联考化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省锡东高级中学2023-2024学年高二下学期3月月考化学试题江苏省徐州市沛县第二中学2023-2024学年高三下学期开学化学试题
6 . 页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供于开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=_______ kJ/mol。
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。
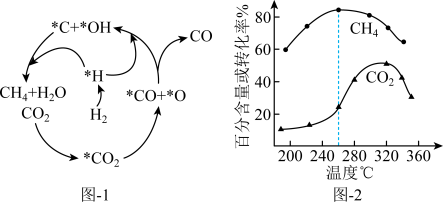
①260℃时,生成生要产物的所发生反应的化学方程式为_______ 。
②温度高于320℃,CO2的转化率下降的原因是_______ 。
③描述CO2转化为CO的反应机理_______ 。
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。
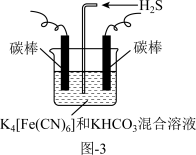
(3)电解时,阳极的电极反应式为_______ 。
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。
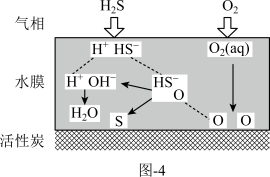
其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是_______ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。

①260℃时,生成生要产物的所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
③描述CO2转化为CO的反应机理
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。

(3)电解时,阳极的电极反应式为
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。

其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
您最近一年使用:0次
名校
7 . 恒压条件下,密闭容器中将CO2、H2按照体积比为1:3合成CH3OH,其中涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1= -49kJ·mol-l
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2= 41kJ·mol-l
在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图

已知:CH3OH的选择性=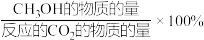
下列说法正确的是
Ⅰ.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1= -49kJ·mol-l
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2= 41kJ·mol-l
在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图

已知:CH3OH的选择性=
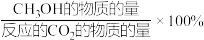
下列说法正确的是
A.反应 CO(g)+2H2(g) CH3OH(g) △H= 90kJ·mol-1 CH3OH(g) △H= 90kJ·mol-1 |
| B.合成甲醇的适宜工业条件是290℃,催化剂选择CZ(Zr-1)T |
| C.230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是230℃以上,升温对反应Ⅱ的影响更大 |
| D.保持恒压恒温下充入氦气,不影响CO2的转化率 |
您最近一年使用:0次
2022-12-17更新
|
599次组卷
|
4卷引用:江苏省靖江市2022-2023学年高三上学期调研测试化学试题
解题方法
8 . 有效去除大气中的 和水体中的氮是维持自然界氮循环的重要保证。
和水体中的氮是维持自然界氮循环的重要保证。
(1)已知:①

②

反应

_______ 。
(2)磷酸铵镁( )沉淀法可去除水体中的氨氮
)沉淀法可去除水体中的氨氮 和
和 )。实验室中模拟氨氮处理:将1L模拟氨氮废水(主要含
)。实验室中模拟氨氮处理:将1L模拟氨氮废水(主要含 )置于搅拌器上,设定反应温度为25℃,先后加入
)置于搅拌器上,设定反应温度为25℃,先后加入 和
和 溶液。将上述溶液分成两等分,用NaOH调节溶液pH分别为9和10,投加絮凝剂并搅拌。反应30min后,取清液测定氨氮质量浓度。实验测得pH为10时氨氮去除率较pH为9时的氨氮去除率低,可能原因是
溶液。将上述溶液分成两等分,用NaOH调节溶液pH分别为9和10,投加絮凝剂并搅拌。反应30min后,取清液测定氨氮质量浓度。实验测得pH为10时氨氮去除率较pH为9时的氨氮去除率低,可能原因是_______ 。
(3)选择合适的电极材料,可通过电解法将模拟氨氮废水全部转化为 。电解时,阳极发生多个电极反应。保持恒定电流电解相同时间,测得溶液初始pH对氨氮去除率及溶液中
。电解时,阳极发生多个电极反应。保持恒定电流电解相同时间,测得溶液初始pH对氨氮去除率及溶液中 的关系如图所示。
的关系如图所示。

①写出电解时阳极生成 的电极方程式:
的电极方程式:_______ 。
②初始pH从12增大到13时,溶液中 减小的可能原因是
减小的可能原因是_______ 。
(4)已知Ni的金属活动性与Fe相当,Pd不与稀酸反应。酸性条件下Al、Al/Ni、Al/Cu/Pd等金属还原硝酸盐的反应机理分别如图甲、乙、丙所示(图中ads表示活性吸附态)。

①甲中,每还原1 mol 理论上消耗Al的质量为
理论上消耗Al的质量为_______ g。
②描述乙中 被还原的过程:
被还原的过程:_______ 。
③要提高 转化为
转化为 的选择性,必须具备的条件是
的选择性,必须具备的条件是_______ 。
 和水体中的氮是维持自然界氮循环的重要保证。
和水体中的氮是维持自然界氮循环的重要保证。(1)已知:①


②


反应


(2)磷酸铵镁(
 )沉淀法可去除水体中的氨氮
)沉淀法可去除水体中的氨氮 和
和 )。实验室中模拟氨氮处理:将1L模拟氨氮废水(主要含
)。实验室中模拟氨氮处理:将1L模拟氨氮废水(主要含 )置于搅拌器上,设定反应温度为25℃,先后加入
)置于搅拌器上,设定反应温度为25℃,先后加入 和
和 溶液。将上述溶液分成两等分,用NaOH调节溶液pH分别为9和10,投加絮凝剂并搅拌。反应30min后,取清液测定氨氮质量浓度。实验测得pH为10时氨氮去除率较pH为9时的氨氮去除率低,可能原因是
溶液。将上述溶液分成两等分,用NaOH调节溶液pH分别为9和10,投加絮凝剂并搅拌。反应30min后,取清液测定氨氮质量浓度。实验测得pH为10时氨氮去除率较pH为9时的氨氮去除率低,可能原因是(3)选择合适的电极材料,可通过电解法将模拟氨氮废水全部转化为
 。电解时,阳极发生多个电极反应。保持恒定电流电解相同时间,测得溶液初始pH对氨氮去除率及溶液中
。电解时,阳极发生多个电极反应。保持恒定电流电解相同时间,测得溶液初始pH对氨氮去除率及溶液中 的关系如图所示。
的关系如图所示。
①写出电解时阳极生成
 的电极方程式:
的电极方程式:②初始pH从12增大到13时,溶液中
 减小的可能原因是
减小的可能原因是(4)已知Ni的金属活动性与Fe相当,Pd不与稀酸反应。酸性条件下Al、Al/Ni、Al/Cu/Pd等金属还原硝酸盐的反应机理分别如图甲、乙、丙所示(图中ads表示活性吸附态)。

①甲中,每还原1 mol
 理论上消耗Al的质量为
理论上消耗Al的质量为②描述乙中
 被还原的过程:
被还原的过程:③要提高
 转化为
转化为 的选择性,必须具备的条件是
的选择性,必须具备的条件是
您最近一年使用:0次
9 . 周期表中ⅥA族元素及其化合物应用广泛。用硫黄熏蒸中药材的传统由来已久; 是一种易燃的有毒气体(燃烧热为
是一种易燃的有毒气体(燃烧热为 ),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯(
),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯( )常作氯化剂或氯磺化剂。硒(
)常作氯化剂或氯磺化剂。硒( )和碲(
)和碲( )的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性
)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性 溶液制备Te。下列化学反应表示正确的是
溶液制备Te。下列化学反应表示正确的是
 是一种易燃的有毒气体(燃烧热为
是一种易燃的有毒气体(燃烧热为 ),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯(
),是制取多种硫化物的原料;硫酸、硫酸盐是重要化工原料;硫酰氯( )常作氯化剂或氯磺化剂。硒(
)常作氯化剂或氯磺化剂。硒( )和碲(
)和碲( )的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性
)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性 溶液制备Te。下列化学反应表示正确的是
溶液制备Te。下列化学反应表示正确的是A. 的燃烧: 的燃烧:  |
B. 和浓硫酸反应: 和浓硫酸反应: |
C.电解强碱性 溶液的阴极反应: 溶液的阴极反应: |
D.向 溶液中滴加足量 溶液中滴加足量 溶液,有白色沉淀生成: 溶液,有白色沉淀生成: |
您最近一年使用:0次
名校
10 . 气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)还原法:①用 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:
ⅰ:
ⅱ:
写出 还原
还原 至
至 和水蒸气的热化学方程式
和水蒸气的热化学方程式_______ 。
②尿素水溶液热解产生的 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:

a.尿素 中氮元素的化合价为
中氮元素的化合价为_______ 。
b.若氧化处理后的尾气中混有 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程_______ 。
③某脱硝反应机理如图-1所示, 参与Ⅰ的反应方程式为
参与Ⅰ的反应方程式为_______ 。

(2)氧化法: 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。
Ⅰ:
Ⅱ: (活化能
(活化能 )
)
Ⅲ: (活化能
(活化能 )
)
 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随 与
与 混合反应温度变化如图-2所示。试分析在
混合反应温度变化如图-2所示。试分析在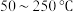 范围内,随着温度的升高
范围内,随着温度的升高 脱除率先几乎不变后下降的可能原因是
脱除率先几乎不变后下降的可能原因是_______ 。

(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以 (A、B均为过渡元素)为催化剂,用
(A、B均为过渡元素)为催化剂,用 还原
还原 的机理如下:
的机理如下:
第一阶段: (不稳定)
(不稳定) 低价态的金属离子(还原前后催化剂中金属原子的个数不变)
低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:Ⅰ.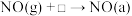 Ⅱ.
Ⅱ.
Ⅲ. Ⅳ.
Ⅳ.
Ⅴ.
注:表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原 得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
得到低价态的金属离子越多,第二阶段反应的速率越快,原因是_______ 。
(1)还原法:①用
 催化还原
催化还原 可以消除氮氧化物的污染。已知:
可以消除氮氧化物的污染。已知:ⅰ:

ⅱ:

写出
 还原
还原 至
至 和水蒸气的热化学方程式
和水蒸气的热化学方程式②尿素水溶液热解产生的
 可去除尾气中的
可去除尾气中的 ,流程如下:
,流程如下:
a.尿素
 中氮元素的化合价为
中氮元素的化合价为b.若氧化处理后的尾气中混有
 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低
,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程
的去除率。试分析硫酸盐的产生过程③某脱硝反应机理如图-1所示,
 参与Ⅰ的反应方程式为
参与Ⅰ的反应方程式为
(2)氧化法:
 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。Ⅰ:

Ⅱ:
 (活化能
(活化能 )
)Ⅲ:
 (活化能
(活化能 )
) 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,脱除率随 与
与 混合反应温度变化如图-2所示。试分析在
混合反应温度变化如图-2所示。试分析在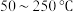 范围内,随着温度的升高
范围内,随着温度的升高 脱除率先几乎不变后下降的可能原因是
脱除率先几乎不变后下降的可能原因是
(3)研究表明氮氧化物的脱除率除了与还原剂、氧化剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以
 (A、B均为过渡元素)为催化剂,用
(A、B均为过渡元素)为催化剂,用 还原
还原 的机理如下:
的机理如下:第一阶段:
 (不稳定)
(不稳定) 低价态的金属离子(还原前后催化剂中金属原子的个数不变)
低价态的金属离子(还原前后催化剂中金属原子的个数不变)第二阶段:Ⅰ.
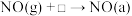 Ⅱ.
Ⅱ.
Ⅲ.
 Ⅳ.
Ⅳ.
Ⅴ.

注:表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原
 得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
您最近一年使用:0次
2022-12-17更新
|
562次组卷
|
3卷引用:江苏省南京师范大学附属中学、天一中学、海安中学、海门中学2022-2023学年高三上学期12月联考化学试题



