名校
1 . 氨及其盐都是重要的化工原料,有广泛的用途。
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。

①比较:p1____ p2(填“>”、“<”或“=”,下同)。
②当压强为p2时,在y点的v(正)____ v(逆)。
(2)研发氨燃料电池是当前科研的一个热点,如图所示。
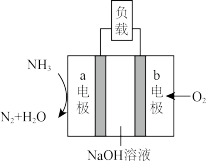
①该电池负极的电极反应式为____ 。
②当有6mol发生转移时,消耗NH3的质量为____ 。
③若该电池用于金属表面镀银,____ (填“a”或“b”)电极连接镀件(待镀金属)。
(3)传统工业以CO2与NH3为原料合成尿素的反应在进行时
分为如下两步:
第一步:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ•mol-1
第二步:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ•mol-1
①写出以CO2与NH3为原料合成尿素的热化学方程式____ 。
②为模拟工业合成尿素,某同学向体积为0.5L密闭容器中投入4molNH3和1molCO2,测得反应中各组分物质的量随时间的变化如图所示。反应进行到____ min时到达平衡。

(1)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
①比较:p1
②当压强为p2时,在y点的v(正)
(2)研发氨燃料电池是当前科研的一个热点,如图所示。

①该电池负极的电极反应式为
②当有6mol发生转移时,消耗NH3的质量为
③若该电池用于金属表面镀银,
(3)传统工业以CO2与NH3为原料合成尿素的反应在进行时
分为如下两步:
第一步:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ•mol-1
第二步:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ•mol-1
①写出以CO2与NH3为原料合成尿素的热化学方程式
②为模拟工业合成尿素,某同学向体积为0.5L密闭容器中投入4molNH3和1molCO2,测得反应中各组分物质的量随时间的变化如图所示。反应进行到

您最近一年使用:0次
2 . 合成气是一种重要的化工原料气,主要组分为CO和H2。用甲烷、二氧化碳自热重整可制备合成气,反应原理如下:
反应I:CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
反应II:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
反应III:CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+205.9kJ·mol-1
CO(g)+3H2(g) △H3=+205.9kJ·mol-1
反应IV:CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时 随温度的变化关系如图所示。下列说法正确的是
随温度的变化关系如图所示。下列说法正确的是

反应I:CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ·mol-1反应II:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.1kJ·mol-1
2CO(g)+2H2(g) △H2=+247.1kJ·mol-1反应III:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H3=+205.9kJ·mol-1
CO(g)+3H2(g) △H3=+205.9kJ·mol-1反应IV:CO2(g)+H2(g)
 CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4不同温度下,向体积为VL的含少量O2的恒压容器按照n(CO2):n(CH4)=1投料,实验测得不同压强下平衡时
 随温度的变化关系如图所示。下列说法正确的是
随温度的变化关系如图所示。下列说法正确的是
| A.△H4=-41.2kJ·mol-1 |
| B.某温度下,反应II的平衡常数随压强增大而减小 |
| C.由图可知,p1>p2>p3 |
| D.压强为p2时,T>Tm后,升高温度对反应IV的促进作用更大 |
您最近一年使用:0次
2022-09-26更新
|
271次组卷
|
2卷引用:江苏省如东高级中学2023届高三上学期期初学情检测化学试题
名校
解题方法
3 . 通过以下反应均可获取H2。下列有关说法不正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6kJ•mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ•mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ•mol–1
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6kJ•mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3kJ•mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=+206.1kJ•mol–1
| A.H2的燃烧热为285.8kJ•mol-1 |
| B.反应②中E(反应物键能总和)>E(生成物键能总和) |
| C.反应C(s)+2H2(g)=CH4(g)的ΔH=+74.8kJ•mol–1 |
| D.2H2O(g)=2H2(g)+O2(g) ΔH<+571.6kJ•mol-1 |
您最近一年使用:0次
2022-09-23更新
|
427次组卷
|
3卷引用:江苏省如皋中学2022-2023学年高三上学期8月综合测试化学试题
名校
解题方法
4 . 十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如图所示:
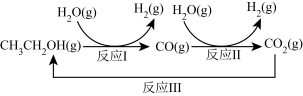
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H1=-41kJ/mol
CO2(g)+H2(g) △H1=-41kJ/mol
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) △H2= +174.1kJ/mol
2CO2(g)+6H2(g) △H2= +174.1kJ/mol
请写出反应Ⅰ的热化学方程式:_______ 。
(2)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:_______ ;每生成0.5mol乙醇,理论上需消耗铅蓄电池中_______ mol硫酸。

(3)据文献报道, CO2可在碱性水溶液中电解生成CH4,写出生成CH4的电极反应式为:_______ 。
(4)在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:
①5 min时B的物质的量浓度为_______ 。
②5 min内用A表示的化学反应速率v(A)为_______ 。
③化学方程式中n为_______ 。

(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) △H1=-41kJ/mol
CO2(g)+H2(g) △H1=-41kJ/molCH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g) △H2= +174.1kJ/mol
2CO2(g)+6H2(g) △H2= +174.1kJ/mol请写出反应Ⅰ的热化学方程式:
(2)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。该电解池阴极上的电极反应式为:

(3)据文献报道, CO2可在碱性水溶液中电解生成CH4,写出生成CH4的电极反应式为:
(4)在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)
 3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:
3C(g)+nD(g),开始时A为4 mol,B为6 mol;5 min时测得生成C 3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。试回答下列问题:①5 min时B的物质的量浓度为
②5 min内用A表示的化学反应速率v(A)为
③化学方程式中n为
您最近一年使用:0次
2022-09-23更新
|
261次组卷
|
4卷引用:江苏省连云港高级中学2022-2023高二上学期第一次阶段测试化学试题
名校
5 . 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:

反应Ⅱ:

表中所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
(1)由表中数据判断
_______ (填“>”“<”或“=”)0;反应

_______ (用 和
和 表示)。
表示)。
(2)在一定条件下将2molCO和6molH2充入2L的密闭容器中发生反应Ⅰ,5min后测得一氧化碳浓度为0.5mol/L,计算可得此段时间的反应速率(用H2表示)为_______ 。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是_______(填序号)。
(4)保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均减小为原来的 ,则化学平衡
,则化学平衡_______ (填“正向”“逆向”或“不”)移动,平衡常数
_______ (填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是_______ (填“Ⅰ”或“Ⅱ”)。
反应Ⅰ:


反应Ⅱ:


表中所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断



 和
和 表示)。
表示)。(2)在一定条件下将2molCO和6molH2充入2L的密闭容器中发生反应Ⅰ,5min后测得一氧化碳浓度为0.5mol/L,计算可得此段时间的反应速率(用H2表示)为
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是_______(填序号)。
| A.充入CO,使体系总压强增大 | B.将 从体系中分离 从体系中分离 |
| C.充入He,使体系总压强增大 | D.使用高效催化剂 |
 ,则化学平衡
,则化学平衡
(5)比较这两种合成甲醇的方法,原子利用率较高的是
您最近一年使用:0次
2022-09-22更新
|
276次组卷
|
2卷引用:江苏省淮安市金湖中学、洪泽中学等四校2022-2023学年高二上学期第一次学情调查化学试题
名校
解题方法
6 . 工业上利用碳热还原 制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。

已知:碳热还原 过程中可能发生下列反应。
过程中可能发生下列反应。
ⅰ.

ⅱ.
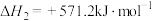

ⅲ.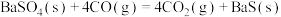
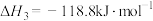

下列关于碳热还原 过程的说法正确的是
过程的说法正确的是
 制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
已知:碳热还原
 过程中可能发生下列反应。
过程中可能发生下列反应。ⅰ.


ⅱ.

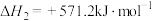

ⅲ.
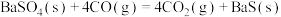
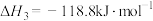

下列关于碳热还原
 过程的说法正确的是
过程的说法正确的是A.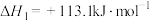 , ,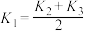 |
B.400℃后,反应后组分的变化是由 的移动导致的 的移动导致的 |
C.温度升高, 的平衡常数K减小 的平衡常数K减小 |
D.反应过程中,生成的 和CO的物质的量之和始终等于投入C的物质的量 和CO的物质的量之和始终等于投入C的物质的量 |
您最近一年使用:0次
2022-09-14更新
|
224次组卷
|
3卷引用:江苏省南通市海安市实验中学2022-2023学年高二上学期9月月考化学试题
7 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕捉和碳利用技术则是关键。通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)已知:CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
 (g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1
(g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1
HOCH2CH2OH(g) + H2(g) → C2H5OH(g) + H2O(g) ∆H2=−94.8kJ∙mol−1
获取乙二醇的反应历程可分为如下2步:
I. (g)+CO2(g)→
(g)+CO2(g)→ 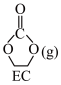 ∆H3=−60.3kJ∙mol−1
∆H3=−60.3kJ∙mol−1
II.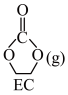 +3H2(g)
+3H2(g) HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4
HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4
①步骤II中 ∆H4=___________ 。
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
由上表可知,温度越高,EC的转化率越高,原因是___________ 。温度升高到220℃时,乙二醇的产率反而降低,原因是_____ 。
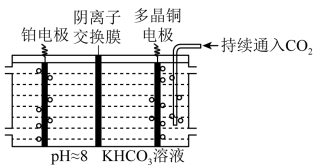
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____
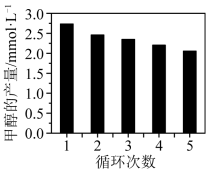
(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_______ (已知Co的性质与Fe相似)
(1)已知:CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
 (g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1
(g) + CO2(g) + 3H2(g)→HOCH2CH2OH(g) + CH3OH(g) ∆H1=−131.9kJ∙mol−1HOCH2CH2OH(g) + H2(g) → C2H5OH(g) + H2O(g) ∆H2=−94.8kJ∙mol−1
获取乙二醇的反应历程可分为如下2步:
I.
 (g)+CO2(g)→
(g)+CO2(g)→  ∆H3=−60.3kJ∙mol−1
∆H3=−60.3kJ∙mol−1II.
 +3H2(g)
+3H2(g) HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4
HOCH2CH2OH(g) (g)+CH3OH(g) ∆H4①步骤II中 ∆H4=
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
| 反应温度/℃ | EC转化率/% | 乙二醇产率/% |
| 160 | 23.8 | 23.2 |
| 180 | 62.1 | 60.9 |
| 200 | 99.9 | 94.7 |
| 220 | 99.9 | 92.4 |
由上表可知,温度越高,EC的转化率越高,原因是
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2与H2反应如果用Co/C作为催化剂,可以得到含有少量甲酸的甲醇。为了研究催化剂的催化效率,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因

您最近一年使用:0次
22-23高三上·江苏南通·开学考试
8 . 丙烯是一种重要的有机化工原料,工业上以丁烯、乙烯为原料制取丙烯的反应如下: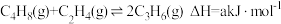 ,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。
,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。

已知几种气体的燃烧热如下表所示
下列说法正确的是
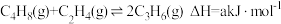 ,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。
,一定温度下,向体积为V L密闭容器中充入1 mol C4H8(g)和1 mol C2H4(g),测得C3H6的体积分数随时间的变化如图中线I所示。
已知几种气体的燃烧热如下表所示
| 气体 | C2H4(g) | C3H6(g) | C4H8(g) |
| 燃烧热/kJ/mol | 1411 | 2049 | 2539 |
| A.C4H8(g)燃烧的热化学方程式可表示为C4H8(g)+6O2(g)=4CO2(g)+4H2O(g) △H=-2539 kJ/mol |
| B.a=148 |
| C.该温度下反应的平衡常数为64 |
| D.图中线Ⅱ可能是其他条件一定,反应在更高温度时进行 |
您最近一年使用:0次
名校
9 . 黄铁矿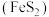 是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化: 。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有:
。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有: ;
; 。
。 的反应机理如下:
的反应机理如下:
反应Ⅰ: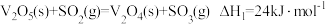
反应Ⅱ:
反应中的能量变化如题图,下列说法不正确的是

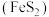 是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化:
是一种重要的含铁矿物,在潮湿空气中会被缓慢氧化: 。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有:
。工业上常选择黄铁矿为原料制备硫酸,其中发生的反应有: ;
; 。
。 的反应机理如下:
的反应机理如下:反应Ⅰ:
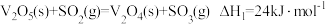
反应Ⅱ:

反应中的能量变化如题图,下列说法不正确的是

A. | B.反应Ⅰ的 |
C.通入过量空气,可提高 的平衡转化率 的平衡转化率 | D.反应速率由反应Ⅰ决定 |
您最近一年使用:0次
2022-09-13更新
|
285次组卷
|
2卷引用:江苏省扬州市江都区邵伯高级中学2022-2023学年高三上学期期初考试化学试题
名校
10 . 二甲醚( )被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①
②
③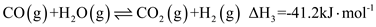
回答下列问题:
(1)反应
___________  。下列措施中,能提高
。下列措施中,能提高 产率的有
产率的有___________ 。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以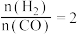 通入
通入 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应: ,其
,其 的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是___________ 。

A.
B.
C.若在P3和 时,起始
时,起始 ,则达到平衡时,CO转化率小于50%
,则达到平衡时,CO转化率小于50%
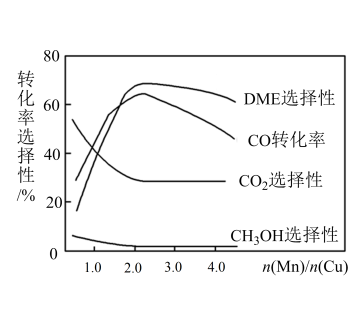
(3)采用一种新型的催化剂(主要成分是 的合金),利用CO和H2制备二甲醚。观察图回答问题。催化剂中
的合金),利用CO和H2制备二甲醚。观察图回答问题。催化剂中 约为
约为___________ 时最有利于二甲醚的合成。
(4)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a极生成的气体是___________ ,b电极的电极反应式为___________ 。

(5)甲醇液相脱水法制二甲醚的原理是:
 ,
, 。
。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是___________ 。
 )被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:①

②

③
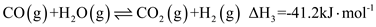
回答下列问题:
(1)反应

 。下列措施中,能提高
。下列措施中,能提高 产率的有
产率的有A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以
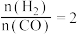 通入
通入 的反应器中,一定条件下发生反应:
的反应器中,一定条件下发生反应: ,其
,其 的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
A.

B.

C.若在P3和
 时,起始
时,起始 ,则达到平衡时,CO转化率小于50%
,则达到平衡时,CO转化率小于50%(3)采用一种新型的催化剂(主要成分是
 的合金),利用CO和H2制备二甲醚。观察图回答问题。催化剂中
的合金),利用CO和H2制备二甲醚。观察图回答问题。催化剂中 约为
约为
(4)下图为绿色电源“二甲醚燃料电池”的工作原理示意图,a极生成的气体是

(5)甲醇液相脱水法制二甲醚的原理是:
 ,
, 。
。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
您最近一年使用:0次



