名校
1 . 在其他条件相同时,可逆反应N2+O2⇌2NO分别在有、无催化剂时的能量变化与反应进程如图所示。下列说法中正确的是
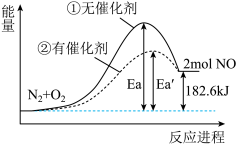

| A.该反应为放热反应 |
B.加入催化剂使反应热 H发生了改变 H发生了改变 |
| C.加入催化剂使体系活化分子百分数增加 |
| D.0.1mol N2和0.1molO2充分反应吸热18.26 kJ |
您最近一年使用:0次
2020-12-14更新
|
130次组卷
|
2卷引用:陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题
名校
解题方法
2 . 已知反应2NO(g) + 2H2(g)⇌N2(g) +2H2O(g),△H1= -752kJ·mol-1 的反应机理如下:
①2NO(g)⇌N2O2(g)(快)
②N2O2(g) + H2(g)⇌N2O(g) + H2O(g)(慢)
③N2O(g) + H2(g)⇌N2(g) +H2O(g)(快)
下列有关说法正确的是
①2NO(g)⇌N2O2(g)(快)
②N2O2(g) + H2(g)⇌N2O(g) + H2O(g)(慢)
③N2O(g) + H2(g)⇌N2(g) +H2O(g)(快)
下列有关说法正确的是
| A.①的逆反应速率小于②的正反应速率 | B.②中 与 与 的碰撞仅部分有效 的碰撞仅部分有效 |
C. 和 和 是该反应的催化剂 是该反应的催化剂 | D.总反应中逆反应的活化能比正反应的活化能小 |
您最近一年使用:0次
2020-12-14更新
|
316次组卷
|
4卷引用:湖南省长沙县第九中学2020-2021学年高二上学期第三次月考化学试题
解题方法
3 . 在一定温度下,H2(g)+I2(g) 2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是
2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是

 2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是
2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是
| A.该反应为放热反应 |
| B.该反应的△H=Ea'-Ea |
| C.该反应中加入催化剂,可增大反应速率,同时改变焓变 |
| D.温度升高,单位体积的活化分子百分数增加,反应速率加快,且平衡逆向移动 |
您最近一年使用:0次
4 . 下列说法正确的是
| A.升高温度,活化分子百分数增多,反应速率加快 |
| B.使用催化剂,降低△H,提高反应速率 |
| C.对于体积不变的气体反应,充入稀有气体提高压强,平衡会移动 |
| D.活化能越高,反应速率越大 |
您最近一年使用:0次
5 . 氮的氧化物是造成大气污染的主要物质,研究氮氧化物间的相互转化及脱除具有重要意义。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步2NO(g) N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步N2O2(g)+O2(g) 2NO2(g)(慢反应)
2NO2(g)(慢反应)
①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数,则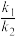 =
=___________ 。
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是___________ (填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)2NO2(g) N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与
N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与 (T为温度)的关系如图。
(T为温度)的关系如图。
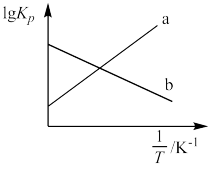
①能正确表示lgKP与 关系的曲线是
关系的曲线是___________ (填“a”或“b”)。
②298K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100kPa。已知KP=2.7×10-3kPa-1,则NO2的转化率为___________ 。
II.烟气中氮氧化物的脱除
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
△H1=___________ 。
(4)以连二亚硫酸盐(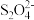 )为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
)为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
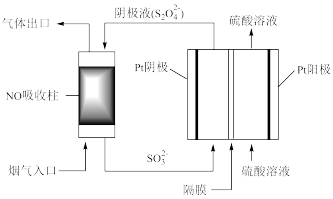
阴极的电极反应式为___________ ,电解槽中的隔膜为___________ (填“阳”或“阴”)离子交换膜。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步2NO(g)
 N2O2(g)(快速平衡)
N2O2(g)(快速平衡)第二步N2O2(g)+O2(g)
 2NO2(g)(慢反应)
2NO2(g)(慢反应)①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数,则
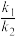 =
=②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)2NO2(g)
 N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与
N2O4(g) (△H<0),用分压(某组分的分压等于总压与其物质的量分数的积)表示的平衡常数KP与 (T为温度)的关系如图。
(T为温度)的关系如图。
①能正确表示lgKP与
 关系的曲线是
关系的曲线是②298K时,在体积固定的密闭容器中充入一定量的NO2,平衡时NO2的分压为100kPa。已知KP=2.7×10-3kPa-1,则NO2的转化率为
II.烟气中氮氧化物的脱除
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
△H1=
(4)以连二亚硫酸盐(
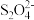 )为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
)为还原剂脱除烟气中的NO,并通过电解再生,装置如下图。
阴极的电极反应式为
您最近一年使用:0次
2020-12-14更新
|
285次组卷
|
3卷引用:河南省实验中学2021届高三上学期期中考试化学试题
20-21高三上·浙江·期中
6 . 氯化碘(ICl)是一种卤素互化物,与氢气反应分①、②两步进行,其能量曲线如图所示,下列说法不正确的是


| A.反应①、反应②均为放热反应 |
| B.反应①、反应②均为氧化还原反应 |
| C.总反应速率的快慢由反应①决定 |
| D.反应①与反应②的活化能之和为218kJ/mol |
您最近一年使用:0次
20-21高三上·浙江·期中
解题方法
7 . 碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)⇌2HI(g)△H =-9.48 kJ/mol
②I2(s)+H2(g)⇌2HI(g)△H=+26.48 kJ/mol
下列说法正确的是
①I2(g)+H2(g)⇌2HI(g)△H =-9.48 kJ/mol
②I2(s)+H2(g)⇌2HI(g)△H=+26.48 kJ/mol
下列说法正确的是
| A.该条件下,1 molH2(g)和足量I2(g)充分反应,放出热量9.48 kJ |
| B.该条件下,碘升华的热化学方程式为I2(s)⇌I2(g)△H=+35.96 kJ/mol |
| C.相同条件下,Cl2(g)+H2(g)⇌2HCl(g)的△H>-9.48 kJ/mol |
| D.反应①是放热反应,所以反应①的活化能大于反应②的活化能 |
您最近一年使用:0次
20-21高二上·浙江·期中
名校
8 . 下列说法正确的是
①活化分子间的碰撞一定能发生化学反应;
②普通分子有时也能发生有效碰撞;
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数;
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多;
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大;
⑥化学反应的实质是活化分子有合适取向时的有效碰撞
①活化分子间的碰撞一定能发生化学反应;
②普通分子有时也能发生有效碰撞;
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数;
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多;
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大;
⑥化学反应的实质是活化分子有合适取向时的有效碰撞
| A.①②⑤ | B.③④⑥ | C.③④⑤ | D.②③④ |
您最近一年使用:0次
2020-12-11更新
|
385次组卷
|
5卷引用:【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】
(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题(已下线)第07讲 活化能(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
解题方法
9 . 有关碰撞理论,下列说法中正确的是
| A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
| B.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
| C.升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能,但能影响化学反应速率 |
您最近一年使用:0次
2020-12-10更新
|
200次组卷
|
2卷引用:浙江省温州市环大罗山联盟2020-2021学年高二上学期期中考试化学试题
解题方法
10 . 已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I表示中间体。下列说法正确的是
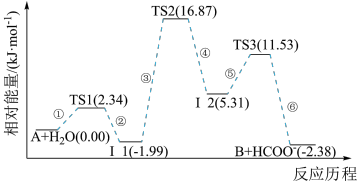

| A.化合物A与H2O之间的碰撞不均为有效碰撞 |
| B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1 |
| C.使用更高效的催化剂可降低反应所需的活化能和反应热 |
| D.升高温度,有利于该反应正向进行 |
您最近一年使用:0次
2020-12-10更新
|
790次组卷
|
8卷引用:河南省名校联盟2020-2021学年高二上学期期中考试化学试题
河南省名校联盟2020-2021学年高二上学期期中考试化学试题河南省沈丘县长安高级中学2020-2021学年高二上学期期中考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 反应机理图(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题二 化学反应机理图象(练)



