20-21高二上·浙江绍兴·阶段练习
名校
1 . 有气体参加的反应中,能使反应物中活化分子数和活化分子百分数都增大的方法是
①增大反应物浓度②增大压强③升高温度④加入催化剂
①增大反应物浓度②增大压强③升高温度④加入催化剂
| A.①②③ | B.②③④ | C.①③④ | D.③④ |
您最近一年使用:0次
2021-01-02更新
|
171次组卷
|
5卷引用:【浙江新东方】绍兴qw122
(已下线)【浙江新东方】绍兴qw122宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高二上】【高中化学】【00135】(已下线)2.1.3 活化能(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)云南省保山市腾冲市第八中学2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+=N2+FeO+ ②FeO++CO=CO2+Fe+。下列说法正确的是
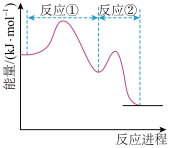

| A.若转移1 mol电子,则消耗11.2 L N2O |
| B.Fe+使反应的活化能减小,FeO+是中间产物 |
| C.两步反应均为放热反应,总反应的化学反应速率由反应②决定 |
| D.在整个历程中只有非极性键的断裂和形成 |
您最近一年使用:0次
2021-01-01更新
|
241次组卷
|
3卷引用:吉林省东北师范大学附属中学2021届高三上学期第三次摸底考试化学试题
名校
解题方法
3 . 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成甲醇、氨气等工业领域中。回答下列问题:
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图1所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH___ 0(填“>、=或<”),该历程中决速步(决定总反应速率的关键步骤)对应的化学方程式___ 。


(2)用水煤气变换所得的CO2(g)和H2(g)可以合成甲醇,可能发生的反应如下:
反应ⅠCO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH1=-58kJ·mol-1
CH3OH(g)+H2O(g)ΔH1=-58kJ·mol-1
反应ⅡCO2(g)+H2(g)=CO(g)+H2O(g)ΔH2
向刚性容器中按初始体积比为1:3充入CO2(g)和H2(g),在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2(g)的转化率和甲醇的选择性(甲醇的选择性= ×100%)随温度的变化如图2所示。
×100%)随温度的变化如图2所示。
①由图2可知,催化效果Cat.1__ Cat.2(填“>、=或<”)。
②在210~270℃间,CH3OH的选择性随温度的升高而下降,可能的原因是__ 。
③若使用催化剂Cat.1,温度为T℃时,CO2(g)转化率为a%,此时甲醇的选择性为b%,则该反应混合物中甲醇的体积分数为___ %。
(3)可以由水煤气变换所得的H2(g)和分离液态空气所得的N2(g)在高温高压及铁触媒条件下合成氨。
①基态N原子的价电子排布图为__ 。
②合成氨工业通常将氨液化后分离出来,再将N2(g)和H2(g)循环使用。氨容易液化的原因有二:一是氨分子为极性分子,二是__ ;氨分子的价层电子互斥模型为__ 。
③一定条件下,氨气可以和铁反应生成Fe4N,其晶胞与钛酸钙晶胞属于相同类型的晶胞,两种晶胞如图3所示。甲中N原子与乙中__ 原子的空间位置相同。

(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图1所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH


(2)用水煤气变换所得的CO2(g)和H2(g)可以合成甲醇,可能发生的反应如下:
反应ⅠCO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH1=-58kJ·mol-1
CH3OH(g)+H2O(g)ΔH1=-58kJ·mol-1反应ⅡCO2(g)+H2(g)=CO(g)+H2O(g)ΔH2
向刚性容器中按初始体积比为1:3充入CO2(g)和H2(g),在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2(g)的转化率和甲醇的选择性(甲醇的选择性=
 ×100%)随温度的变化如图2所示。
×100%)随温度的变化如图2所示。①由图2可知,催化效果Cat.1
②在210~270℃间,CH3OH的选择性随温度的升高而下降,可能的原因是
③若使用催化剂Cat.1,温度为T℃时,CO2(g)转化率为a%,此时甲醇的选择性为b%,则该反应混合物中甲醇的体积分数为
(3)可以由水煤气变换所得的H2(g)和分离液态空气所得的N2(g)在高温高压及铁触媒条件下合成氨。
①基态N原子的价电子排布图为
②合成氨工业通常将氨液化后分离出来,再将N2(g)和H2(g)循环使用。氨容易液化的原因有二:一是氨分子为极性分子,二是
③一定条件下,氨气可以和铁反应生成Fe4N,其晶胞与钛酸钙晶胞属于相同类型的晶胞,两种晶胞如图3所示。甲中N原子与乙中

您最近一年使用:0次
名校
4 . 下列利用相关数据作出的推理或判断一定正确的是
| A.利用焓变数据判断反应能否自发进行 |
| B.利用反应热数据判断反应速率的大小 |
| C.利用平衡常数判断反应进行的程度大小 |
| D.利用反应的活化能数据判断反应热的大小 |
您最近一年使用:0次
2020-12-29更新
|
385次组卷
|
4卷引用:广东省广州市执信中学(广雅,执信,二中联考)2019-2020学年高二上学期期末考试化学试题
名校
5 . 下列有关研究化学反应原理的叙述中, 正确的是
| A.利用原电池的工作原理可将任何放热反应的化学能转化为电能 |
| B.研究化学反应速率与化学平衡,有利于指导实际生产中达到“多快好省”的生产效率 |
| C.研究表明升高温度能提高反应的活化能,增大活化分子发生有效碰撞的机会,加快反应速率 |
| D.通过改变反应条件,能使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用 |
您最近一年使用:0次
2020-12-29更新
|
305次组卷
|
2卷引用:广东省广州市执信中学(广雅,执信,二中联考)2019-2020学年高二上学期期末考试化学试题
解题方法
6 . 一定条件下,CO2(g)+3H2(g)⇌H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1;向2 L恒容恒温密闭容器中充入1 mol CO2和2.8 mol H2反应,图中过程Ⅰ、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法中不正确的是( )
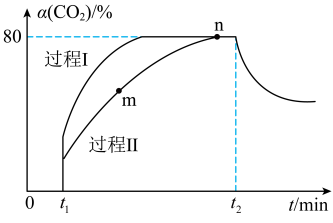

| A.m点:v正>v逆 |
| B.活化能:过程Ⅱ>过程Ⅰ |
| C.已知平衡时n点总压强为P ,该反应的压强平衡常数KP=200× P-2 |
| D.过程Ⅰ,t2时刻改变的反应条件可能是升高温度 |
您最近一年使用:0次
名校
7 . 下列条件中,不改变活化分子百分率但仍可以加快反应速率的是
| A.加热 | B.减压 | C.加催化剂 | D.加大反应物浓度 |
您最近一年使用:0次
8 . 近年来,研究发现硫的单质和化合物在一次能源的转化、存储和释放中有重要应用。回答下列问题:
(1)有学者指出:含硫物质可进行太阳能的转化和存储,具体过程如图所示。
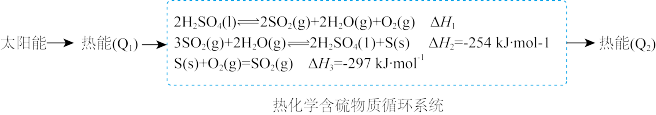
①△H1=_______________________ 。
②经上述过程实际存储的热能Q2小于Q1,原因为______________________ 。
(2)SO2在含KI的溶液中发生反应的能量变化如图所示。
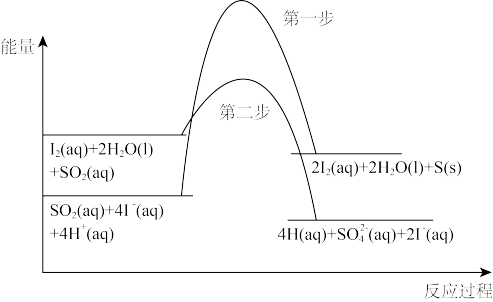
①总反应的化学方程式为_______________ (各物质需标明状态)。
②转化过程中的决速步骤为___________ (填“第一步”或“第二步”)。
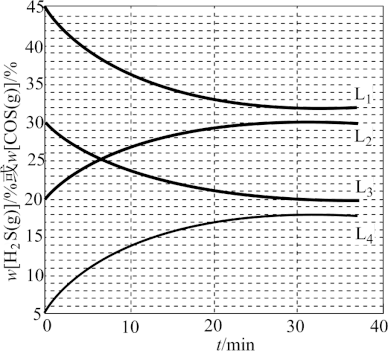
(3)反应H2S(g) + CO2 (g) COS(g)+ H2O(g)△H>0 可用于制备有机化工原料COS。
COS(g)+ H2O(g)△H>0 可用于制备有机化工原料COS。
①275°C时,将等物质的量的H2S(g)与CO2(g)充入密闭容器中,测得H2O(g)的平衡体积分数为26%。则CO2(g)的平衡转化率α=__________ 。
②在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数( )随时间(t)的变化关系如图所示。起始密闭容器中
)随时间(t)的变化关系如图所示。起始密闭容器中 [H2S(g)]和
[H2S(g)]和 [CO2(g)]、
[CO2(g)]、 [COS(g)]和
[COS(g)]和 [H2O(g)]分别相等。则300℃时反应的平衡常数K=
[H2O(g)]分别相等。则300℃时反应的平衡常数K=________ ;320 ℃时 [H2S(g)]、
[H2S(g)]、 [COS(g)]随时间变化的曲线分别为
[COS(g)]随时间变化的曲线分别为_____________ 、______________ 。
(1)有学者指出:含硫物质可进行太阳能的转化和存储,具体过程如图所示。
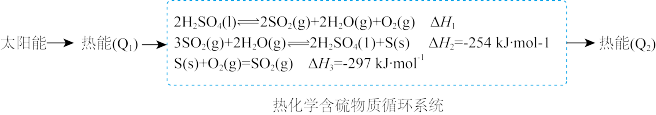
①△H1=
②经上述过程实际存储的热能Q2小于Q1,原因为
(2)SO2在含KI的溶液中发生反应的能量变化如图所示。

①总反应的化学方程式为
②转化过程中的决速步骤为
(3)反应H2S(g) + CO2 (g)
 COS(g)+ H2O(g)△H>0 可用于制备有机化工原料COS。
COS(g)+ H2O(g)△H>0 可用于制备有机化工原料COS。①275°C时,将等物质的量的H2S(g)与CO2(g)充入密闭容器中,测得H2O(g)的平衡体积分数为26%。则CO2(g)的平衡转化率α=
②在300℃、320℃时上述反应中H2S(g)和COS(g)的体积分数(
 )随时间(t)的变化关系如图所示。起始密闭容器中
)随时间(t)的变化关系如图所示。起始密闭容器中 [H2S(g)]和
[H2S(g)]和 [CO2(g)]、
[CO2(g)]、 [COS(g)]和
[COS(g)]和 [H2O(g)]分别相等。则300℃时反应的平衡常数K=
[H2O(g)]分别相等。则300℃时反应的平衡常数K= [H2S(g)]、
[H2S(g)]、 [COS(g)]随时间变化的曲线分别为
[COS(g)]随时间变化的曲线分别为
您最近一年使用:0次
名校
9 . 在含有少量的 的溶液中,
的溶液中, 分解原理为:
分解原理为: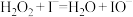 (慢反应),
(慢反应), (快反应)。已知分解
(快反应)。已知分解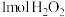 放出热量
放出热量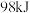 。下列说法正确的是
。下列说法正确的是
 的溶液中,
的溶液中, 分解原理为:
分解原理为: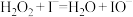 (慢反应),
(慢反应), (快反应)。已知分解
(快反应)。已知分解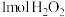 放出热量
放出热量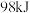 。下列说法正确的是
。下列说法正确的是A.反应的速率与 浓度有关 浓度有关 |
B. 和 和 是该反应的催化剂 是该反应的催化剂 |
C.速率关系为: |
D.反应活化能等于 |
您最近一年使用:0次
2020-12-25更新
|
162次组卷
|
3卷引用:福建省三明市德化一中、漳平一中、永安一中三校协作2020-2021学年高二12月联考化学试题
10 . FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是_____ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3.完成NaClO3氧化FeCl2的离子方程式: +Fe2++ _____=Cl-+Fe3++____,
+Fe2++ _____=Cl-+Fe3++____,________ 。
(3)制备无水氯化铁
已知:FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
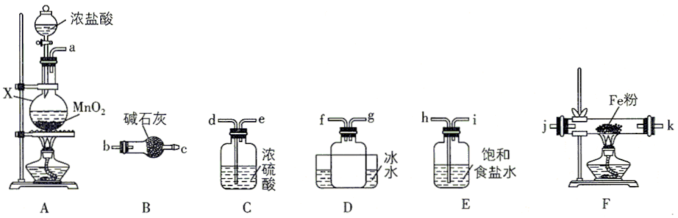
①装置的连接顺序为a→____ → j,k →_____ (按气流方向,用小写字母表示)。
②实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为_____ 。
(4)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①_______
④实验结论:反应(i)、(ii)的活化能大小关系是:E(i)_____ E(ii)(填“>”、 “<”或“=”,下同),平衡常数大小关系是:K(i)_____ K(ii)。
⑤另取5 mL l mol L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施__________ 。
(1)FeCl3净水的原理是
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3.完成NaClO3氧化FeCl2的离子方程式:
 +Fe2++ _____=Cl-+Fe3++____,
+Fe2++ _____=Cl-+Fe3++____,(3)制备无水氯化铁
已知:FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解

①装置的连接顺序为a→
②实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为
(4)探究FeCl3与SO2的反应
已知反应体系中存在下列两种化学变化:
(i) Fe3+与SO2发生络合反应生成Fe(SO2)62+(红棕色);
(ii) Fe3+与SO2发生氧化还原反应,其离子方程式为①
步骤 | 现象 | 结论 |
| Ⅰ.取5 mL1 mol⋅L−1 FeCl3溶液于试管中,通入SO2至饱和 | 溶液很快由黄色变为红棕色 | |
| Ⅱ.用激光笔照射步骤Ⅰ中的红棕色溶液 | 溶液中无明显光路 | ②红棕色物质不是 |
| Ⅲ .将步骤Ⅰ中的溶液静置 | 1小时后,溶液逐渐变为浅绿色 | |
| IV.向步骤Ⅲ中溶液加入2滴K3[Fe(CN)6]溶液 | ③ | 溶液中含有Fe2+ |
⑤另取5 mL l mol
 L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施
L-l FeC13溶液,先滴加2滴浓盐酸,再通入SO2至饱和。几分钟后,溶液由黄色变为浅绿色,由此可知:促使氧化还原反应(ii)快速发生可采取的措施
您最近一年使用:0次



