名校
1 . 下列措施能降低化学反应的活化能,提高反应速率的是
| A.增大反应物浓度 | B.加催化剂 |
| C.加压 | D.升温 |
您最近一年使用:0次
2021-01-28更新
|
233次组卷
|
8卷引用:黑龙江省嫩江市高级中学2020-2021学年高二上学期9月月考化学试题
2 . 运用相关化学知识进行判断,下列结论错误 的是
| A.对于一个给定的反应,选择合适的催化剂可以降低反应物的总能量,改变正逆反应速率 |
| B.某反应的化学平衡常数K越大,它的正向反应进行的程度越大,反应物的转化率越大 |
| C.可燃冰是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.铁与稀硫酸反应制取氢气,向溶液中加入少量的CuSO4固体可以加快化学反应速率 |
您最近一年使用:0次
名校
3 . 研究表明,甲醇通过催化氧化制取甲醛时,在无催化剂(图中实线)和加入特定催化剂(图中虚线)时均会产生甲醛,其反应中物质的相对能量如图所示。下列说法错误的是


| A.该条件下CO2比CO的稳定性强 |
| B.无催化剂时,生成CO比生成甲醛的活化能小 |
| C.无催化剂时,温度升高,生成甲醛的正反应速率增大的程度比逆反应速率增大程度大 |
| D.加入该催化剂可提高此过程的各反应的速率,但不能改变反应的焓变 |
您最近一年使用:0次
名校
4 . 下列有关说法正确的是
| A.NaOH溶液与稀盐酸反应的活化能几乎为零 |
| B.升高温度和增大压强都可以提高反应体系内活化分子百分数 |
| C.过程的自发性不仅能用于判断其方向性,也能确定其是否一定会发生 |
| D.对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大 |
您最近一年使用:0次
名校
解题方法
5 . 氮和硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)⇌2NO2(g)的反应历程由下列①②两步基元反应组成,相关信息如下:(E为活化能,v为反应速率,k为速率常数)
①2NO(g)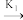 N2O2(g) E正= 82 kJ·mol-1v = klc2(NO)
N2O2(g) E正= 82 kJ·mol-1v = klc2(NO)
N2O2(g)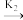 2NO(g) E逆= 205 kJ·mol-1v = k2c(N2O2)
2NO(g) E逆= 205 kJ·mol-1v = k2c(N2O2)
②N2O2(g)+O2(g)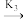 2NO2(g) E正= 82 kJ·mol-1v= k3c(N2O2)·c(O2)
2NO2(g) E正= 82 kJ·mol-1v= k3c(N2O2)·c(O2)
2NO2(g) N2O2(g)+O2(g) E逆= 72 KJ·mol-1v = k4c2(NO2)
N2O2(g)+O2(g) E逆= 72 KJ·mol-1v = k4c2(NO2)
则:2NO(g)+O2(g)⇌2NO2(g)△H=_______ kJ·mol-1;其平衡常数K与上述速率常数k1、k2、k3、k4的关系式为K=_______ 。
(2)2SO2(g)+O2(g)⇌2SO3(g)反应过程中能量变化如图1所示。

①在V2O5存在时,该反应的机理为:
V2O5+ SO2=2VO2+SO3(快)
_______ (慢)。
②下列说法正确的是_______ (填字母代号)。
a.V2O5的质量或形状不影响反应速率
b.有催化剂存在时∣△H∣<198 kJ·mol-l
c.增大O2的浓度可显著提高反应速率
(3)已知反应NO2(g)+SO2(g)⇌NO(g)+SO3(g)△H <0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lg p(NO2)和lg p(SO3)两个压强对数的关系如图2所示,实验初始时体系中的p( NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
①T1_______ T2(填“>” “<”或者“=” ),温度为T1时化学平衡常数KP=_______ 。
②同一温度下图象呈线性变化的理由是_______ 。
(1)2NO(g)+O2(g)⇌2NO2(g)的反应历程由下列①②两步基元反应组成,相关信息如下:(E为活化能,v为反应速率,k为速率常数)
①2NO(g)
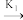 N2O2(g) E正= 82 kJ·mol-1v = klc2(NO)
N2O2(g) E正= 82 kJ·mol-1v = klc2(NO)N2O2(g)
 2NO(g) E逆= 205 kJ·mol-1v = k2c(N2O2)
2NO(g) E逆= 205 kJ·mol-1v = k2c(N2O2)②N2O2(g)+O2(g)
 2NO2(g) E正= 82 kJ·mol-1v= k3c(N2O2)·c(O2)
2NO2(g) E正= 82 kJ·mol-1v= k3c(N2O2)·c(O2)2NO2(g)
 N2O2(g)+O2(g) E逆= 72 KJ·mol-1v = k4c2(NO2)
N2O2(g)+O2(g) E逆= 72 KJ·mol-1v = k4c2(NO2)则:2NO(g)+O2(g)⇌2NO2(g)△H=
(2)2SO2(g)+O2(g)⇌2SO3(g)反应过程中能量变化如图1所示。

①在V2O5存在时,该反应的机理为:
V2O5+ SO2=2VO2+SO3(快)
②下列说法正确的是
a.V2O5的质量或形状不影响反应速率
b.有催化剂存在时∣△H∣<198 kJ·mol-l
c.增大O2的浓度可显著提高反应速率
(3)已知反应NO2(g)+SO2(g)⇌NO(g)+SO3(g)△H <0,某研究小组研究不同温度T1℃、T2℃下的平衡态中lg p(NO2)和lg p(SO3)两个压强对数的关系如图2所示,实验初始时体系中的p( NO2)和p(SO2)相等、p(NO)和p(SO3)相等。
①T1
②同一温度下图象呈线性变化的理由是
您最近一年使用:0次
名校
6 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应以回收S,物质循环转化过程如图所示。下列叙述正确的是
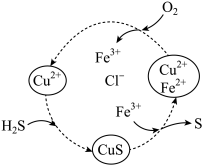

| A.设计循环的目的是降低活化能,减慢总反应速率 |
| B.循环转化过程中有置换反应发生 |
| C.能循环利用的物质只有CuCl2 |
| D.若1mol H2S发生图示转化的同时消耗0.4 molO2,则混合液中Fe3+浓度将减小 |
您最近一年使用:0次
2021-01-15更新
|
182次组卷
|
2卷引用:广东省东莞市东华高级中学2021届高三上学期第二次月考化学试题
7 . 合理处理碳、氮氧化物,减少在大气中的排放,在生产、生活中有重要意义。回答下列问题:

(1)利用H2还原CO2是减少CO2排放的一种方法。H2在Cu-ZnO催化下可与CO2同时发生反应I、II,两反应的反应过程与能量的关系如图所示。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
由图可知反应I是_________ 反应(填“吸热”或“放热”),ΔH1_________ ΔH2(填“>”、“<”或“=”)。
(2)H2还可以将CO2还原为CH4(g)和H2O(l)。已知25℃、101 kPa时H2和CH4的燃烧热分别为285.8 kJ·mol-1和890.3 kJ·mol-1,则25℃、101 kPa时H2与CO2反应生成CH4(g)和H2O(l)的热化学方程式为__________________ 。
(3)利用反应II生成的CO可将N2O转化为N2,反应的能量变化及反应历程如图所示,依次进行两步反应的化学方程式分别为①N2O+Fe+=N2+FeO+(慢),②FeO++CO=CO2+Fe+(快)。

反应过程中的中间产物是______________ ,每转化22.4 L(标准状况)N2O转移电子的数目为______________ ,反应①和反应②的活化能Ea①_________ Ea②(填“>”或“<”)。

(1)利用H2还原CO2是减少CO2排放的一种方法。H2在Cu-ZnO催化下可与CO2同时发生反应I、II,两反应的反应过程与能量的关系如图所示。
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2由图可知反应I是
(2)H2还可以将CO2还原为CH4(g)和H2O(l)。已知25℃、101 kPa时H2和CH4的燃烧热分别为285.8 kJ·mol-1和890.3 kJ·mol-1,则25℃、101 kPa时H2与CO2反应生成CH4(g)和H2O(l)的热化学方程式为
(3)利用反应II生成的CO可将N2O转化为N2,反应的能量变化及反应历程如图所示,依次进行两步反应的化学方程式分别为①N2O+Fe+=N2+FeO+(慢),②FeO++CO=CO2+Fe+(快)。

反应过程中的中间产物是
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比率。 |
| B.光辐照不可以改变化学反应速率 |
| C.有些反应速率极高,温度对其反应速率几乎没有什么影响时,反映了其活化能非常高 |
| D.在工业上合成氨的反应中,通过催化剂来提高该反应的平衡转化率 |
您最近一年使用:0次
10-11高二上·广东梅州·阶段练习
名校
解题方法
9 . 下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子百分数,使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子个数,从而使反应速率增大 |
| C.升高温度,能增加反应物分子中活化分子百分数,使化学反应速率增大 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
您最近一年使用:0次
2021-01-08更新
|
525次组卷
|
53卷引用:2010年广东省梅州市曾宪梓中学高二10月考化学
(已下线)2010年广东省梅州市曾宪梓中学高二10月考化学(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年江西省新余九中高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省苏州五中高二第二学期期中考试化学试卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(已下线)2012-2013学年江西省赣州市十一县(市)高二上学期期中联考化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷(已下线)2015届福建省八县一中高二上学期半期联考化学试卷2015-2016学年内蒙古包头九中高一6月月考化学试卷江西省南昌市八一中学、洪都中学、麻丘高中等六校2017-2018学年高二10月联考化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考内蒙古巴彦淖尔市第一中学2017-2018学年高二上学期期中考试(A卷)化学试题安徽省定远重点中学2017-2018学年高二上学期期末考试化学试题【全国百强校】天津市静海县第一中学2018-2019学年高二上学期9月学生学业能力调研化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高二上学期9月月考化学试题甘肃省武威市第十八中2018-2019学年高二上学期第一次月考化学试题内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期期中考试化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题吉林省白山市抚松六中2019-2020学年高二上学期第一次月考化学试卷宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第一次阶段考试化学试题吉林省长春市吉林省实验中学2019-2020学年高二上学期期中考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期第一次月考化学试题吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高二上学期第一次阶段考试化学试题吉林省吉林市顶级名校2019-2020学年高二上学期12月月考化学考试题浙江省浙东北联盟(ZDB)2019-2020学年高二上学期期中考试化学试题湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高二上学期10月月考化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——影响化学反应速率的因素(强化练习)新疆阿克苏市实验中学2019-2020学年高二上学期第一次月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2020届高三上学期第二次月考化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第一节 化学反应速率 方法帮陕西省渭南市澄城县城关中学2020-2021学年高二上学期第一次月考化学试题四川省仁寿第一中学校南校区2020-2021学年高二10月月考理综化学试题浙江省宁波诺丁汉大学附属中学2020-2021学年高二上学期10月月考化学试题(已下线)【浙江新东方】43人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时3 活化能福建省泉州市泉港区第一中学2020-2021学年高二上学期期中考试化学试题内蒙古巴彦淖尔市临河三中2020-2021学年高二10月考化学试题宁夏回族自治区石嘴山市平罗县平罗中学2020-2021学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2020-2021学年高二上学期期中考试化学试题湖南省雅礼中学2020-2021学年高二上学期第三次月考化学试题福建省莆田第二中学2020-2021学年高二上学期期中考试化学试题天津市新华中学2020-2021学年高二上学期第一次月考化学试题山东省曲阜市第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古北京四中呼和浩特分校2021-2022学年高二上学期第一次月考化学试题安徽省亳州市第二中学2021-2022学年高二上学期第一次月考化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期第一次月考化学试题辽宁省葫芦岛市第八高级中学2021-2022学年高二上学期实验班第一次月考化学试题
10 . 汽车尾气处理存在反应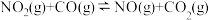 ,该反应过程及能量变化如图所示。下列说法错误的是
,该反应过程及能量变化如图所示。下列说法错误的是
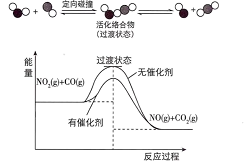
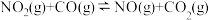 ,该反应过程及能量变化如图所示。下列说法错误的是
,该反应过程及能量变化如图所示。下列说法错误的是
| A.升高温度,平衡逆向移动 |
| B.反应物转化为活化络合物需要吸收能量 |
C.该反应生成了具有非极性共价键的 |
| D.使用催化剂可以降低活化能,加快反应速率 |
您最近一年使用:0次



