名校
解题方法
1 . 一定条件下,某可逆反应在密闭容器中建立化学平衡,在 时刻改变某一个条件,建立新的平衡,其
时刻改变某一个条件,建立新的平衡,其 图像如下:
图像如下:
A.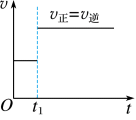 B.
B.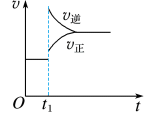
C.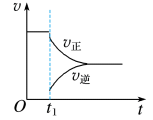 D.
D.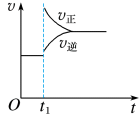
(1)对于反应: ,
, 时刻增大压强,其图像为
时刻增大压强,其图像为___________ ,平衡___________ (填“向正反应方向”“向逆反应方向”或“不”,下同)移动。
(2)对于反应 ,
, 时刻增大容器体积,其图像为
时刻增大容器体积,其图像为___________ ,平衡___________ 移动。
 时刻改变某一个条件,建立新的平衡,其
时刻改变某一个条件,建立新的平衡,其 图像如下:
图像如下:A.
 B.
B.
C.
 D.
D.
(1)对于反应:
 ,
, 时刻增大压强,其图像为
时刻增大压强,其图像为(2)对于反应
 ,
, 时刻增大容器体积,其图像为
时刻增大容器体积,其图像为
您最近一年使用:0次
名校
2 . 一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以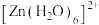 的形式存在,并存在电离平衡
的形式存在,并存在电离平衡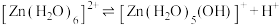 。下列说法错误的是
。下列说法错误的是
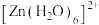 的形式存在,并存在电离平衡
的形式存在,并存在电离平衡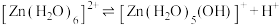 。下列说法错误的是
。下列说法错误的是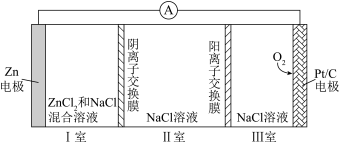
A.放电时,Ⅰ室溶液中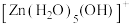 浓度增大 浓度增大 |
B.放电时,Ⅱ室中的 通过阴离子交换膜进入Ⅰ室 通过阴离子交换膜进入Ⅰ室 |
C.充电时, 电极的电极反应为 电极的电极反应为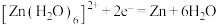 |
D.充电时,每生成 ,Ⅲ室溶液质量理论上减少 ,Ⅲ室溶液质量理论上减少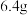 |
您最近一年使用:0次
2023-10-29更新
|
1899次组卷
|
7卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期12月月考化学试卷
新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期12月月考化学试卷山东省济宁市微山县第二中学2023-2024学年高三上学期第三次月考化学试题广西北海市2024届高三一模考试化学试题(已下线)热点14 电化学及其应用(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题海南省海口市海南中学2023-2024学年高二下学期4月期中考试化学试题
名校
3 . 在密闭容器中进行如下反应: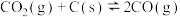
 ,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加 ,则平衡
,则平衡___________ (填“逆向移动”“正向移动”或“不移动”,下同)
(2)保持温度不变,增大反应容器的容积,则
___________ (填“增大”“减小”或“不变”,下同)。
(3)保持反应容器的容积和温度不变,通入He,则平衡___________ 。
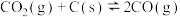
 ,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。(1)增加
 ,则平衡
,则平衡(2)保持温度不变,增大反应容器的容积,则

(3)保持反应容器的容积和温度不变,通入He,则平衡
您最近一年使用:0次
11-12高二上·山西吕梁·阶段练习
名校
解题方法
4 . “生态马路”运用“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述正确的是
| A.使用光催化剂不改变反应速率 |
| B.使用光催化剂能提高NO的转化率 |
| C.升高温度能加快反应速率 |
| D.改变压强对反应速率无影响 |
您最近一年使用:0次
2023-10-21更新
|
122次组卷
|
25卷引用:新疆自治区生产建设兵团第一师高级中学2018-2019学年高二上学期第二次月考化学试题
新疆自治区生产建设兵团第一师高级中学2018-2019学年高二上学期第二次月考化学试题(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012年湖南省浏阳一中高二上学期段考化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷河北省保定一中2019-2020学年上学期高三第二次阶段考试化学试题重庆市云阳江口中学校2020届高三上学期第三次月考化学试题湖南省长郡中学2022-2023学年高二上学期第一次月考化学试题甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期第一次月考化学试题广东省江门市培英高级中学2022-2023学年高二上学期10月月考化学试题辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题四川省自贡市第一中学校2023-2024学年高二上学期10月月考化学试题(已下线)2011-2012学年四川省成都市六校协作体高二下学期期中联考化学试卷(已下线)2012-2013学年湖北荆门高二上学期期末教学质量检测化学试卷辽宁省师范大学附属中学2018届高三上学期期中考试化学试题辽宁师大附中2017-2018学年第一学期期中考试高三化学试卷(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》(已下线)考点08 化学反应速率及其影响因素-2020年高考化学命题预测与模拟试题分类精编江苏省响水中学2019-2020学年高二下学期期中考试化学(选修)试题(已下线)练习6 影响化学反应速率的因素-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)西藏自治区拉萨市那曲第二高级中学2019-2020学年高一下学期期末考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题(已下线)第18讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 化学反应速率及其影响因素
名校
5 . 氢能是一种极具发展潜力的清洁能源。以下反应是目前大规模制取氢气的重要方法之一: 
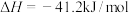
(1)欲提高CO的平衡转化率,理论上可以采取的措施为___________。
(2)已知在800K时,反应: ,若初始浓度
,若初始浓度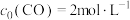 ,
, ,则反应达到平衡时,CO转化成
,则反应达到平衡时,CO转化成 的转化率为60%。求: 800K时该反应的平衡常数
的转化率为60%。求: 800K时该反应的平衡常数___________ 。

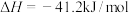
(1)欲提高CO的平衡转化率,理论上可以采取的措施为___________。
| A.增大压强 | B.升高温度 | C.加入催化剂 | D.通入过量水蒸气 |
 ,若初始浓度
,若初始浓度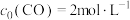 ,
, ,则反应达到平衡时,CO转化成
,则反应达到平衡时,CO转化成 的转化率为60%。求: 800K时该反应的平衡常数
的转化率为60%。求: 800K时该反应的平衡常数
您最近一年使用:0次
6 . 研究 、
、 、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(1)已知反应 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:
①若有1mol 生成,该反应
生成,该反应___________ (填“吸收”或“放出”)___________ kJ能量。
②一定温度下,在恒容的密闭容器中充入1molCO和2mol 发生上述反应,对于该反应,下列说法正确的是
发生上述反应,对于该反应,下列说法正确的是___________ (填序号)。
A.反应过程中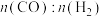 不变
不变
B.升高温度,正反应速率减小
C.往容器中充入He,压强增大,反应速率加快
D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡
(2)利用反应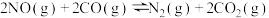 ,可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
,可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。

①X代表的物质是___________ ;a点正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
②从反应开始到达到平衡,
___________  ;该条件下,CO的平衡转化率为
;该条件下,CO的平衡转化率为___________ 。
(3)可用电化学原理处理 制备硫酸,装置图如图所示,电极为多孔材料。电极M为
制备硫酸,装置图如图所示,电极为多孔材料。电极M为___________ 极;写出N极的电极方程式:___________ 。

 、
、 、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。(1)已知反应
 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:| 化学键 | H-H | C-O | C≡O(CO) | H-O | C-H |
E(kJ·mol ) ) | 436 | 343 | 1073 | 465 | 413 |
 生成,该反应
生成,该反应②一定温度下,在恒容的密闭容器中充入1molCO和2mol
 发生上述反应,对于该反应,下列说法正确的是
发生上述反应,对于该反应,下列说法正确的是A.反应过程中
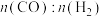 不变
不变B.升高温度,正反应速率减小
C.往容器中充入He,压强增大,反应速率加快
D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡
(2)利用反应
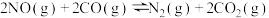 ,可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
,可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
①X代表的物质是
②从反应开始到达到平衡,

 ;该条件下,CO的平衡转化率为
;该条件下,CO的平衡转化率为(3)可用电化学原理处理
 制备硫酸,装置图如图所示,电极为多孔材料。电极M为
制备硫酸,装置图如图所示,电极为多孔材料。电极M为
您最近一年使用:0次
名校
7 . 为了探究反应条件对反应CO(g) + H2O(g) CO2(g)+H2(g);ΔH的影响,某活动小组设计了三个实验,实验曲线如图所示:
CO2(g)+H2(g);ΔH的影响,某活动小组设计了三个实验,实验曲线如图所示:
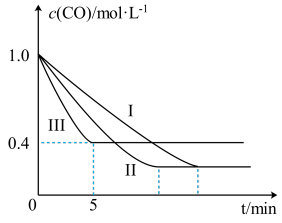
(1)请依据实验曲线图补充完整表格中的实验条件:x=___________ ,y=___________ 。
(2)实验Ⅲ从开始至平衡,平衡常数K=___________ 。
(3)对比实验Ⅱ和实验Ⅲ可知,升高温度,CO的转化率___________ (填“增大”“减小”或“不变”),ΔH___________ 0(填“>或“<”)。
(4)在530 C时,平衡常数K=1,若往1 L容器中投入0.4 mol CO(g)、0.1 mol H2O(g)、0.2 mol CO2(g)、0.2 mol H2(g),此时化学反应将___________ (填“向正反应方向”“向逆反应方向”或“不”)移动。
 CO2(g)+H2(g);ΔH的影响,某活动小组设计了三个实验,实验曲线如图所示:
CO2(g)+H2(g);ΔH的影响,某活动小组设计了三个实验,实验曲线如图所示: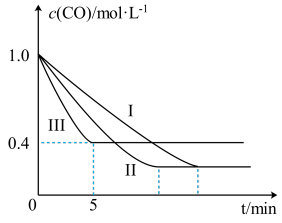
| 编号 | 温度 | 催化剂 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 无 | 1.0 mol/L | 3.0 mol/L |
| Ⅱ | x | 有 | y | 3.0 mol/L |
| Ⅲ | 630℃ | 有 | 1.0 mol/L | 3.0 mol/L |
(1)请依据实验曲线图补充完整表格中的实验条件:x=
(2)实验Ⅲ从开始至平衡,平衡常数K=
(3)对比实验Ⅱ和实验Ⅲ可知,升高温度,CO的转化率
(4)在530 C时,平衡常数K=1,若往1 L容器中投入0.4 mol CO(g)、0.1 mol H2O(g)、0.2 mol CO2(g)、0.2 mol H2(g),此时化学反应将
您最近一年使用:0次
名校
解题方法
8 . 氨是一种重要的化工原料和储氢材料。回答下列问题
(1)已知:
①
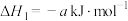 ;
;
②
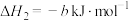 (其中,a、b均大于0)。
(其中,a、b均大于0)。
则

___________  。
。
(2)下列叙述正确的是___________(填代号)。
(3)氨在钨表面发生反应 ,速率方程为
,速率方程为 (k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时,
(k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时, 与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用
与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用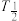 表示。
表示。

① 温度下,速率常数k=
温度下,速率常数k=___________ ;当起始浓度 时半衰期为
时半衰期为___________ min。
②温度:
___________ (填“>”“<”或“=”) 。
。
(4)工业生产中,合成氨宜选择450~500℃、20~50MPa,温度不低于450℃,压强不高于50MPa,其主要原因是___________ (从反应速率和平衡角度分析)。
(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入1mol 和3mol
和3mol (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。

①相对于乙,甲改变的条件是___________ (填代号)。
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在甲条件下,平衡时体积为0.5L,则该反应的平衡常数K为___________  (结果保留两位有效数字)。
(结果保留两位有效数字)。
(1)已知:
①

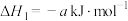 ;
;②

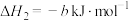 (其中,a、b均大于0)。
(其中,a、b均大于0)。则


 。
。(2)下列叙述正确的是___________(填代号)。
A.在合成氨中, |
B.在恒温恒容下1mol 和1mol 和1mol 制 制 ,当 ,当 体积分数不变时达到平衡 体积分数不变时达到平衡 |
C.在恒温恒压下合成氨,平衡后通入少量氩气, 的平衡转化率不变 的平衡转化率不变 |
| D.在恒温恒容下合成氨,平衡后通入少量氨气,逆反应速率增大且大于正反应速率 |
 ,速率方程为
,速率方程为 (k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时,
(k为速率常数,只与温度、催化剂有关),在钨催化作用下,不同温度和起始浓度时, 与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用
与时间关系如图所示,化学上,将物质的浓度衰变一半所用时间叫“半衰期”,用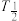 表示。
表示。
①
 温度下,速率常数k=
温度下,速率常数k= 时半衰期为
时半衰期为②温度:

 。
。(4)工业生产中,合成氨宜选择450~500℃、20~50MPa,温度不低于450℃,压强不高于50MPa,其主要原因是
(5)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入1mol
 和3mol
和3mol (合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中
(合成氨的反应是放热反应)。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
①相对于乙,甲改变的条件是
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在甲条件下,平衡时体积为0.5L,则该反应的平衡常数K为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次
2023-09-12更新
|
115次组卷
|
2卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
9 . 下列因素一定能引起化学平衡移动的是
| A.化学反应速率发生变化 |
| B.有气态物质参加的反应达到平衡后,改变压强 |
| C.反应体系的温度发生变化 |
| D.反应物或生成物的浓度发生变化 |
您最近一年使用:0次
2023-08-31更新
|
156次组卷
|
2卷引用:新疆生产建设兵团第二师八一中学2023-2024学年高二上学期第一次月考化学试题
10 . 改变压强,化学反应速率一定改变,平衡一定移动。(_____)
您最近一年使用:0次
2023-08-30更新
|
91次组卷
|
2卷引用:新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第一次月考化学试题



