解题方法
1 . 甘肃矿产资源丰富,镍、钴、铂等金属储量全国领先,有色金属冶炼在国民经济发展有着重要作用。利用紫硫镍铁矿石提取粗镍并回收铁、铜、钴等元素的工艺流程如下:
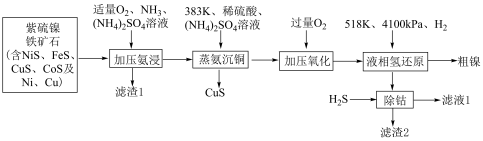
已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为: ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。
②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为___________ 。
(2)结合下列图表选择“加压氨浸”的最佳条件___________ 。

(3)“加压氨浸”过程中“加压”的目的是___________ 、___________ ;Cu发生反应的化学方程式为___________ 。
(4)“加压氧化”的目的是氧化残留的___________ (填离子符号)。
(5)“除钴”过程中发生反应的离子方程式为___________ 。
(6)流程中可以循环利用的物质有___________ (填化学式)。

已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为:
 ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为
(2)结合下列图表选择“加压氨浸”的最佳条件

(3)“加压氨浸”过程中“加压”的目的是
(4)“加压氧化”的目的是氧化残留的
(5)“除钴”过程中发生反应的离子方程式为
(6)流程中可以循环利用的物质有
您最近一年使用:0次
名校
解题方法
2 . 硫酸是一种重要的化工产品,目前的重要生产方法是“接触法”,反应原理为:2SO2+O2 2SO3,已知该反应为放热反应。则下列说法正确的是
2SO3,已知该反应为放热反应。则下列说法正确的是
 2SO3,已知该反应为放热反应。则下列说法正确的是
2SO3,已知该反应为放热反应。则下列说法正确的是| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C.由反应可知,2mol SO2的能量大于2mol SO3的能量 |
| D.工业在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
您最近一年使用:0次
2021-12-01更新
|
1075次组卷
|
7卷引用:甘肃省兰州第一中学2020-2021学年高一上学期期中考试化学试题
甘肃省兰州第一中学2020-2021学年高一上学期期中考试化学试题四川省内江市2021-2022学年高二上学期期末检测题化学试题(已下线)6.2.2 化学反应的限度-2021-2022学年高一化学课后培优练(人教版2019必修第二册)第六章 化学反应与能量(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)黑龙江省牡丹江市第一高级中学2022-2023学年高一下学期5月期中考试化学试题(已下线)第六章 化学反应与能量【单元测试A卷】6.2.2 化学反应的限度 课堂例题
名校
解题方法
3 . 关于合成氨工业的下列说法正确的是( )
| A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业效率都很低 |
B.由于 易液化, 易液化, 、 、 可循环使用,则总的说来,氨的产率很高 可循环使用,则总的说来,氨的产率很高 |
| C.合成氨工业的反应温度控制在400~500℃左右,目的是使平衡向正反应方向进行 |
D.合成氨工业采用 ,是因为该条件下催化剂的活性最好 ,是因为该条件下催化剂的活性最好 |
您最近一年使用:0次
2020-09-20更新
|
880次组卷
|
8卷引用:甘肃省兰州第一中学2022-2023学年高二上学期期中考试化学试题
甘肃省兰州第一中学2022-2023学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第四节 化学反应的调控(已下线)第六章 化学反应与能量(培优提升卷)-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)河南省通许县一中2022—2023年高二上学期第一次月考化学试题(已下线)课时5化学反应条件的控制第4节 化学反应条件的优化——工业合成氨
4 . 在加热、催化剤作用下2SO2(g)+O2(g) 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )
 2SO3(g)下列说法不正确的是( )
2SO3(g)下列说法不正确的是( )| A.在相同条件下,该反应中分别用SO2和O2表示的v,数值不同,但该反应的快慢程度是一致的 |
| B.该反应加入催化剂的目的是为了加快反应速率 |
| C.为了提高SO2的转化率,减少污染物的排放,常常在实际生产中,O2和SO2的投入量之比大于1:2 |
| D.在密闭容器中,投入2 mol SO2和l mol O2,反应结束时生成的2 mol SO3 |
您最近一年使用:0次
名校
解题方法
5 . 氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬绿的工艺流程如下:

已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式_________ 。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误 的是_____ (填标号)。
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
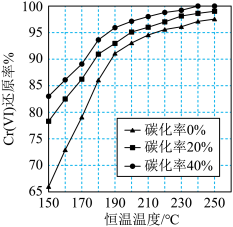
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_________ 。
(4)滤液中所含溶质为_______ 。该水热法制备氧化铬绿工艺的优点有_________ 、________ (请写出两条)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=_________ 。
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为_________ 。

已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法
A 该反应一定无需加热即可进行 B 必要时可使用冷却水进行温度控制
C 铬酸钠可适当过量,使淀粉充分反应 D 应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如下图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为

(4)滤液中所含溶质为
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[Cr(OH)3·nH2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,质量损失与固体残留质量比为9:19,经计算得出n=
(6)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为
您最近一年使用:0次
2020-03-13更新
|
697次组卷
|
4卷引用:甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题
甘肃省兰州市第一中学2020届高三冲刺模拟考试(三)理科综合化学试题广东省深圳市2020年普通高中高三年级线上统一测试(全国I卷)理综化学试题湖北省黄冈中学2020届高三化学测试(已下线)学科网2020年5月高三大联考考后强化卷(新课标Ⅰ卷)化学试题
解题方法
6 . SO2 是危害最为严重的大气污染物之一,SO2 的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理 SO2。催化还原 SO2 不仅可以消除 SO2 污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为__________ 。
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为______ 写化学式),0~t1 时间段的温度为_____ ,0~t1 时间段用SO2 表示的化学反应速率为_____ 。
②总反应的化学方程式为____________ 。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:

①分析可知X 为
②总反应的化学方程式为
您最近一年使用:0次
名校
7 . 冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a火烧孔雀石炼铜;b湿法炼铜;现代有:c铝热法炼铁;d光卤石法炼镁。对它们的冶炼方法分析不正确的是
| A.a② | B.b③ | C.c④ | D.d⑤ |
您最近一年使用:0次
2018-08-23更新
|
645次组卷
|
27卷引用:【全国百强校】甘肃省兰州第一中学2017-2018学年高一下学期期末考试化学试题
【全国百强校】甘肃省兰州第一中学2017-2018学年高一下学期期末考试化学试题(已下线)09-10年河南方城二高高一下学期期末化学卷(已下线)2011-2012学年陕西省宝鸡中学高一下学期期中考试化学试卷(已下线)2012-2013学年四川省成都七中高一下学期期末考试化学试卷(已下线)2014年高二化学苏教版选修2 2.4镁和铝的冶炼练习卷(已下线)2013-2014辽宁省五校第二学期期末联考高一化学试卷2015届浙江省诸暨中学高三上学期期中化学试卷2015届广西玉林市博白县高三下学期返校调研考试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2016-2017学年湖北省黄冈市蕲春县高一下学期期中考试化学试卷陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题广西桂林市桂林中学2016-2017学年高一下学期期中考试化学试题湖北省蕲春县2016-2017学年高一下学期期中考试化学试题广东省佛山市超盈实验中学2016-2017学年高一下学期期末模拟化学试题广东省仲元中学2016-2017学年高一下学期期末考试(理)化学试题山西省太原市黄陵中学高新部2017-2018学年高二上学期开学考化学试题湖北省黄冈中学2016-2017学年高一下学期期中考试化学试题【全国百强校】广东仲元中学2017-2018学年高二下学期期中考试化学(文)试题云南省建水县民中2017-2018学年高一下学期6月份考试化学试题2019年高考化学一轮复习《化学与自然资源的开发利用》专题同步练习卷黑龙江省青冈县一中2018-2019学年高二上学期开学考试化学试题甘肃省武威市第一中学2019届高三上学期10月月考化学试题(已下线)2018年11月2日 《每日一题》一轮复习-金属矿物的开发利用(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第4讲 金属材料与矿物 铜及其化合物 (教学案)安徽省郎溪县郎溪中学2018-2019学年高一下学期第一次月考化学试题甘肃省武威第一中学2019-2020学年高二10月月考化学试题福建省泉州第五中学2020-2021学年高一下学期期中考试化学试题
名校
8 . 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
2018-01-19更新
|
2031次组卷
|
10卷引用:甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题
甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题广东省佛山市普通高中2018届高三教学质量检测(一)化学试题河北省衡水中学2018届高三第十五次模拟理科综合化学试题【全国百强校】河南省林州市第一中学2017-2018学年高二5月月考化学试题【全国百强校】河南省信阳高级中学2018届高三第四次模拟考试化学试题山西省大同市第二中学2020届高三3月月考理综化学试题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题2021年天津高考化学试题变式题13-162020届高三化学二轮冲刺新题专练——化学反应原理综合题
名校
9 . 硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产.下列对于反应 2SO2+O2  2SO3的说法中正确的是
2SO3的说法中正确的是
 2SO3的说法中正确的是
2SO3的说法中正确的是| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
| C.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| D.在达到平衡的体系中,充入由18O原子组成的O2后,18O仅存在于SO2和SO3中 |
您最近一年使用:0次
2017-05-05更新
|
300次组卷
|
4卷引用:甘肃省兰州交大东方中学2019-2020学年高二上学期期中考试化学试题
甘肃省兰州交大东方中学2019-2020学年高二上学期期中考试化学试题江西省九江第一中学2016-2017学年高一下学期期中考试化学试题(已下线)2.4 化学反应的调控(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)天津市宝坻九中2020-2021学年高二上学期第一次月考化学试题
10-11高三上·甘肃兰州·期中
10 . 在给定条件下,下列加点的物质在化学反应中能被完全消耗的是
| A.向100 mL 3 mol·L—1的硝酸中加入5.6g铁 |
| B.标准状况下,将1g铝片投入20 mL 18.4mol·L—1的硫酸中 |
| C.用50mL 8 mol·L—1浓盐酸与10g二氢化锰共热制取氯气 |
| D.在5×l07Pa、500℃和铁触媒催化的条件下,用氢气和氢气合成氨 |
您最近一年使用:0次



