名校
1 . 能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为______________ ;该反应在________ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________ (填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是_____ ;

④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________ (MPa)-2(小数点后保留2位小数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。请写出负极的电极反应为_______________ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下的平衡常数大小关系是K1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。请写出负极的电极反应为
您最近一年使用:0次
2020-05-03更新
|
96次组卷
|
2卷引用:陕西省榆林市绥德县绥德中学2019-2020高二下学期第一次阶段性测试化学试题
名校
2 . 在密闭容器中发生如下反应:mA(g) + nB(g) ⇌ pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 ( )
| A.平衡向逆反应方向移动 | B.m + n > p |
| C.A的转化率降低 | D.B的体积分数增加 |
您最近一年使用:0次
2020-04-30更新
|
87次组卷
|
2卷引用:陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题
名校
3 . 在一密闭容器中,反应mA(g)+nB(s)=3C(g)达到平衡时,测得c(A)为0.5 moL/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)为 0.3moL/L则下列判断不正确的是( )
| A.混合气体密度一定减小 | B.平衡一定向逆反应方向移动 |
| C.化学计量数:m+n<3 | D.物质C的体积分数减小了 |
您最近一年使用:0次
名校
4 . 对于可逆反应N2(g)+3H2(g)=2NH3(g)∆H<0.下列说法中正确的是( )
| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的小 |
| B.达到平衡后,升高温度,既加快了正,逆反应速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器体积,既有利于加快正,逆反应速率,又有利于提高 氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应 速率减小了 |
您最近一年使用:0次
2020-03-29更新
|
135次组卷
|
5卷引用:陕西省渭南市瑞泉中学2019-2020学年高二上学期第一次月考化学试题
陕西省渭南市瑞泉中学2019-2020学年高二上学期第一次月考化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)第四节 化学反应的调控第4节 化学反应条件的优化——工业合成氨(已下线)专题06 化学反应的方向及调控【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
解题方法
5 . NO、NO2是大气污染物,但只要合理利用,NO、NO2也是重要的资源。回答下列问题:
(1)氨的合成。已知:N2和H2生成NH3的反应为: N2(g)+
N2(g)+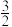 H2(g)
H2(g) NH3(g) ΔH=-46.2kJ·mol-1
NH3(g) ΔH=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(※表示吸附态):
化学吸附:N2(g)→2N※;H2(g) 2H※;
2H※;
表面反应:N※+H※ NH※;NH※+H※
NH※;NH※+H※ NH2※;NH2※+H※
NH2※;NH2※+H※ NH3※;
NH3※;
脱附:NH3※ NH3(g)
NH3(g)
其中N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。则利于提高合成氨平衡产率的条件有( )
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)NH3还原法可将NO还原为N2进行脱除。已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-1530kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
写出NH3还原NO的热化学方程式__ 。
(3)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是__ (填字母代号)。

a.温度 b.压强 c.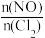 d.与催化剂的接触面积
d.与催化剂的接触面积
(4)在密闭容器中充入4molCO和5molNO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
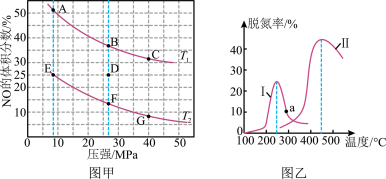
①温度T1__ T2(填“>”或“<”)。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,则重新达到平衡时,D点应向图中A~G点中的__ 点移动。
③探究催化剂对CO、NO转化的影响。某研究小组将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图乙所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为__ ;a点__ (填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由__ 。
(1)氨的合成。已知:N2和H2生成NH3的反应为:
 N2(g)+
N2(g)+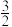 H2(g)
H2(g) NH3(g) ΔH=-46.2kJ·mol-1
NH3(g) ΔH=-46.2kJ·mol-1在Fe催化剂作用下的反应历程为(※表示吸附态):
化学吸附:N2(g)→2N※;H2(g)
 2H※;
2H※;表面反应:N※+H※
 NH※;NH※+H※
NH※;NH※+H※ NH2※;NH2※+H※
NH2※;NH2※+H※ NH3※;
NH3※;脱附:NH3※
 NH3(g)
NH3(g)其中N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。则利于提高合成氨平衡产率的条件有
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)NH3还原法可将NO还原为N2进行脱除。已知:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-1530kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+180kJ·mol-1
写出NH3还原NO的热化学方程式
(3)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)
 2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
2ClNO(g) △H<0。平衡后,改变外界条件X,测得NO的转化率α(NO)随X的变化如图所示,则条件X可能是
a.温度 b.压强 c.
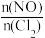 d.与催化剂的接触面积
d.与催化剂的接触面积(4)在密闭容器中充入4molCO和5molNO发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H=-746.5kJ•mol-1,如图甲为平衡时NO的体积分数与温度、压强的关系曲线图。
①温度T1
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,则重新达到平衡时,D点应向图中A~G点中的
③探究催化剂对CO、NO转化的影响。某研究小组将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图乙所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为
您最近一年使用:0次
名校
解题方法
6 . 下列事实不能用勒夏特列原理解释的是
A.对于2HI(g) H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
| B.合成氨反应中为提高氨的产率,理论上应采取降低温度的措施 |
| C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释 |
| D.用饱和食盐水可以去除Cl2中的HCl |
您最近一年使用:0次
2020-03-03更新
|
131次组卷
|
3卷引用:陕西省渭南市大荔县2019-2020学年高二上学期期末教学质量检测化学试题
名校
7 . 冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=___ 。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是____ 。

A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___ 。
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)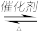 2CO2(g) +N2(g)
2CO2(g) +N2(g)
①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=___ ;反应达到平衡状态时,测得二氧化碳为0.8mol,则平衡时的压强为起始压强的__ 倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH__ 0(填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是__ (填编号)

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是

A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
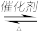 2CO2(g) +N2(g)
2CO2(g) +N2(g)①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=
②该反应在低温下能自发进行,该反应的ΔH
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
您最近一年使用:0次
2019-12-10更新
|
195次组卷
|
2卷引用:陕西省宝鸡中学、西安三中等五校2020届高三上学期第一次联考化学试题
8 . 现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中 C 的质量分数也减小,则:
(1)该反应的正反应为_____ 热反应,且 m+n_____ p(填“>”“=”“<”)。
(2)减压时,A 的质量分数_____ 。(填“增大”“减小”或“不变”,下同)
(3)恒温恒容时,若加入 B,则 A 的转化率_____ ,B 的转化率_____ 。
(4)若升高温度,则平衡时 c(B):c(C)的值将_____ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_____ 。
(6)保持体积不变,若 B 是有色物质,A、C 均无色,则加入 C 时混合气体颜色_ (填“变深”“变浅”或“不变”,下同)。
(7)若 B 是有色物质,压缩体积为原来的一半,则混合气体颜色_____ ,而维持容器内压强不变,充入氖气时,混合物颜色_____ 。
(1)该反应的正反应为
(2)减压时,A 的质量分数
(3)恒温恒容时,若加入 B,则 A 的转化率
(4)若升高温度,则平衡时 c(B):c(C)的值将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)保持体积不变,若 B 是有色物质,A、C 均无色,则加入 C 时混合气体颜色
(7)若 B 是有色物质,压缩体积为原来的一半,则混合气体颜色
您最近一年使用:0次
9 . 合成氨的反应为:3H2+N2 2NH3的叙述中,错误的是
2NH3的叙述中,错误的是
 2NH3的叙述中,错误的是
2NH3的叙述中,错误的是| A.该反应为可逆反应 |
| B.温度降低会使化学反应速率减慢 |
| C.该反应无法达到平衡状态 |
| D.加入催化剂有利于加快化学反应速率 |
您最近一年使用:0次
10 . 某温度下,在容积固定的密闭容器中,发生可逆反应A(g)+2B(g) 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()
 2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()
2C(g),平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是()| A.刚充入时反应速率:v(正)减小,v(逆)增大 |
| B.达到新的平衡时:反应混合物中A.B的物质的量分数不变 |
| C.达到新的平衡时:c(A):c(B):c(C)仍为1:1:2 |
| D.达到新的平衡过程中:体系压强先增大,后减小 |
您最近一年使用:0次



