1 . 一定条件下, 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下:不正确 的是
 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下: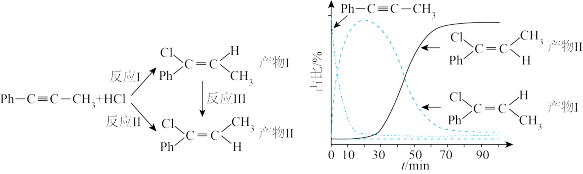
| A.反应焓变:反应I>反应Ⅱ |
| B.反应活化能:反应I<反应Ⅱ |
C.增加 浓度可增加平衡时产物Ⅱ和产物I的比例 浓度可增加平衡时产物Ⅱ和产物I的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近一年使用:0次
2023-06-21更新
|
7783次组卷
|
28卷引用:湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题
湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第23讲化学反应与热能(已下线)第26讲化学反应速率及影响因素(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江苏省扬州中学2023-2024学年高三上学期10月月考化学试题江苏省海安高级中学2023-2024学年高三上学期11月月考化学试题山东省实验中学2023-2024学年高三上学期11月二诊化学试题(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建陕西省西安中学2023-2024学年高三(实验版)上学期12月练考理科综合试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖北省沙市中学2023-2024学年高三下学期3月月考化学试题2024届南昌市第十九中学高三下学期模拟预测化学试题江西省南昌市八一中学2024届高三下学期三模测试化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)06-2023新东方高二上期中考化学10-2023新东方高二上期中考化学浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题
2 . 已知: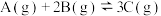
 ,向一恒温恒容的密闭容器中充入
,向一恒温恒容的密闭容器中充入 和
和 发生反应,
发生反应, 时达到平衡状态I,在
时达到平衡状态I,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
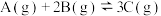
 ,向一恒温恒容的密闭容器中充入
,向一恒温恒容的密闭容器中充入 和
和 发生反应,
发生反应, 时达到平衡状态I,在
时达到平衡状态I,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
| A.容器内压强不变,表明反应达到平衡 |
B. 时改变的条件:向容器中加入C 时改变的条件:向容器中加入C |
C.平衡时A的体积分数 : :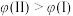 |
D.平衡常数K: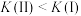 |
您最近一年使用:0次
2021-06-09更新
|
9321次组卷
|
49卷引用:2021年新高考湖南化学高考真题
2021年新高考湖南化学高考真题2021年湖南省高考化学试卷变式题11-19(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时38 化学平衡常规图像-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学平衡常数及转化率的计算(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省常德市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题12 化学反应速率与化学平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)秘籍07 化学反应速率及平衡图象剖析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题湖南省临湘市第五中学2021-2022学年高二上学期第三次月考化学试题湖南省郴州市永兴县童星学校2022-2023学年高二上学期9月月考化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题(已下线)专题09 化学反应速率与化学平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型124 突破化学反应速率和化学平衡图像题(已下线)专题15 化学平衡图像-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)题型23 平衡常数、平衡转化率图象(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点3 化学平衡常数及转化率的计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省周口恒大中学2023-2024学年高三下学期4月期中考试化学试题山东省临沂市沂水县第一中学2020-2021学年高二下学期期末检测化学试题河北省衡水中学2021-2022学年高二上学期8月份线上调研化学试题河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题广东省揭阳市普宁市华侨中学2021-2022学年高二下学期第三次月考化学试题第二章 综合拔高练贵州省黔东南州凯里市第一中学2022-2023学年高二上学期期中考试化学试题安徽省桐城中学2022-2023学年高二上学期月考(1)化学试题河南省郑州市2021-2022学年高二上学期期末考试化学试题(已下线)化学反应速率与化学平衡——进阶学习山东省青岛莱西市2022-2023学年高二上学期期中考试化学试题
名校
解题方法
3 . 已知,25℃时K2Cr2O7溶液中存在以下平衡:
①Cr2O (aq)+H2O(l)
(aq)+H2O(l) 2CrO
2CrO (aq)+2H+(aq) K1=3.27×10-15
(aq)+2H+(aq) K1=3.27×10-15
②Cr2O (aq)+H2O(l)
(aq)+H2O(l) 2HCrO
2HCrO (aq) K2=3.0×10-2
(aq) K2=3.0×10-2
③HCrO (aq)
(aq) CrO
CrO (aq)+H+(aq) K3
(aq)+H+(aq) K3
25℃时,0.1mol/LK2Cr2O7溶液中,lg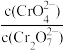 随pH的变化关系如图所示(lg3.27=0.52,10-0.78=0.17)。下列说法错误的是
随pH的变化关系如图所示(lg3.27=0.52,10-0.78=0.17)。下列说法错误的是
①Cr2O
 (aq)+H2O(l)
(aq)+H2O(l) 2CrO
2CrO (aq)+2H+(aq) K1=3.27×10-15
(aq)+2H+(aq) K1=3.27×10-15②Cr2O
 (aq)+H2O(l)
(aq)+H2O(l) 2HCrO
2HCrO (aq) K2=3.0×10-2
(aq) K2=3.0×10-2③HCrO
 (aq)
(aq) CrO
CrO (aq)+H+(aq) K3
(aq)+H+(aq) K325℃时,0.1mol/LK2Cr2O7溶液中,lg
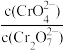 随pH的变化关系如图所示(lg3.27=0.52,10-0.78=0.17)。下列说法错误的是
随pH的变化关系如图所示(lg3.27=0.52,10-0.78=0.17)。下列说法错误的是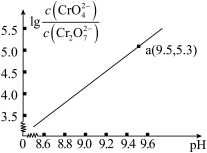
A.0.1mol/LK2Cr2O7溶液中,加入少量的HI气体,c(CrO )增大 )增大 |
| B.溶液颜色不再变化,可以判断该体系达到平衡 |
C.a点溶液中离子浓度关系:c(K+)>c(CrO )>c(Cr2O )>c(Cr2O )>c(H+) )>c(H+) |
D.反应③的化学平衡常数K3=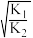 |
您最近一年使用:0次
2023-04-12更新
|
1290次组卷
|
8卷引用:湖南省2024届高三下学期高考仿真模拟卷(四)化学试题
湖南省2024届高三下学期高考仿真模拟卷(四)化学试题湘豫名校联考2022-2023学年高三上学期一轮复习诊断考试(二)化学试题(已下线)专题十二化学反应速率与平衡(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)仿真卷01-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2023年高考山东卷化学真题变式题(不定项选择题)黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(三)试题
名校
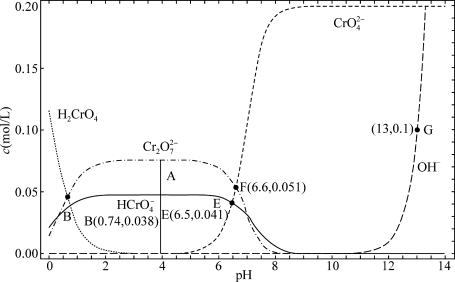
4 . 某温度下,改变0.1mol/L  溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
 溶液的pH时,各种含铬元素微粒及
溶液的pH时,各种含铬元素微粒及 浓度变化如图所示(已知
浓度变化如图所示(已知 是二元酸),下列有关说法中,正确的是
是二元酸),下列有关说法中,正确的是
A.该温度下的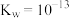 |
B.溶液中存在平衡 ,该温度下此反应的 ,该温度下此反应的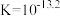 |
C.向0.1mol/L  溶液中加入一定量NaOH固体,溶液橙色变浅 溶液中加入一定量NaOH固体,溶液橙色变浅 |
D.E点溶液中存在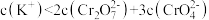 |
您最近一年使用:0次
5 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
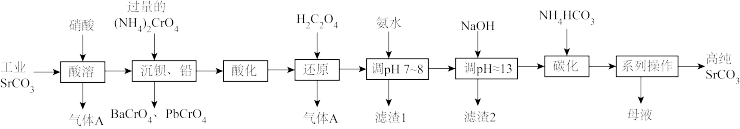
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1200次组卷
|
13卷引用:化学-2022年高考考前押题密卷(湖南卷)
(已下线)化学-2022年高考考前押题密卷(湖南卷)湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题湖南省邵阳市第一中学2023届高三第五次月考化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题
名校
6 .  的配位化合物较稳定且运用广泛。
的配位化合物较稳定且运用广泛。 可与
可与 、
、 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 与
与 、
、 的反应在溶液中存在以下平衡:
的反应在溶液中存在以下平衡:




下列说法不正确 的是
 的配位化合物较稳定且运用广泛。
的配位化合物较稳定且运用广泛。 可与
可与 、
、 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的 、红色的
、红色的 、黄色的
、黄色的 、无色的
、无色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: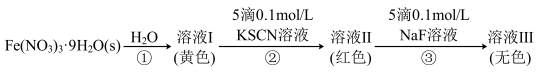
 与
与 、
、 的反应在溶液中存在以下平衡:
的反应在溶液中存在以下平衡:



下列说法
A.I中溶液呈黄色可能是由于 水解产物的颜色引起的 水解产物的颜色引起的 |
B.向溶液II中加入NaF后,溶液颜色变为无色,说明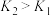 |
C.为了能观察到溶液I中 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
| D.向溶液III中加入足量的KSCN固体,溶液可能再次变为红色 |
您最近一年使用:0次
2023-01-09更新
|
822次组卷
|
8卷引用:湖南省岳阳市2022-2023学年高三下学期2月月考化学试题
名校
解题方法
7 .  的配位化合物较稳定且应用广泛。
的配位化合物较稳定且应用广泛。 可与
可与 、
、 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的 、红色的
、红色的 、无色的
、无色的 、黄色的
、黄色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的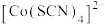 配离子;
配离子; 不能与
不能与 形成配离子。下列说法不正确的是
形成配离子。下列说法不正确的是
 的配位化合物较稳定且应用广泛。
的配位化合物较稳定且应用广泛。 可与
可与 、
、 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的 、红色的
、红色的 、无色的
、无色的 、黄色的
、黄色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: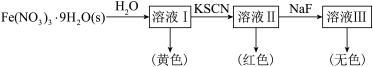
 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的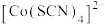 配离子;
配离子; 不能与
不能与 形成配离子。下列说法不正确的是
形成配离子。下列说法不正确的是A.Ⅰ中溶液呈黄色可能是由 水解产物的颜色造成 水解产物的颜色造成 |
| B.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色 |
C.可用NaF和KSCN溶液检验 溶液中是否含有 溶液中是否含有 |
D.为了能观察到溶液Ⅰ中 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
您最近一年使用:0次
2023-03-04更新
|
796次组卷
|
6卷引用:湖南省长沙市雅礼中学2023届高三模拟考试(一)化学试题
湖南省长沙市雅礼中学2023届高三模拟考试(一)化学试题天津市第一中学2022-2023学年高三下学期第四次月考化学试题(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)山东省德州市第一中学2022-2023学年高二下学期3月月考化学试题山东省德州市陵城区祥龙高级中学2022-2023学年高二下学期3月月考化学试题福建省南平市浦城第一中学2023-2024学年高二下学期4月期中考试化学试题
8 . 钯碳催化剂活性高、选择性好,在石油化工、精细化工和有机合成中占有举足轻重的地位。利用废钯碳催化剂回收钯(杂质主要含碳、有机物及少量Fe、Zn等)的工艺流程如图:
①钯常见的化合价有+2和+4价。钯容易形成配位化合物,如[Pd(NH3)4]Cl2、[Pd(NH3)2]Cl2、[H2Pd(NO3)4]。
②当有硝酸存在时,钯易与硝酸形成稳定的配位化合物。
回答下列问题:
(1)“焙烧”的目的是_____ 。
(2)“烧渣”的主要成分是PdO,利用水合肼(N2H4•H2O)在弱碱性环境下还原,产生可以参加大气循环的气体。该反应的化学方程式为_____ 。
(3)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdCl4,硝酸的还原产物为NO,该反应的化学方程式为_____ 。
(4)H2PdCl4溶液进行充分“浓缩赶硝”的原因是_____ 。
(5)“氨水络合”时需要控制溶液的pH,欲使溶液中的杂质金属离子沉淀完全,pH至少调节为_____ (保留三位有效数字)。(已知常温下Ksp[Fe(OH)3]=2.8×10-39,Ksp[Zn(OH)2]=2.0×10-16,lg2=0.3)
(6)用平衡移动原理解释盐酸将Pd(NH3)4]Cl2转化为Pd(NH3)2]Cl2沉淀的原因_____ 。
(7)海绵状金属钯密度为12.0g•cm-3,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,此条件下海绵钯的吸附容量R=_____ mL•g-1。

①钯常见的化合价有+2和+4价。钯容易形成配位化合物,如[Pd(NH3)4]Cl2、[Pd(NH3)2]Cl2、[H2Pd(NO3)4]。
②当有硝酸存在时,钯易与硝酸形成稳定的配位化合物。
回答下列问题:
(1)“焙烧”的目的是
(2)“烧渣”的主要成分是PdO,利用水合肼(N2H4•H2O)在弱碱性环境下还原,产生可以参加大气循环的气体。该反应的化学方程式为
(3)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdCl4,硝酸的还原产物为NO,该反应的化学方程式为
(4)H2PdCl4溶液进行充分“浓缩赶硝”的原因是
(5)“氨水络合”时需要控制溶液的pH,欲使溶液中的杂质金属离子沉淀完全,pH至少调节为
(6)用平衡移动原理解释盐酸将Pd(NH3)4]Cl2转化为Pd(NH3)2]Cl2沉淀的原因
(7)海绵状金属钯密度为12.0g•cm-3,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,此条件下海绵钯的吸附容量R=
您最近一年使用:0次
2023-04-02更新
|
778次组卷
|
2卷引用:2024届湖南省衡阳市第八中学高三下学期模拟预测化学试题
名校
解题方法
9 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含NiFe2O4、NiO、 FeO、 Al2O3)中回收镍并转化为NiSO4的流程如图所示: 
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式___________ 。
(3)使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是___________ 。
(4)①“萃取”时发生反应Mn+ + nRH MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与
MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与 的关系如下表所示,当
的关系如下表所示,当 =0.25时,水层中主要的阳离子为
=0.25时,水层中主要的阳离子为___________ 。
②物质X的化学式为___________ 。
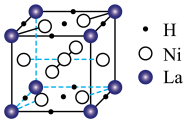
(5)镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=___________ 。
(6)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。

144.5g二丁二酮肟合镍分子内含有σ键___________ mol,碳碳键是由___________ 轨道重叠形成的。
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为
(2)“焙烧” 后金属元素以硫酸盐的形式存在,写出NiO与(NH4)2SO4反应的化学方程式
(3)使用95℃热水“溶解”后过滤,所得滤渣的主要成分的化学式是
(4)①“萃取”时发生反应Mn+ + nRH
 MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与
MRn+ nH+ (Mn+为金属离子,RH为萃取剂),萃取率与 的关系如下表所示,当
的关系如下表所示,当 =0.25时,水层中主要的阳离子为
=0.25时,水层中主要的阳离子为 萃取率/% | 0.1 | 0.15 | 0.2 | 0.25 | 0.3 | 0.35 | 0.4 |
| Ni2+ | 55% | 68% | 80% | 99% | 99.5% | 99.8% | 99.9% |
| Fe2+ | 2% | 2% | 4% | 5% | 8% | 30% | 58% |
(5)镧镍合金储氢后的晶胞如图所示,该化合物中原子个数比N([La) : N(Ni) : N(H)=

(6)Ni2+与丁二酮肟可形成鲜红色的二丁二酮肟合镍(M= 289 g·mol-1),结构如下图所示。

144.5g二丁二酮肟合镍分子内含有σ键
a. sp3和sp2 b. sp2和 sp2 c. sp2和p d. sp3和p
您最近一年使用:0次
2023-03-18更新
|
628次组卷
|
2卷引用:湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题
名校
解题方法
10 . 实验室以二氧化铺铈 废渣为原料制备
废渣为原料制备 ,其部分实验过程如下:
,其部分实验过程如下:
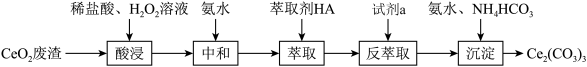
已知: 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为: (水层)
(水层) (有机层)
(有机层) (有机层)+
(有机层)+ (水层)。下列说法正确的是
(水层)。下列说法正确的是
 废渣为原料制备
废渣为原料制备 ,其部分实验过程如下:
,其部分实验过程如下:
已知:
 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为: (水层)
(水层) (有机层)
(有机层) (有机层)+
(有机层)+ (水层)。下列说法正确的是
(水层)。下列说法正确的是A.“酸浸”过程中 做氧化剂 做氧化剂 |
B.加氨水“中和”除去过量盐酸,主要目的是提高 的萃取率 的萃取率 |
| C.试剂a一定是盐酸 |
D.“沉淀”时反应的离子方程式为 |
您最近一年使用:0次
2023-03-29更新
|
627次组卷
|
4卷引用:湖南省岳阳市2023届高三下学期教学质量监测(二模)化学试题
湖南省岳阳市2023届高三下学期教学质量监测(二模)化学试题(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)化学-2023年高考押题预测卷03(辽宁卷)(含考试版、全解全析、参考答案、答题卡)福建省厦门第一中学2023届高三下学期第三次模拟测试化学试题



