名校
1 . 已知 呈粉红色,
呈粉红色,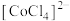 呈蓝色,
呈蓝色,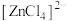 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: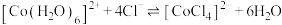 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色,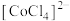 呈蓝色,
呈蓝色,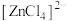 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: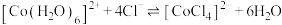 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和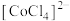 中 中 键数之比为 键数之比为 |
B.由实验1可推知 |
C.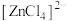 和 和 的配位数之比为 的配位数之比为 |
D.由实验③可知配离子的稳定性: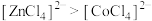 |
您最近半年使用:0次
名校
2 . 恒温恒容,可逆反应N2O4(g) 2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
 2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是| A.NO2的体积分数增大 | B.达新平衡后平衡体系压强比原平衡大 |
| C.平衡正向移动 | D.达新平衡后N2O4转化率降低 |
您最近半年使用:0次
3 . 工业上通过将 与氢气反应,实现碳中和。
与氢气反应,实现碳中和。
(1)已知反应 。根据理论计算,在恒压、起始物质的量之比
。根据理论计算,在恒压、起始物质的量之比 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
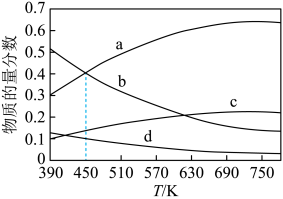
①该反应的平衡常数表达式为___________ ,该反应的
___________ 0(填“>”或“<”)。
②图中曲线b、c分别表示的是平衡时___________ 和___________ 的物质的量分数变化。
(2)用 和
和 合成
合成 的反应为
的反应为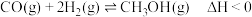 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。
在不同温度下的平衡转化率与压强的关系如图所示。

①图中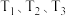 的大小关系为
的大小关系为___________ 。
②图中b、c、d点上正反应速率的关系为___________ 。
②图中a、b、d点上平衡常数的大小关系为___________ 。
(3)合成二甲醚:
反应Ⅰ:
反应Ⅱ: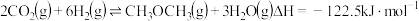
在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性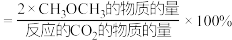 。
。

①温度高于 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是___________ 。
② 时,起始投入
时,起始投入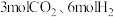 ,在催化剂作用下
,在催化剂作用下 与H2反应一段时间后,测得
与H2反应一段时间后,测得 平衡转化率为40%,
平衡转化率为40%, 的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗
的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗 的物质的量为
的物质的量为___________  。不改变反应时间和温度,一定能提高
。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有___________ 。
③合成二甲醚时较适宜的温度为 ,其原因是
,其原因是___________ 。
 与氢气反应,实现碳中和。
与氢气反应,实现碳中和。(1)已知反应
 。根据理论计算,在恒压、起始物质的量之比
。根据理论计算,在恒压、起始物质的量之比 条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
条件下,该反应达平衡时各组分的物质的量分数随温度变化的曲线如图所示。
①该反应的平衡常数表达式为

②图中曲线b、c分别表示的是平衡时
(2)用
 和
和 合成
合成 的反应为
的反应为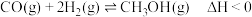 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。
在不同温度下的平衡转化率与压强的关系如图所示。
①图中
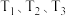 的大小关系为
的大小关系为②图中b、c、d点上正反应速率的关系为
②图中a、b、d点上平衡常数的大小关系为
(3)合成二甲醚:
反应Ⅰ:

反应Ⅱ:
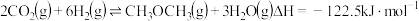
在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。其中:
的选择性随温度的变化如图所示。其中: 的选择性
的选择性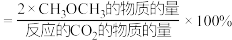 。
。
①温度高于
 ,
, 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②
 时,起始投入
时,起始投入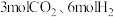 ,在催化剂作用下
,在催化剂作用下 与H2反应一段时间后,测得
与H2反应一段时间后,测得 平衡转化率为40%,
平衡转化率为40%, 的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗
的选择性为50%(图中A点),达到平衡时反应Ⅱ理论上消耗 的物质的量为
的物质的量为 。不改变反应时间和温度,一定能提高
。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有③合成二甲醚时较适宜的温度为
 ,其原因是
,其原因是
您最近半年使用:0次
4 . 某学习小组研究可逆反应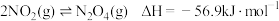 ,请回答下列问题。
,请回答下列问题。
(1)将一定量的 和
和 混合气体充入恒容密闭容器中,反应一段时间,能说明该反应达到化学平衡状态的是___________(填字母)。
混合气体充入恒容密闭容器中,反应一段时间,能说明该反应达到化学平衡状态的是___________(填字母)。
(2)将玻璃球分别浸泡在甲、乙两个烧杯中,向甲中加入 晶体,此烧杯中
晶体,此烧杯中 球的红棕色变浅,说明平衡
球的红棕色变浅,说明平衡 向
向___________ (填“正反应”或“逆反应”)方向移动,所以 晶体溶于水是
晶体溶于水是___________ (填“放热”或“吸热”)过程。
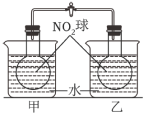
(3)将一定量的 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
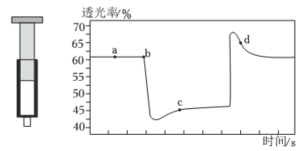
①b点的操作是___________ 注射器(填“压缩”或“拉伸”)。
②c点与a点相比,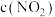
___________ ,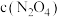
___________ (填“增大”或“减小”)。
③若不忽略体系温度变化,且没有能量损失,则温度
___________ 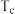 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
④d点的V(正)___________ V(逆)(填“>”、“<”或“=”)。
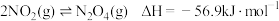 ,请回答下列问题。
,请回答下列问题。(1)将一定量的
 和
和 混合气体充入恒容密闭容器中,反应一段时间,能说明该反应达到化学平衡状态的是___________(填字母)。
混合气体充入恒容密闭容器中,反应一段时间,能说明该反应达到化学平衡状态的是___________(填字母)。| A.容器内气体颜色保持不变 |
B.单位时间内消耗 ,同时生成 ,同时生成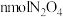 |
| C.容器内气体的压强不随时间变化 |
| D.容器内气体质量不随时间变化 |
 晶体,此烧杯中
晶体,此烧杯中 球的红棕色变浅,说明平衡
球的红棕色变浅,说明平衡 向
向 晶体溶于水是
晶体溶于水是
(3)将一定量的
 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。
①b点的操作是
②c点与a点相比,
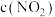
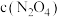
③若不忽略体系温度变化,且没有能量损失,则温度

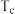 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。④d点的V(正)
您最近半年使用:0次
5 . 下列平衡移动方向和现象判断正确的是
A. ,加水,平衡逆向移动,溶液黄色变浅 ,加水,平衡逆向移动,溶液黄色变浅 |
B.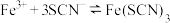 ,加入 ,加入 粉,平衡正向移动,气体颜色变浅 粉,平衡正向移动,气体颜色变浅 |
C.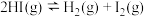 ,压缩容器体积,平衡不移动,气体颜色无变化 ,压缩容器体积,平衡不移动,气体颜色无变化 |
D. ,升高温度,溶液由蓝绿色变为黄绿色 ,升高温度,溶液由蓝绿色变为黄绿色 |
您最近半年使用:0次
名校
6 . 下列实验过程不能达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
| B | 证明压强对平衡移动产生影响 | 向充有NO2和N2O4混合气体的恒容透明密闭容器中充入氦气增大压强,观察现象 |
| C | 探究浓度对化学平衡的影响 | 试管中盛有0.1 mol·L−1 K2Cr2O7溶液,向其中滴加10滴6 mol·L−1 NaOH溶液,观察到溶液黄色加深 |
| D | 比较CdS(黄色)与CuS(黑色)的溶解度[已知Ksp(CdS)>Ksp(CuS)] | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-02-07更新
|
137次组卷
|
2卷引用:四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷
名校
7 . 下列事实能用平衡移动原理解释的是
A. 溶液中加入少量 溶液中加入少量 固体,促进 固体,促进 分解 分解 |
B.密闭烧瓶内的 和 和 的混合气体,压缩后颜色加深 的混合气体,压缩后颜色加深 |
| C.氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| D.碳酸钙的分解反应达平衡后,恒温条件下压缩容器,一段时间后,体系压强不变 |
您最近半年使用:0次
名校
8 . 下列有关速率和平衡说法正确的是
| A.已知反应:CaCO3(s)⇌CaO(s)+CO2(g),在密闭的反应炉内达到平衡后,若其他条件均不改变,将反应炉体积缩小一半,则达到新平衡时CO2(g)的浓度将升高 |
| B.H2、I2、HI平衡混合气体加压后颜色变深,能用勒夏特列原理解释 |
C.重铬酸钾溶液中存在: (橙色) (橙色) (黄色) (黄色) ,若滴加少量NaOH溶液,平衡正移,溶液由橙色变黄色 ,若滴加少量NaOH溶液,平衡正移,溶液由橙色变黄色 |
| D.使用正催化剂,改变了反应历程和∆H,降低了反应的活化能,增大了活化分子百分数,化学反应速率增大 |
您最近半年使用:0次
2023-11-21更新
|
121次组卷
|
2卷引用:四川省成都列五中学2023-2024学年高二上学期10月月考化学试题
9 . 恒容高压氢气氛围中CO在铑基催化剂表面主要发生反应为2CO(g)+4H2(g) C2H5OH(g)+ H2O(g),该反应的速率方程为
C2H5OH(g)+ H2O(g),该反应的速率方程为 = k c2(CO),其中k为速率常数,下列说法中错误的是
= k c2(CO),其中k为速率常数,下列说法中错误的是
 C2H5OH(g)+ H2O(g),该反应的速率方程为
C2H5OH(g)+ H2O(g),该反应的速率方程为 = k c2(CO),其中k为速率常数,下列说法中错误的是
= k c2(CO),其中k为速率常数,下列说法中错误的是| A.充入CO的量越多,平衡体系中C2H5OH的浓度越大 |
| B.在该体系中继续充入H2可提高反应速率 |
| C.在该体系中加入适量生石灰可提高反应物的平衡转化率 |
| D.对铑基催化剂进行改良可能会进一步提高催化效率 |
您最近半年使用:0次
10 . 目前,常用三元催化将汽车尾气中NO和CO转化为CO2和N2。在密闭容器中模拟进行如下反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
(1)增加CO的浓度,平衡向_______ 移动,该反应的平衡常数K_______ 。
(2)保持反应容器压强和温度不变,通入He,平衡向_______ 移动,该化学反应速率_______ ,该反应的△H_______ 。
(3)在一定温度下,缩小反应容器体积,平衡向_______ 移动,NO(g)的转化率_______ 。
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡_______ 移动,该化学反应速率将_______ 。
 2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。
2CO2(g)+N2(g) △H<0。达到平衡后,其他条件不变,分别改变下列条件。用“正反应方向”“逆反应方向”或“不”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断其他物理量变化情况。(1)增加CO的浓度,平衡向
(2)保持反应容器压强和温度不变,通入He,平衡向
(3)在一定温度下,缩小反应容器体积,平衡向
(4)使用相同质量的同种催化剂,增大催化剂的比表面积,平衡
您最近半年使用:0次
2023-11-05更新
|
260次组卷
|
2卷引用:四川省成都市彭州市2023-2024学年高二上学期期中考试化学试题



