1 . 处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g) CO2(g)+N2(g)ΔH,几种物质的相对能量如下:
CO2(g)+N2(g)ΔH,几种物质的相对能量如下:
①ΔH=______ kJ·mol-1;改变下列“量”,一定会引起ΔH发生变化的是____ 填代号)
A.反应物浓度B.催化剂C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:______ (写化学方程式)。第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应活化能____ 第一步反应活化能(填“大于”、“小于”或等于”)。
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g) 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
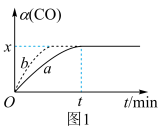
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是______ 。
②在此温度下,该可逆反应的平衡常数K=_____ (用含x的代数式表示)。
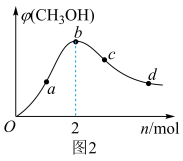
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250℃发生反应:CO(g)+2H2(g) CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___ 。
(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:______ 。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g)
 CO2(g)+N2(g)ΔH,几种物质的相对能量如下:
CO2(g)+N2(g)ΔH,几种物质的相对能量如下:| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量kJ·mol-1 | 475.5 | 283 | 0 | 393.5 |
①ΔH=
A.反应物浓度B.催化剂C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g)
 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是
②在此温度下,该可逆反应的平衡常数K=
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250℃发生反应:CO(g)+2H2(g)
 CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:
您最近一年使用:0次
2019-09-15更新
|
319次组卷
|
2卷引用:四川省内江市第六中学2021-2022年高三上学期第二次月考化学试题
名校
2 . 温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)  x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是

 x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
| A.x可能为4 |
| B.M为容器甲 |
| C.容器乙达平衡时B的转化率为25% |
| D.M的平衡常数大于N |
您最近一年使用:0次
2019-09-04更新
|
247次组卷
|
3卷引用:四川省绵阳市南山中学双语学校2020-2021学年高二下学期6月月考化学试题
名校
3 . 在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g) cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
 cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是| A.a+b=c | B.该变化使平衡正向移动 |
| C.B的转化率降低 | D.C的体积分数增大 |
您最近一年使用:0次
2019-07-04更新
|
1543次组卷
|
10卷引用:四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题
四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题黑龙江省齐齐哈尔市龙江二中2019-2020学年高二12月月考化学试题山西省太原市第五中学2020-2021学年高二上学期10月月考试题山东省滨州渤海中学2020-2021学年高二上学期10月月考化学试题新疆北屯高级中学2020-2021学年高二上学期10月月考化学试题辽宁省辽东南协作体2021-2022学年高二上学期第一次月考化学试题甘肃省临夏中学2019-2020学年高二上学期期中考试化学(理)试题吉林省吉林市第五十五中学2019-2020学年高二上学期期末考试化学试题河南省周口市扶沟县包屯高中2019---2020学年高二上期期末考试化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)
名校
解题方法
4 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
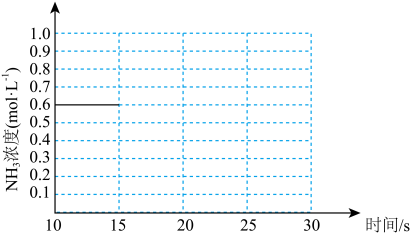
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近一年使用:0次
2019-02-07更新
|
473次组卷
|
3卷引用:四川省泸州市泸县第二中学2020届高三上学期第一次月考理综化学试题
名校
5 . 在一可变密闭容器中发生反应:2A(g) + B(g) xC(g),达到平衡时测得 A 的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的 2 倍,再次达平衡时,测得 A 的浓度为 0.2 mol/L。下列有关的判断正确的是
xC(g),达到平衡时测得 A 的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的 2 倍,再次达平衡时,测得 A 的浓度为 0.2 mol/L。下列有关的判断正确的是
 xC(g),达到平衡时测得 A 的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的 2 倍,再次达平衡时,测得 A 的浓度为 0.2 mol/L。下列有关的判断正确的是
xC(g),达到平衡时测得 A 的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的 2 倍,再次达平衡时,测得 A 的浓度为 0.2 mol/L。下列有关的判断正确的是| A.x = 3 | B.物质 C 的体积分数减小 |
| C.平衡向正反应方向移动 | D.物质 B 的转化率降低 |
您最近一年使用:0次
2018-11-13更新
|
464次组卷
|
5卷引用:四川省德阳市第五中学2018-2019学年高二上学期第四次(12月)月考化学试题
名校
6 . 合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
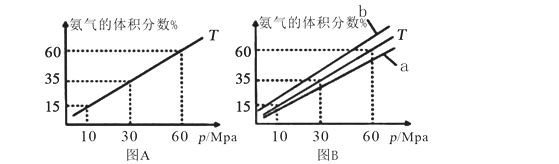
①图A中氨气的体积分数为15%时,H2的转化率为_______ 。
②图B中T=500℃,则温度为450℃时对应的曲线是_______ (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
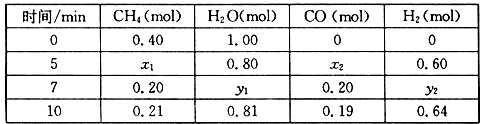
①分析表中数据,判断5 min时反应是否处于平衡状态?_____ (填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________ 。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________ 。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______ 。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105 Pa增加到5×105 Pa时,平衡______ 移动(填“正向、逆向或不”)。
②当压强为1×106 Pa时,此反应的平衡常数表达式为______________ 。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=500℃,则温度为450℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10 min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡
②当压强为1×106 Pa时,此反应的平衡常数表达式为
您最近一年使用:0次
2017-10-22更新
|
464次组卷
|
2卷引用:四川省成都市郫都区第一中学2017-2018学年高二上学期第一次月考化学试题
名校
7 . 利用催化技术可将汽车尾气中的 NO和 CO转变成CO2和N2,化学方程式:2NO(g)+2CO(g)  2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
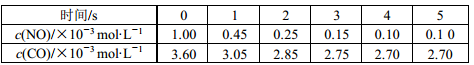
下列说法中不正确的是
 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
下列说法中不正确的是
| A.2 s内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1 |
| B.在该温度下,反应的平衡常数 K=5 |
| C.若将容积缩小为原来的一半, NO 转化率大于 90% |
| D.使用催化剂可以提高整个过程中 CO 和 NO 的处理量 |
您最近一年使用:0次
名校
8 . 下列反应不能用勒夏特例原理解释的是( )
| A.光照新制的氯水时 溶液的 pH逐渐减小 |
| B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快 |
| C.可用浓氨水和氢氧化钠固体快速制取氨气 |
| D.增大压强,有利于SO2和O2反应生成 SO3 |
您最近一年使用:0次
2017-10-20更新
|
555次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年高二上学期第一次月考化学试题
名校
9 . 已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
 N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
| A.b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深 |
| B.c点与a点相比,n(NO2)减小,混合气体密度增大 |
| C.d 点:v(正)<v(逆) |
D.若在注射器中对反应H2(g)+I2(g)  2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 |
您最近一年使用:0次
2017-02-28更新
|
322次组卷
|
3卷引用:四川省泸县第四中学2019-2020学年高二下学期第一次在线月考化学试题
10 . 恒容体系,发生如下反应2A(g) B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
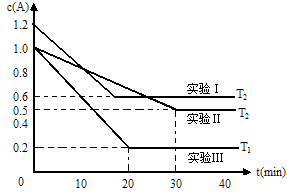
(1)在实验Ⅲ中,0~20min的时间内,v(B)=_______________ 。
(2)根据以上实验事实,完成以下填空:x=____________ ,生成物C的状态为____________ ,反应热△H________ 0(填“>”、“=”或者“<”)。
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是__________ 。
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K=_________ ,在T2℃时K的数值为_______ 。
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是______________ 。
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
 B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
(1)在实验Ⅲ中,0~20min的时间内,v(B)=
(2)根据以上实验事实,完成以下填空:x=
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K=
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
您最近一年使用:0次



